硝基乙腈钾合成1,2,4-三嗪氮杂稠环化合物的研究❋
陆婷婷 闫峥峰 汪营磊 李建康
西安近代化学研究所(陕西西安,710065)
引言
1,2,4-三嗪氮杂稠环化合物有着独特的生物活性,毒性低,内吸性高,常被用作医药和农药的结构组成单元,在医药和农药合成方面起着重要的作用[1-3]。 而高氮含量、可引入高能N—N 键和C—N键的优点,也使氮杂环化合物在含能材料领域受到持续关注[4-6]。 因此,简单、经济、高效地合成氮杂稠环化合物具有较为重要的研究意义。 硝基乙腈是合成氮杂稠环化合物的关键中间体,其结构为亚甲基上同时连接氰基和硝基两个强吸电子基团,使得亚甲基具有较好的反应活性。 使用硝基乙腈与α-氨基-1H-五元氮杂环化合物重氮盐在温和条件下发生偶联反应,再经过分子内环化后,可以生成含有邻位氨基/硝基的1,2,4-三嗪氮杂稠环化合物。 目前,该方法反应条件温和,操作方便,安全性高,是合成1,2,4-三嗪氮杂稠环化合物的重要研究方法[7-9]。Shreeve 曾利用硝基乙腈的活性亚甲基与重氮盐进行偶联反应,再经分子内环化,温和简便地合成了含能化合物4-氨基-3,7-二硝基-1,2,4-三唑[5,1-c]并1,2,4-三嗪(TTX)[10]。
常规制备硝基乙腈的方法是硝基甲烷在碱性条件下缩合制备中间体硝基乙醛肟,后者在乙醚溶液由二氯亚砜脱水后,在氩气保护下除去溶剂,经过柱分离得到产物[11-12]。 该方法的中间体硝基乙醛肟容易分解,且久置容易生成爆炸性产物,因此需要即用即制[13];二氯亚砜具有强刺激性和腐蚀性,遇水分解放出二氧化硫、氯化氢等刺激性气体。 由于氰基、硝基等强吸电基的存在,硝基乙腈的热稳定性较差,常温放置时容易分解,甚至发生燃烧或爆炸。 为了在不影响性能的前提下,提高硝基乙腈的稳定性,研究人员利用硝基乙腈的强吸电性,合成了硝基乙腈钾、硝基乙腈钠等相应的盐。 其中,硝基乙腈钾具有合成方法简单、稳定性高、污染性小等特点,是目前最常用代替硝基乙腈的盐。 Voinkov[14]于2016 年使用2-氰基-2-羟基亚氨基乙酸乙酯(NOCNEt)在碱性条件下经KMnO4氧化合成2-硝基-2-氰基乙酸乙酯钾(CNEAK),后者在KOH 的催化下水解得到硝基乙腈钾,硝基乙腈钾总产率为28.35%。 该方法制备的硝基乙腈钾稳定性比硝基乙腈高,可以稳定存在一定时间。 中间体CNEAK 的稳定性也高于硝基乙醛肟,常温放置不会分解。 但Voinkov 法存在着产率较低(总产率28.35%)、KMnO4用量较大[m(NOCNEt)∶m(KMnO4) =3.0∶4.5]、水解反应时间较长(常温下过夜)的缺点。
本文中,对Voinkov 法的条件进行了优化,重点考察了物料比、催化剂用量、反应温度和时间对反应产率的影响,确定了较佳的反应条件,将硝基乙腈钾的产率提高到37.71%。 使用硝基乙腈钾代替现制备的硝基乙腈,与4-氰基-5-氨基-1H-吲哚偶联反应、环化反应合成了新型氮杂稠环化合物3-硝基-4-氨基-7-氰基-[1,2,4]三唑[5,1-c][1,2,4]三嗪(AITX),并表征其结构,测试了性能,为1,2,4-三嗪氮杂稠环化合物的合成提供一种简便、高效的方法。
1 试验部分
1.1 试剂与仪器
NaNO2、浓硫酸、NH4Cl、NaOH、水合肼、浓盐酸、KMnO4、KOH、醋酸钠,成都市科龙化工试剂厂。
NEXUS 870 型FT-IR,美国Nicolet 公司;Vario EL-III型元素分析仪,德国Elementar公司;AV 500型超导核磁共振仪,瑞士Bruker公司;Finnigan TSQ Quantumultra AM 型质谱仪,美国Thermal 公司;LC-2010A型高效液相色谱仪(归一法),日本Shimadzu公司。
1.2 试验过程
1.2.1 CNEAK 的合成
将12.78 g(90 mmol)NOCNEt 溶于220 mL 水中,常温下滴加30 mL 的KOH(1 mol/L)溶液,滴加完毕后升温至30 ℃,分批加入9.48 g (0.06 mol)KMnO4,控制加料速度,反应液温度不超过40 ℃。滴加完毕后,在30 ℃反应,直至KMnO4消耗完毕(取样滴在滤纸上没有紫色斑点为终点)。 过滤除去MnO2后旋蒸浓缩(浴温低于40 ℃),冰乙醇洗涤固体,过滤。 用乙醇重结晶,得到白色固体11.67 g,产率66.16%。
1H NMR(CDCl3,500 MHz):δ =1.22 (s,3H),4.05 (s,2H)。 IR(KBr):v=2 211, 1 700, 1 367,1 337,1 292,1 222,1 089,1 015,772 cm-1。
C5H5N2O4K 元素分析: C 30. 61, H 2. 57, N 14.28; 实测值:C 30.41, H 2.76, N 14.17。
1.2.2 硝基乙腈钾的合成
将9.8 g (50 mmol)CNEAK 溶于40 mL KOH 溶液(1.25 mol/L)中,并在30 ℃反应4 h,溶液pH 值从14 降到9。 40 ℃以下旋蒸除去溶剂,得到的固体用50 mL 乙醇洗涤,过滤后滤饼用50 mL 甲醇常温萃取3 次,回流下萃取1 次,合并甲醇溶液,30 ℃以下旋蒸,旋蒸后的固体用乙醇洗涤,干燥后得到浅黄色固体3.2 g,产率56.61%。 爆点137 °C。 合成路线见图1。
1H NMR (D2O,500 MHz),δ=4.70 (s, 1H)。13C NMR (DMSO-d6,125 MHz),δ =161.42,116.68,87.94。

图1 硝基乙腈钾合成路线Fig 1 Synthesis of Nitroacetonitrile potassium
1.2.3 AITX 的合成
0.62 g(5 mmol)硝基乙腈钾溶于10 mL 水中,冷却至0 ℃,加入2.46 g (30 mmol)醋酸钠,低温搅拌待用。 将1.08 g (10 mmol) 4-氰基-5-氨基咪唑溶解于10 mL 水中,加入2.5 mL (30 mmol)浓盐酸,加热使反应物全溶后,冰盐浴使反应体系降温至-5 ~0 ℃,缓慢滴加冰的NaNO2(0.76g,11 mmol)水溶液,滴加完毕后反应0.5 h;在4-氰基-5-氨基咪唑溶液中缓慢滴加入硝基乙腈钾溶液,滴加完毕后,在0 ℃以下反应0.5 h,收集灰黄色滤饼,滤饼冰水洗两次后,进行柱分离,得到目标产物棕红色固体AITX。
1H NMR (DMSO-d6,500 MHz),δ=10.04(s,1H),9. 05 (s, 1H)。13C NMR (DMSO-d6,125 MHz):δ =144.94,137.79,136.47,129.65,114.28,103. 92。 FT-IR(KBr):v= 2 323,3 328,3 193,3 111,2 924,2 854,2 240,2 227,1 752,1 638,1 579,1 549,1 477,1 465,1 374,1 349,1 248,1 169,1 098,1 037,906,856,818 cm-1。
高分辨质谱(C6H3N7O2):m/z =204. 027 546[M—H]-。
2 结果与讨论
2.1 NOCNEt 与KMnO4 摩尔比对CNEAK 产率的影响
当n(NOCNEt)∶n(KOH) =3.0∶1.2,固定其他反应条件,选取了常用氧化剂KMnO4对NOCNEt进行氧化,改变NOCNEt 与KMnO4的摩尔比,考察KMnO4用量对产物CNEAK 的影响,具体结果见表1。 表1 中,纯度使用高效液相色谱仪测试。

表1 KMnO4 用量对CNEAK 产率与纯度的影响Tab.1 Effect of KMnO4 on the yield and purity of CNEAK
Voinkov 法使用的NOCNEt 与KMnO4的摩尔比为3.0 ∶4.5,CNEAK 的产率为63. 00%。 但重复Voinkov法时,产率仅为32.00%。 分析原因,可能是KMnO4用量太大,导致产率降低。 降低KMnO4用量,NOCNEt 与KMnO4的摩尔比分别为3.0∶2.0、3.0∶2.1、3.0∶2.2 时,CNEAK 产率(纯度)分别为65.74% (98.55%)、65. 77% (98. 44%)、65. 80%(98.47%),产率和纯度均比较接近。 继续降低KMnO4用量,NOCNEt 与KMnO4的摩尔比为3.1∶2.0 时,由于氧化反应不完全,CNEAK 的产率仅为59.48%,纯度(93. 75%) 也较低。 因此,较佳的NOCNEt 和KMnO4投料摩尔比为3.0∶2.0。
2.2 NOCNEt 与KOH 摩尔比对CNEAK 产率的影响
当n(NOCNEt)∶n(KMnO4) =3.0∶2.0,固定其他反应条件,氧化反应选取了KOH 为催化剂,改变NOCNEt 与KOH 的摩尔比,讨论了反应物与KOH 摩尔比对产物CNEAK 产率的影响,具体结果见表2。
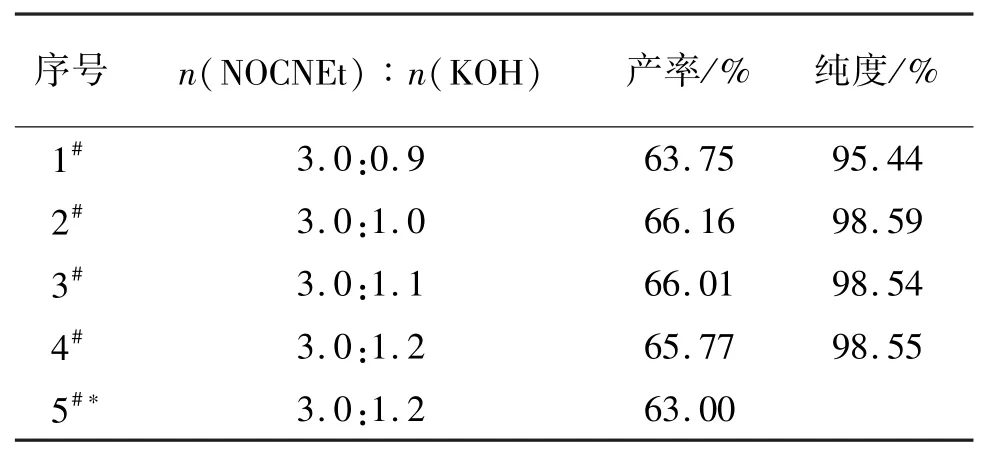
表2 KOH 用量对CNEAK 产率与纯度的影响Tab.2 Effect of KOH on the yield and purity of CNEAK
Voinkov 法使用的NOCNEt 与KOH 的摩尔比为3.0∶1.2,CNEAK 的产率为63.00%。 在重复试验时,产率为66. 14%,略高于文献报道。 尝试减少KOH 的用量,n(NOCNEt):n(KOH)分别为3.0 ∶1.1和3.0∶1.0 时发现,CNEAK 的产率略有上升(66.01%和66.16%)。 继续减少KOH 用量,发现CNEAK 产率下降较大(63. 75%),并且纯度降低(95.44%)。 因此,选择较佳的NOCNEt 和KOH 投料比为3.0∶1.0。
2.3 时间和温度对硝基乙腈钾产率的影响
n(NOCNEt)∶n(KMnO4)∶n(KOH) =3.0∶2.0∶1.0 时,固定其他反应条件,考察了水解反应温度和反应时间对硝基乙腈钾产率的影响,结果如图2 所示。

图2 时间和温度对产率影响Fig.2 Effect of time and temperature on yield
Voinkov 法是常温下水解24 h,产率45.00%。本文中,讨论了反应温度与产率之间的关系,以达到减少反应时间,提高产率的目的。 反应温度升高至25 ℃,随着反应时间的延长,产率提高,当反应时间为4.5 h 时,产率升至41.00%。 继续升高反应温度至30 ℃,随着反应时间的延长,产率也相应增加,当反应时间为4 h 时,产率达到56.88%。 继续延长反应时间,产率无明显提高。 继续提高反应温度至35℃,反应产率虽然随着反应时间的延长而增加,但总体低于30 ℃时的产率。 这可能是由于硝基乙腈钾在高温下不稳定,可能会发生分解而导致。 因此,选择较佳的水解反应温度为30 ℃,反应时间为4 h。
2.4 水解反应溶剂对反应的影响
在水解反应后,需要使用高真空度条件40 ℃以下旋蒸除去溶剂水。 除水后得到的产物胶粘于烧瓶壁,板结严重,难以分离;直接用乙醇洗涤效果较差。因此,尝试使用乙醇和水的混合溶剂代替水,反应后得到悬浊液直接过滤后,甲醇提取产物。
乙醇对水解反应的影响见图3。 但反应结果并不理想。 使用混合溶剂时,反应24 h,硝基乙腈钾的产率仅为40.21%,纯度也只有95.23%(表3)。 造成此结果的主要原因是2-硝基-2-氰基乙酸乙酯在碱性条件下水解为2-硝基-2-氰基乙酸盐和乙醇,2-硝基-2-氰基乙酸盐通过脱羧反应得到目标产物硝基乙腈钾。 当使用乙醇和水的混合溶剂时,体系中的大量乙醇使得第一步酯的水解反应平衡难以向右移动,因此反应时间延长,产率降低。
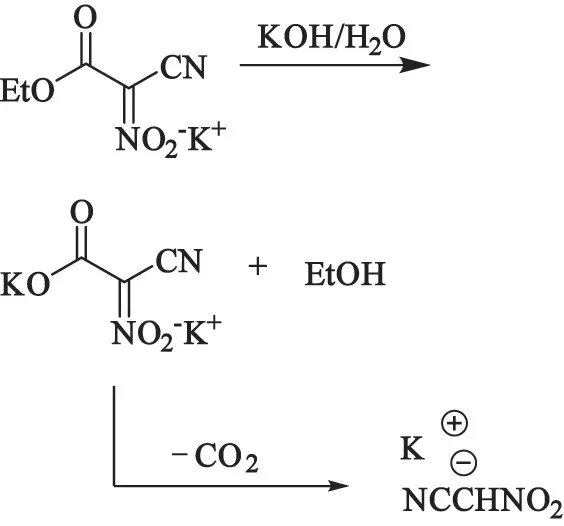
图3 乙醇对水解反应影响Fig.3 Effect of alcohol on hydrolysis reaction

表3 溶剂对水解反应产物产率和纯度的影响Tab.3 Effect of solvent on yield and purity of hydrolysis product
2.5 AITX 的合成及性能
以4-氰基-5-氨基-1H-吲哚和硝基乙腈钾为底物,合成了新型氮杂稠环化合物AITX(图4)。 4-叠氮基-5-氨基-1H-吲哚与NaNO2反应生成相应的重氮盐,后者与硝基乙腈偶联反应后,得到中间产物,由中间产物环合生成目标产物[15]。 经计算,AITX的密度、氮含量、生成焓等性能参数见表4。 结果显示,AITX 的密度为1. 64 g/cm3,氮质量分数达到47.80%,生成焓为772.43 kJ/mol。 通过AITX 的结构、密度和生成焓可以看出,由于AITX 含能基团较少(仅有一个硝基和一个叠氮基),并不适合作为直接应用的含能材料。 所以,并未计算其爆速和爆压,而会在后续对其结构进行进一步修饰,尝试合成新的、性能更好的含能材料。
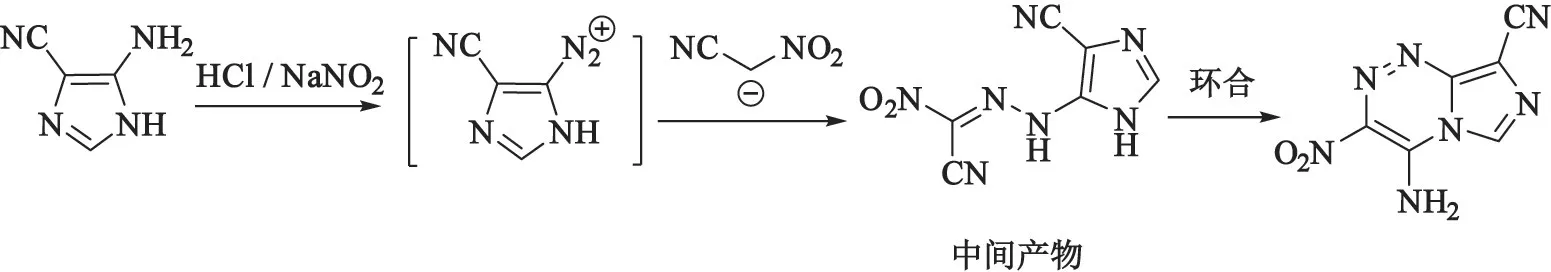
图4 AITX 的合成Fig.4 Synthesis of AITX

表4 AITX 的性能Tab.4 Properties of AITX
3 结论
以NOCNEt为原料,经过氧化、水解制备得到硝基乙腈钾,并表征了其结构。优化了Voinkov的合成方法,对物料比、催化剂用量、反应温度和时间等反应条件进行了讨论,硝基乙腈钾的总产率达到37.71%,高于文献中报道的28.35%。 使用4-氰基-5-氨基-1H-吲哚和硝基乙腈钾合成了新型的氮杂稠环化合物AITX,并计算了其部分性能。 AITX 的密度为1.64 g/cm3,氮质量分数达到47.80%,生成焓为772.43 kJ/mol。

