单叶蔓荆种子休眠特性与解除方法*
尹德洁 布凤琴 徐艳芳 黄 彪 李 成
(1.山东建筑大学风景园林研究中心 济南 250101; 2.国际竹藤中心 国家林业和草原局/北京市共建竹藤科学与技术重点实验室 北京 100102)
单叶蔓荆(Vitexrotundifolia)又名蔓荆子,为马鞭草科(Verbenaceae)牡荆属(Vitex)落叶小灌木,主要分布在沙滩海岸前沿、海边及湖畔,在我国主要集中分布于山东、河北、辽宁、江苏、福建、浙江、安徽、江西、广东、台湾等地。植株具有防风固沙及改良土壤作用,果实为传统中药,具有镇痛降压作用,对心血管疾病有显著疗效。随着人们不断深入认识单叶蔓荆的较高开发利用价值(乔勇进等, 2001),其需求量俱增,导致野生种质资源日渐稀少,已被列入国家Ⅲ级濒危保护植物。单叶蔓荆在生产上主要以扦插和断蔓等营养繁殖为主,种子繁殖困难,无法形成播种产业化种植。目前研究多集中在化学成分、药理作用及生态效应上(常宗涛等, 2016; 陈怀远等, 2018; 魏宗贤等, 2011),对种子萌发条件及休眠特性等种苗繁殖的研究较少。
自然界中不同植物在长期进化中形成不同种子休眠特性,可分5类(Baskinetal., 2004): 1)物理休眠(physical dormancy, PY),通常由果皮或种皮中存在的不透水的栅栏细胞所引起,通过机械损伤可解除休眠,如白皮松(Pinusbungeana)、欧榛(Corylusavellana)、栝楼(Trichosantheskirilowii)(郭聪聪等, 2019; 孙婷等, 2008; 王世杰等, 2018)等。2) 生理休眠(physiological dormancy, PD),是最普遍的休眠类型,又可分为深度、中度和浅度生理休眠。深度生理休眠种子的离体胚不能正常生长或产生畸形苗,种子萌发需低温层积处理3~4个月,赤霉素处理不能破除休眠,如挪威槭(Acerplatanoides)(付婷婷等, 2009); 中度生理休眠种子的离体胚能正常生长,赤霉素处理可促进部分种类种子萌发,低温层积2~3个月便可萌发,如欧亚槭(Acerpseudoplatanus)(洑香香等, 2011); 大多数种子属浅度生理休眠,离体胚能产生正常幼苗,赤霉素处理和层积处理能解除休眠。3)形态休眠(morphological dormancy, MD),属非生理休眠,此类种子的胚虽已分化但未发育完全,解除休眠需较长时间让胚生长至足够体积,如牡丹(Paeoniasuffruticosa)(潘昊磊等, 2019)和贝母属(Fritillaria)植物(朱敏嘉等, 2019)。4)形态生理休眠(morphophysiological dormancy, MPD),指种子的胚未发育完全,同时具有生理休眠,如巫山淫羊藿(Epimediumwushanense)(苏贺, 2016)和凹叶木兰(Magnoliasargentiana)(唐安军, 2014)。5)复合休眠(combinational dormancy, PY+PD),指胚具有生理休眠,同时种皮或果皮有不透水性,如窄叶野碗豆(Viciaangustifolia)(张瑞等, 2014)。本文研究了单叶蔓荆种子的休眠特性,并探讨解除休眠方法,为其保护及利用、人工种苗繁育及规模化种植提供参考。
1 材料与方法
1.1 试验材料 单叶蔓荆果实于2018年10月采于山东省滨州市(117°51′21.41″E,38°15′52.73″N),果实采回置于室内自然风干后,置于4 ℃冰箱中保存待用。选择发育饱满且完好的果实进行发芽试验。
1.2 试验方法 1) 果实和种子形态特征及空壳率的测定 对完整的单叶蔓荆果实及种子形态进行观察,注意有无果柄及是否宿存萼片; 选取生长一致的果实,从中部横切和纵切,观察果实内部组织结构; 用游标卡尺测定果实大小; 用万分之一电子天平测定果实千粒质量; 随机挑选100粒果实横切,对种子进行计数,重复3次,净度风选仪清选后计算空壳率。
2) 果实和种子吸水性 取果皮完整的果实和用小刀切割处理的果实各100粒,称其质量,浸入3倍于果实体积的蒸馏水中,置于25 ℃恒温培养箱内,在前12 h每2 h取出果实后用滤纸快速吸干表面水分并称量,以后每6 h称量1次,直至质量恒定。试验3次重复,计算果实吸水率[吸水率=(湿质量-干质量)/干质量×100%]。
解剖出单叶蔓荆种子,取有完整种皮的种子和用小刀破皮的种子各100粒,用上述同样的方法计算种子吸水率,试验重复3次。
3) 萌发抑制物部位及类型的测定 取2份去掉宿存花萼的完整单叶蔓荆果实2 g,用0.1%的KMnO4溶液消毒,蒸馏水中浸泡24 h,自然风干后分离果皮和种子,分别充分研磨成粉末,并分别用蒸馏水和甲醇定容至20 mL。置于4 ℃振荡培养箱中浸提36 h,4 ℃、4 000 r·min-1的冷冻离心机中离心15 min,取上清液。将蒸馏水上清液定容至20 mL; 用旋转蒸发仪在56 ℃下对甲醇上清液进行处理,使甲醇挥发干净,用蒸馏水溶解剩余物质,并定容至20 mL。即得浓度为0.1 g·mL-1的蒸馏水和甲醇粗提物母液,试验重复3次。
参照王小平等(1998)的方法,设置粗提物浓度为0(CK)、0.1、0.01、0.05 g·mL-1,每个处理取30粒白菜种子,放在有双层滤纸的培养皿中,加入10 mL粗提物溶液,在25 ℃恒温培养箱中培养,保持培养皿湿润,48 h后测定白菜种子发芽率,72 h后测量根长和苗高,并计算内源萌发抑制物活性(抑制物活性=1-处理组发芽率/对照发芽率×100%)。
4) 种子休眠解除方法 将用0.1%的KMnO4溶液消毒后的单叶蔓荆果实置于蒸馏水中,浸泡24 h后,进行不同处理(表1)。
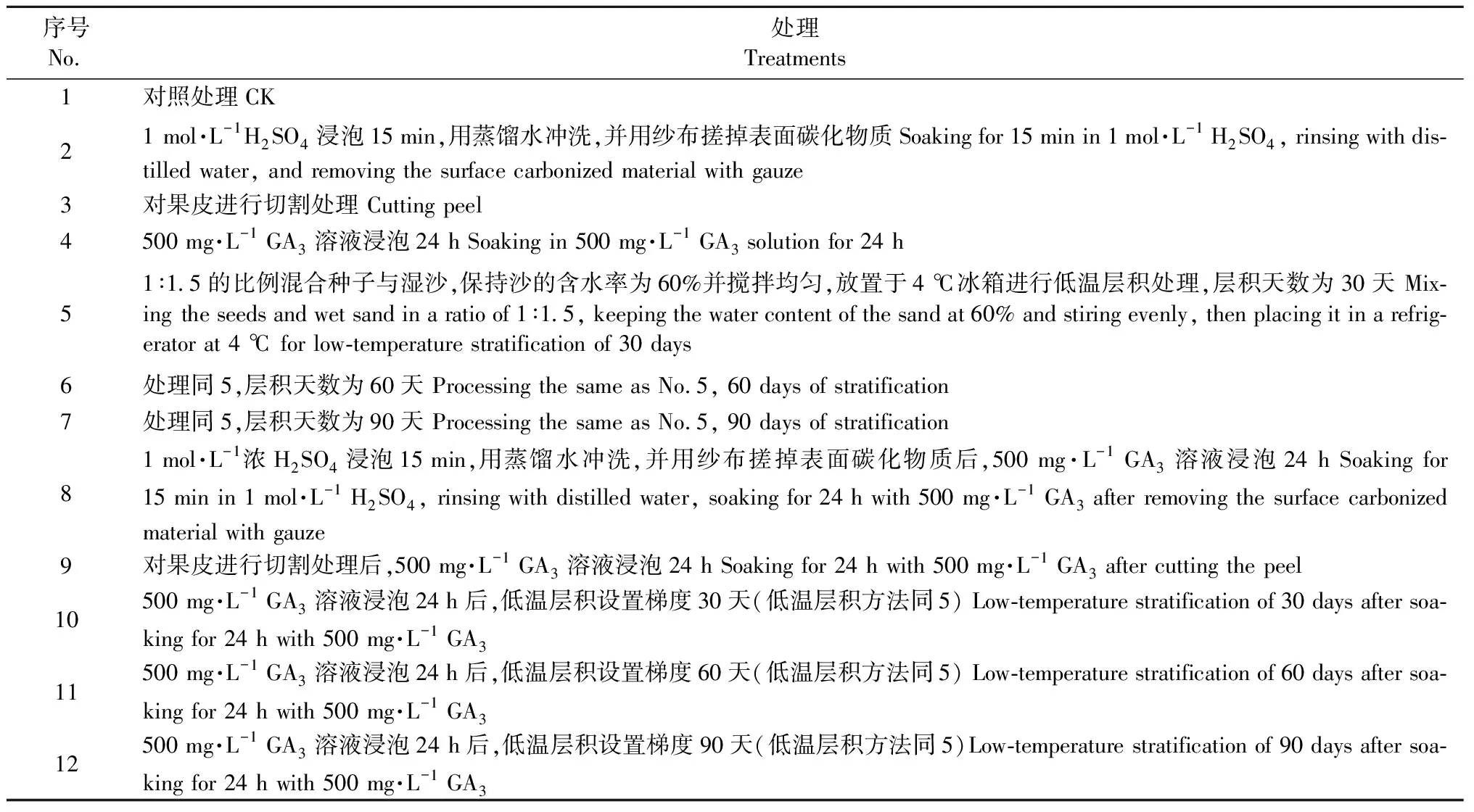
表1 对单叶蔓荆果实的不同试验处理Tab.1 Different experimental treatments on the fruits of Vitex rotundifolia
每个处理均选取饱满果实50粒,置于双层滤纸的培养皿中,在25 ℃恒温培养箱中进行发芽试验,每个处理重复3次。保持滤纸湿润,每天观测,胚根突出种皮的长度为种子长度的一半时为种子萌发。第30天测定发芽势(GP),第45天统计发芽率(GR)、发芽指数(GI)和活力指数(VI),测量根长(cm),发芽试验持续观测时间为45天。发芽势和发芽指数能衡量种子的发芽能力,即萌发的速度和整齐度; 而活力指数反映的是种子萌发的动力。
发芽势=(第30天发芽数/供试种子总数)×100%;
发芽率=(第45天发芽数/供试种子总数)×100%;
发芽指数=∑Gt/Dt;
活力指数=发芽指数×根长。
式中,Gt为发芽后第t日的发芽数,Dt为Gt对应的发芽天数。
萌发抑制物清除 取去掉宿存花萼的完整单叶蔓荆果实2 g,用0.1%的KMnO4溶液消毒且用蒸馏水浸泡24 h后,用500 mg·L-1的GA3溶液浸泡24 h。处理完成后参照3)进行粗提物制备及其活性测定。设置粗提物的浓度为0(CK)、0.1、0.01、0.05 g·mL-1,24 h后测定白菜种子发芽率,48 h后测量根长和苗高。
1.3 数据分析 数据采用Microsoft Excel和SPSS 19.0软件进行统计分析和图表处理。
2 结果与分析
2.1 单叶蔓荆果实的形态特征 单叶蔓荆果实为圆球形核果(图1),成熟后表面黑色或褐色,花萼宿存; 果实具短小果梗,纵轴为4.0~6.0 mm,短轴为3.8~5.8 mm。横切面果皮厚,包括灰黑色的外层和黄白色的内层,内果皮由完全木栓化的石细胞层组成,内外层之间有棕褐色排列成环的油点; 内含种子通常为0~4粒,种仁黄白色或白色。单叶蔓荆果实平均千粒质量为29.15 g,空壳率为26%。

图1 单叶蔓荆果实组织结构及种子萌发Fig.1 Fruit organization and seed germination of V. rotundifoliaA. 完整果实Complete fruit; B. 果实横切面Fruit cross section 1: 4粒种子Four seeds; 2: 3粒种子Three seeds; 3: 2粒种子Two seed; 4: 1粒种子One seeds; 5: 无种子No seeds. C. 果实横切面(图中等比例扩大3倍)Fruit cross section (triple the proportion) a. 外果皮Exocarp; b. 内果皮Endocarp; c. 外果皮和内果皮之间排列成环的油点The oil spots are arranged in a ring between exocarp and endocarp; d. 种子Seed。 D. 种子发芽过程Seed germination.
2.2 单叶蔓荆果实和种子吸水性 由图2可知,单叶蔓荆果实浸水后立即吸涨,浸种2 h吸水最快,为急剧吸水期; 浸种18 h后开始较为缓和的吸水阶段,未切割果皮的和切割果皮的果实的吸水率分别达到(103.99%±7.43%)和(155.67%±2.33%)。总体来看,在0~36 h内,未切割果皮和切割果皮的果实的吸水率表现出相似变化,但数值相差较大,且切割果皮的果实吸水率一直较高,说明果皮对果实及内部种子吸水有明显机械阻碍。由图3可知,单叶蔓荆种子百粒质量为0.231 4 g,吸水18 h后质量达到恒定,完整的和破皮的种子百粒质量分别为0.273 8 g和0.275 3 g,且吸水率差值不明显,说明单叶蔓荆种子没有吸水障碍。
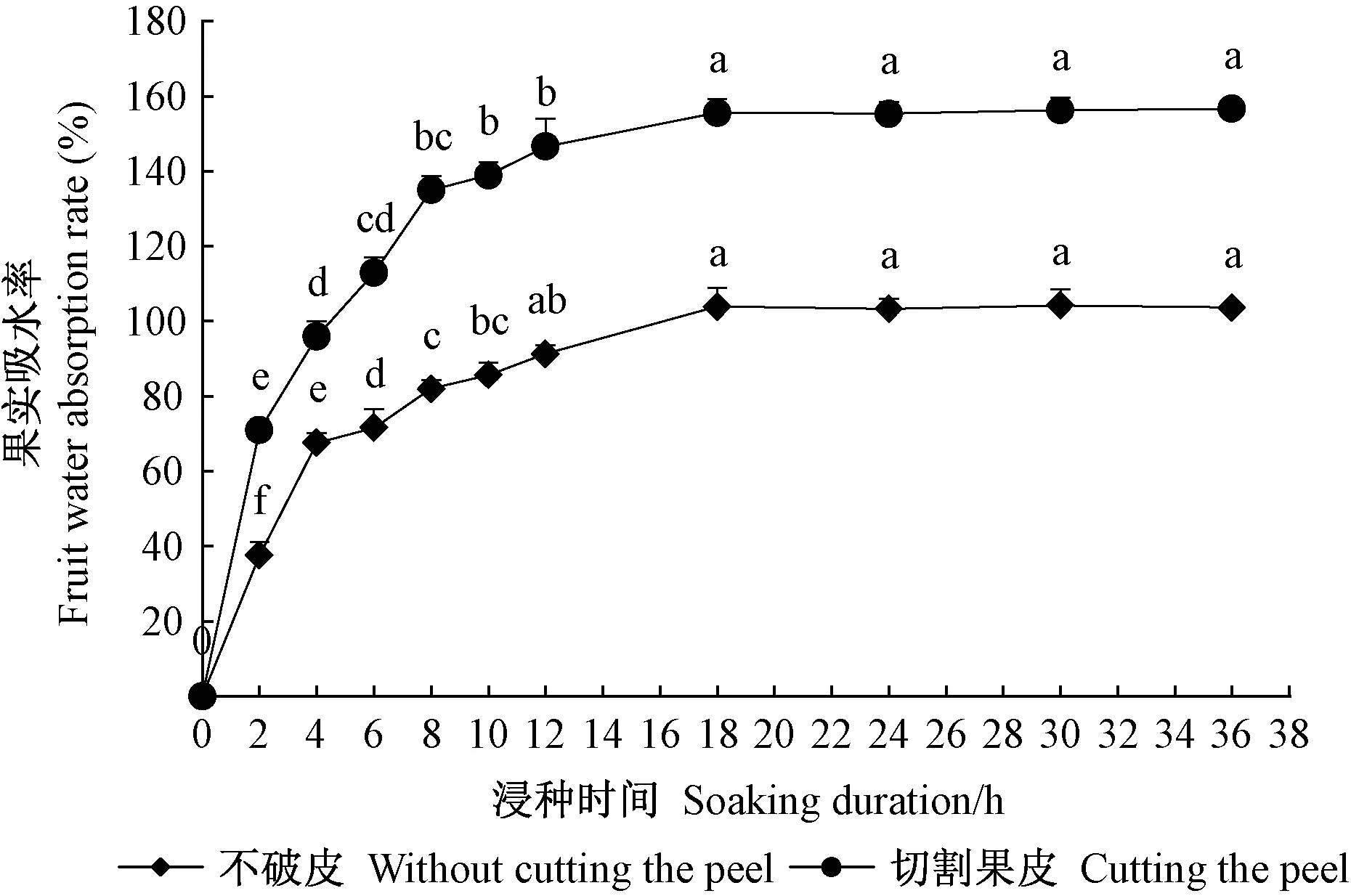
图2 在20 ℃条件下单叶蔓荆果实吸水率随浸泡时间的变化Fig.2 Changes of water absorption of V. rotundifolia fruit to soaking duration under 20 ℃

图3 在20 ℃条件下单叶蔓荆种子吸水率随浸泡时间的变化Fig.3 Changes of water absorption of V. rotundifolia seed to soaking duration under 20 ℃
2.3 萌发抑制物对白菜种子萌发特性的影响 1) 果皮不同浸提液对白菜种子萌发及幼苗生长的影响
由表2可知,单叶蔓荆果皮水浸提液和甲醇浸提液对白菜种子发芽的抑制作用,随浸提液浓度增加而逐渐增强。不同浓度的水浸提液和甲醇浸提液的发芽率组间差异显著(P<0.05)。水浸提液浓度为0.01、0.05、0.1 g·mL-1时,发芽率比对照分别降低40.33%、41%、43.66%,水浸提液浓度为0.1 g·mL-1时的发芽率显著低于浓度0.01、0.05 g·mL-1时; 不同浓度甲醇浸提液的发芽率与对照相比差异显著,浓度在0.01、0.05、0.1 g·mL-1时比对照分别降低38.66%、39.35%、41%。
由表2可知,随着果皮水浸提液和甲醇浸提液浓度升高,对白菜根长生长的抑制逐渐增强,对照的主根长为2.13 cm,而不同浓度的水浸提液、甲醇浸提液处理后的主根长分别为1.33~1.35 cm、1.31~1.75 cm。不同浓度水浸提液的白菜幼苗主根长与对照相比有显著差异,不同浓度间差异不显著; 甲醇浸提液浓度为0.05和0.1 g·mL-1时,主根长与对照相比差异显著,且处理间差异不显著。由此可知,果皮水浸提液对白菜主根长的抑制作用更明显。随着果皮水浸提液和甲醇浸提液浓度升高,对白菜苗高生长的抑制作用也逐渐增强,当水浸提液浓度和甲醇浸提液浓度为0.05和0.1 g·mL-1时,苗高比对照显著降低8.39%、8.81%和8.03%、8.63%,水浸提液对苗高的抑制作用要强于甲醇浸提液。
综上说明,单叶蔓荆果皮内含有影响种子萌发的水溶性内源抑制物和醇溶性内源抑制物,且内源抑制物的活性和抑制种子发芽及幼苗生长的作用随浸提液浓度增大而增强。果皮水浸提液的抑制作用高于甲醇浸提液,这可能是由于果皮内萌发抑制物的水中溶解性大于甲醇中溶解性。
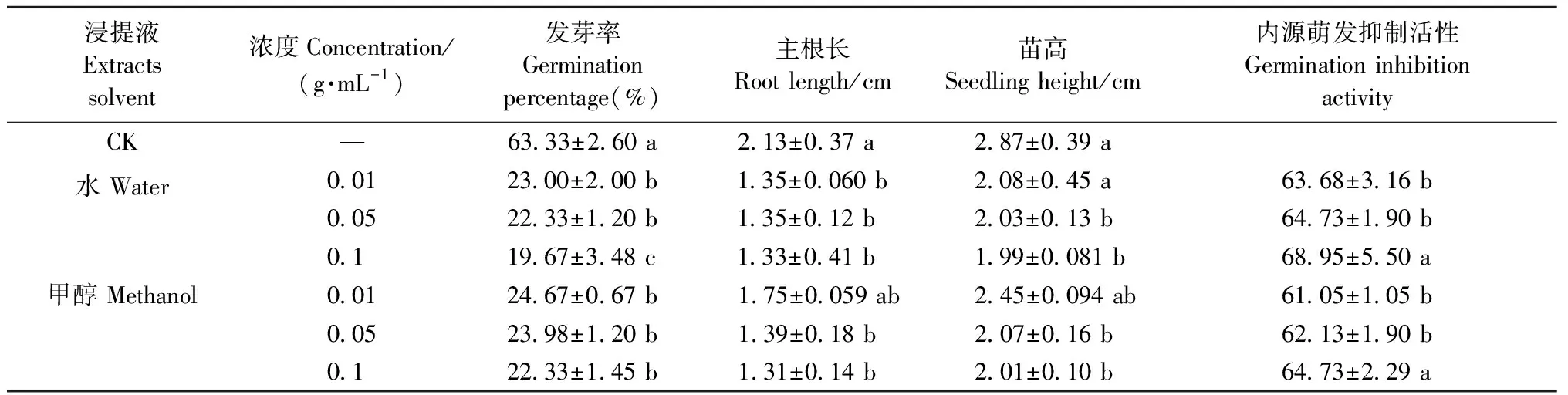
表2 果皮粗提物对白菜种子萌发及幼苗生长的影响①Tab.2 Effect of different peel extracts on seed germination and seedling growth of Chinese cabbage
2) 种子不同浸提液对白菜种子萌发及幼苗生长的影响 单叶蔓荆种子不同浓度的水浸提液和甲醇浸提液处理的白菜种子发芽率、根长和苗高与对照相比均无显著差异(表2),说明单叶蔓荆种子不含使种子休眠的内源萌发抑制物质。
3) GA3处理后果皮提取液对白菜种子萌发及幼苗生长的影响 由表3可知,采用GA3处理后的单叶蔓荆果皮水浸提液和甲醇浸提液对白菜种子萌发和幼苗生长有抑制作用,且抑制作用随浓度增大而增强。不同浓度的水浸提液和甲醇浸提液培养的白菜种子发芽率与对照相比均差异显著,但不同浓度间差异不显著。结合表2结果可知,经GA3处理的不同浓度浸提液培养的白菜种子,其发芽率均要高于未处理,说明GA3处理后降低果皮浸提液抑制作用。尤其在浓度为0.01 g·mL-1时,果皮水浸提液和甲醇浸提液培养下的白菜种子发芽率较未用GA3处理时显著提高23.25%和27.15%。
由表3可知,GA3处理后的果皮不同浓度水浸提液培养的白菜种子幼苗的根长与对照相比差异显著,甲醇浸提液培养的幼苗根长在0.01 g·mL-1与对照相比无显著差异,在0.05和0.1 g·mL-1时与对照相比差异显著; 水浸提液培养的白菜种子幼苗的苗高在0.05、0.1 g·mL-1与对照相比有显著差异,不同浓度甲醇浸提液培养的幼苗苗高与对照相比均无显著差异。结合表2可知,GA3处理后的果皮浸提液培养的白菜幼苗根长和苗高均大于未经GA3处理时。综上所述,GA3处理可减弱单叶蔓荆果实内源抑制物的活性。
2.4 解除休眠的方式 采用多种处理,研究单叶蔓荆种子的休眠解除方式。由表4可知: 对照(流水浸种24 h)、1 mol·L-1H2SO4、切割果皮、低温层积30天以及低温层积60天均不会使种子萌发,即不能解除种子休眠。而低温层积90天、GA3、GA3+1 mol·L-1H2SO4、GA3+切割果皮、GA3+低温层积(30、60、90天)均可促进种子萌发。其中GA3+1 mol·L-1H2SO4处理的种子发芽时间最短,为14天,比单纯用GA3处理提前4天,比低温层积90天处理提前11天。
GA3+1 mol·L-1H2SO4处理的单叶蔓荆种子发芽率最高(44%),分别比低温层积90天、GA3、GA3+切割果皮、GA3+低温层积(30、60、90天)提高28%、21.33%、10.67%、24.67%、22.67%、8%,均差异显著; 其发芽势比低温层积90天、GA3、GA3+切割果皮、GA3+低温层积(30、60天)分别显著提高16.67%、13.34%、8.67%、14.67%、12.67%,但与GA3+低温层积90天处理差异不显著; 其发芽指数较低温层积90天、GA3、GA3+切割果皮、GA3+低温层积(30、60、90天)分别显著提高5.72%、2.08%、2.79%、4.75%、4.58%、0.58%; 活力指数较低温层积90天、GA3、GA3+切割果皮、GA3+低温层积(30、60、90天)分别显著提高7.05%、3.37%、4.83%、6.58%、6.17%、1.08%。
综合不同处理结果可知,低温层积90天、GA3、GA3+H2SO4、GA3+切割果皮、GA3+低温层积(30、60、90天)均可不同程度地解除单叶蔓荆种子的休眠。在GA3+H2SO4处理下,种子发芽能力及种子活力最强,休眠解除作用最显著。
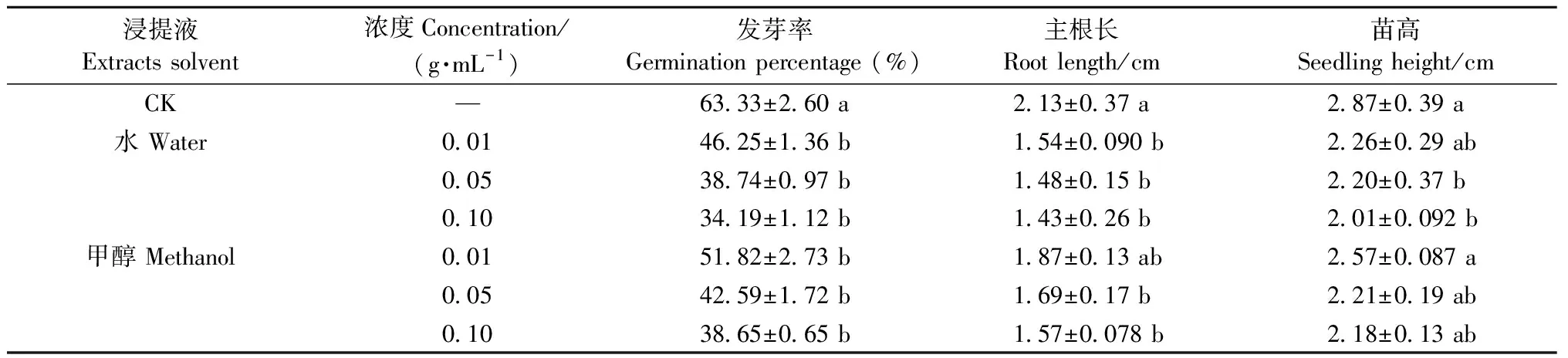
表3 GA3处理后不同浸提液对白菜种子萌发及幼苗生长的影响Tab.3 Effect of different extracts on seed germination and seedling growth of Chinese cabbage after gibberellin treatment
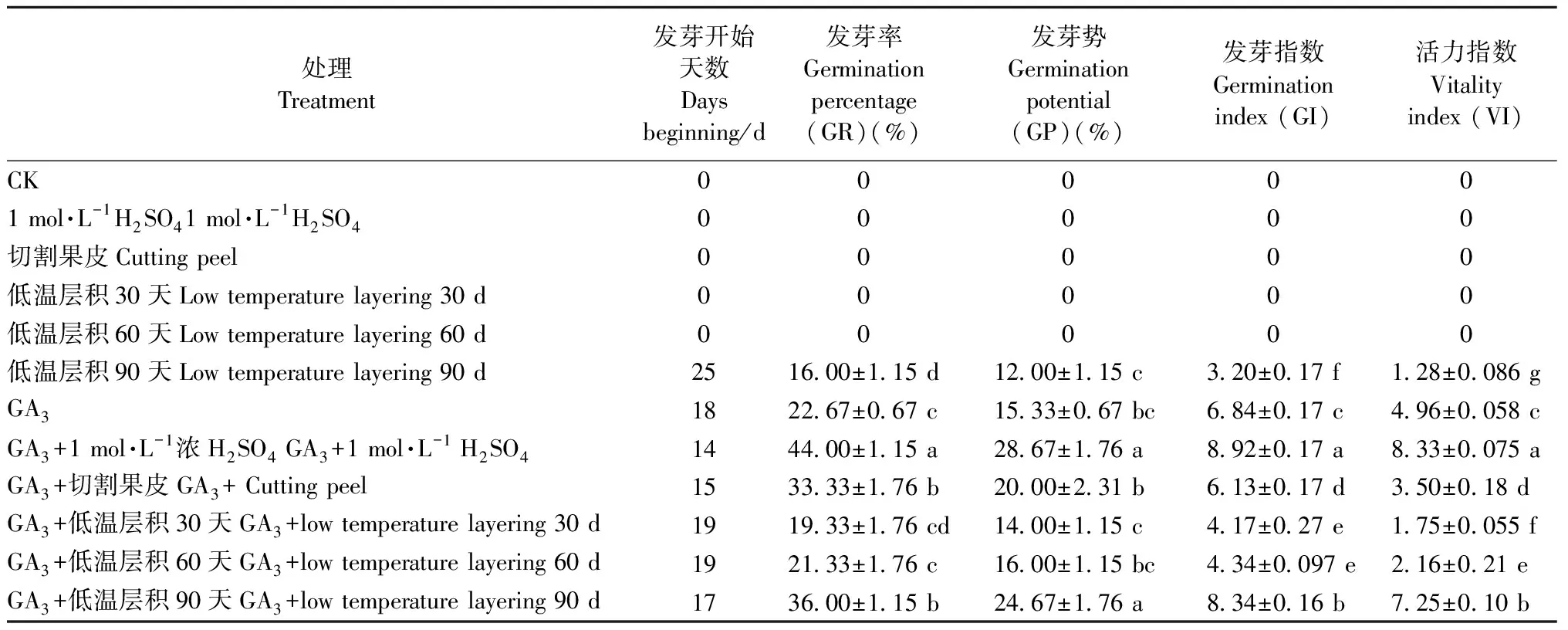
表4 不同处理对单叶蔓荆种子萌发的影响Tab.4 Influence of different treatments on germination of V. rotundifolia seeds
3 讨论
3.1 影响单叶蔓荆种子休眠的主要因素 1)果皮是种子萌发的主要障碍 通过果实吸水性可知,果实破皮后的吸水率远高于未破皮,且随时间延长时二者也无法一致,说明坚硬果皮是种子吸水的阻碍因素之一。而种子破皮与不破皮处理的种子吸水率无显著差异,说明种皮并无吸水障碍,这与对滇重楼(Parispolyphyllavar.yunnanensis)(黄玮等, 2008)、红芪(Hedysarumpolybotrys)(孙云波等, 2015)等的研究结果相似。
2) 果皮中内源抑制物是造成种子休眠的重要因素 单叶蔓荆果皮粗提物能明显抑制白菜种子萌发和生长,说明果皮含有萌发抑制物质,青钱柳(Cyclocaryapaliurus)的果皮中也存在活性较强的引起种子休眠的内源抑制物质(尚旭岚等, 2011)。内源萌发抑制物质引起的种子休眠归为形态学-生理学休眠(Nikolaeva, 1977),很多研究认为内源激素的参与诱导生理休眠以及其维持和终止(颜启传, 2001)。GA3是一种重要的植物内源激素,对种子萌发有重要调节作用,是一种萌发刺激物。经GA3处理后的单叶蔓荆果皮粗提物能显著促进白菜种子萌发和生长,萌发率和根长、苗高显著高于未经GA3处理,说明GA3降低了果皮内抑制剂的作用,促进了内源GA3和生长素的合成,从而促使种子解除休眠,Debeaujon等(2000)研究表明,胚的生理休眠主要原因在于抑制剂浓度过高、促进剂浓度过低导致。而在单叶蔓荆种皮中不存在萌发抑制物质,这与孙荣进等(2012)研究结果一致。具有休眠特性的不同植物种子的萌发抑制物质存在的部位不同,如栀子(Gardeniajasminoides)(颜升等, 2014)存在于果肉和果皮中,沙拐枣(Calligonummongolicum)存在于果皮中(于卓等, 1998),黄山花楸(Sorbusamabilis)存在于果实中。抑制物质的活性强弱顺序依次为果肉、果皮、种子(徐向东等, 2014)。
单叶蔓荆果皮中同时存在水溶性和醇溶性萌发抑制物,且水溶性萌发抑制物的活性更大,这与肉果秤锤树(Sinojackiasarcocarpa)的果肉中的萌发抑制物研究结果相反(刘超等, 2013)。而在茅苍术(Atractylodeslancea)和细叶鸢尾(Iristenuifolia)种子内仅含有醇溶性萌发抑制物质(张丹等, 2011)。在滇重楼种子中,乙醇提取液抑制活性强,而甲醇提取液抑制活性很弱(古今等, 2013)。
种子的休眠特性是长期演化中形成的适应外界不良环境的一种方式,具有重要意义(Kermode, 2005; Gusanoetal., 2004)。单叶蔓荆生长在沙滩海岸前沿,为沙生和盐生植物,这一区域土壤干旱贫瘠,风大风多,时而发生短期海浸现象,因此单叶蔓荆演化出由完全木栓化的石细胞层组成的内果皮,仅在果梗处有一核孔吸收氧气和水分。孙荣进等(2012)解剖发现,单叶蔓荆种子具有完整的胚,因此不存在生理后熟,即排除形态休眠。单叶蔓荆内果皮木栓化石细胞机械阻碍造成的物理休眠是造成种子萌发困难的主要障碍,果皮中的内源抑制物也是造成种子休眠的重要因素之一。对单叶蔓荆而言,影响种子萌发的关键因素都集中在果皮上,因此下一步应深入研究果皮的成分组成,通过液相色谱等手段鉴定出休眠物质成分,这也是本研究的不足之处。
3.2 破除单叶蔓荆种子休眠的处理方法 1) GA3可清除果皮中内源抑制物 采用低温层积90天、500 mg·L-1GA3+浓H2SO4、500 mg·L-1GA3+切割果皮、500 mg·L-1GA3+低温层积30天、500 mg·L-1GA3+低温层积60天、500 mg·L-1GA3+低温层积90天的处理,可打破种子休眠和促使种子萌发率提高。仅用物理手段如浓H2SO4和切割果皮来打破果皮机械障碍,并不能解除种子休眠,而用500 mg·L-1GA3处理可使种子萌发,说明内源萌发抑制物质是影响单叶蔓荆种子萌发的决定性因素。因此,要想解除单叶蔓荆种子休眠,必须要有GA3等外源萌发刺激物质来清除内源抑制物。
2) 低温层积90天才可破除种子休眠 最常见的种子休眠类型为生理休眠,表现为种皮无吸水障碍,但胚生长能力较弱,需经过低温层积或暖层积来提高胚的生长能力,以此来提高种子萌发率(Baskinetal., 2004; Carricketal., 1994)。在本研究中,低温层积30、60天时,同样不能使种子萌发,而层积90天时的种子得以萌发,与疏叶香根芹(Osmorhizaaristatavar.laxa)和野生黄瑞香(Daphnegiraldii)种子的研究结果一致(Walcketal., 2002; 闫芳等, 2016); 但与曹晓晓(2011)的单叶蔓荆种子低温层积120天的萌发率依然为0的结果不同,这可能与本试验在低温层积之前流水浸种24 h有关。
由于单叶蔓荆果皮坚硬且难以去除,种子难以轻松剥取,因此生产中直接将单叶蔓荆果实视为种子进行播种。本试验中虽剥取单叶蔓荆种子以进行种子吸水率研究,但在实际生产中,可对单叶蔓荆果实进行低温沙藏,但低温层积一般要3个月以上才可能解除种子休眠,如何采用更快速且易操作的方式处理单叶蔓荆果实,使种子快速、整齐的发芽,仍需进一步研究。
本研究中,500 mg·L-1GA3+浓H2SO4处理能较明显地打破单叶蔓荆种子休眠,说明浓H2SO4腐蚀果皮打破了机械阻碍和GA3清除了内源萌发抑制物质,2个作用机制的结合是解除种子休眠和提高发芽率的最佳手段。但未来需进一步研究单叶蔓荆果皮内萌发抑制物的成分及GA3解除种子休眠的机制。
4 结论
单叶蔓荆种子休眠既有果皮结构造成的物理休眠因素,也有内源萌发抑制物的影响。克服坚硬果皮和清除萌发抑制物,是打破其种子休眠的关键。本研究中,采用500 mg·L-1GA3+浓H2SO4处理,可有效解除种子休眠,提高发芽率。

