阿米替林对非酒精性脂肪性肝病细胞模型脂质沉积及生化代谢的影响
刘 勤,张 强,吴方雄,闫 蓉,李 蓉,王 佳,牛春燕,3
1 厦门大学 医学院,福建 厦门 361102; 2 西安医学院第一附属医院 消化内科,西安 710077;3 南京市溧水区人民医院,东南大学附属中大医院溧水分院 消化内科,南京 211200
非酒精性脂肪性肝病(NAFLD)正在成为世界最常见的慢性肝病,全球患病率已达25%[1]。NAFLD的发病机制涉及胰岛素抵抗(insulin resistance,IR)、脂毒性、炎症反应、内质网应激(endoplasmic reticulum stress,ERS)、遗传因素、肠道微生态改变等多个方面[2]。近年研究发现,具有脂毒性特征的鞘脂类介质如神经酰胺(ceramide, CE)、酸性鞘磷脂酶(acid sphingomyelinase, ASM)等参与介导脂代谢紊乱及炎症发生等多种生物学过程,且ASM/CE通路在肝脏疾病的病理生理机制中发挥重要作用,这一通路可被包括TNFα在内的多种生物因素激活[3]。三环类抗抑郁药阿米替林(amitriptyline)是ASM的功能性抑制剂,可促使ASM降解失活,进而抑制CE的产生及其进一步的毒性生物学效应。以往仅在动物实验研究发现阿米替林对脂质代谢的改善作用,但体外研究在国内外尚未见报道。本研究通过建立NAFLD细胞模型,拟从ASM/CE通路方向探讨阿米替林在改善NAFLD肝脏脂质代谢中的作用及其机制。
1 材料与方法
1.1 材料
1.1.1 细胞 HepG2细胞株(procell,CL-0103)和L02细胞株(武汉巴菲尔生物技术有限公司)。
1.1.2 主要药品与试剂 油酸(sigma,O1383),棕榈酸(sigma,P5585),油红O染色液(sigma,O0625),阿米替林(阿拉丁,A129730,以下简称Ami),人TNFα(PeproTech,96-300-01A),Acid sphingomyelinase抗体(affinity,DF13384),HRP标记羊抗兔二抗(武汉博士德生物工程有限公司),TG测定试剂盒、TC测定试剂盒、ALT测定试剂盒、AST测定试剂盒(长春汇力生物技术有限公司),游离脂肪酸(FFA)测定试剂盒(南京建成科技有限公司),人神经酰胺ELISA试剂盒(江莱生物,JL19781),人ASM ELISA测定试剂盒(武汉伊莱瑞特生物科技有限公司)。
1.1.3 仪器与设备 倒置荧光显微镜(Olympus),冷冻离心机(Eppendorf),CO2恒温培养箱(SANYO),全自动生化分析仪(Rayto),酶标仪(Thermo),垂直电泳槽、电转仪(北京六一仪器厂),PCR仪(东胜创新生物科技有限公司),实时荧光定量PCR仪(ABI)。
1.2 方法
1.2.1 细胞培养及分组 HepG2和L02细胞在培养基为RPMI 1640+10%FBS+1%青链霉素溶液,37 ℃、5%CO2饱和湿度条件下培养。正常对照组进行常规培养;NAFLD模型组加入含1 mmol/L FFA(油酸∶棕榈酸=2∶1)培养基培养24 h;Ami组加入100 μmol/L Ami,TNFα组加入20 ng/ml人重组TNFα,Ami+TNFα组同时加入100 μmol/L Ami与20 ng/ml人重组TNFα;Ami组、TNFα组、Ami+TNFα组均于造模前预处理1 h,造模过程中不换液。
1.2.2 MTT比色法测定细胞活力 取处于对数生长期,生长状态良好的L02和HepG2细胞,调整细胞密度到8×104/ml,接入96孔板,同时设空白孔,37 ℃培养过夜。待细胞贴壁后,按照分组进行换液处理(每组3个复孔),37 ℃培养24 h后每孔加入10 μl MTT,37 ℃培养4 h。吸出培养基,加入150 μl DMSO震荡10 min,酶标仪测定568 nm下各孔吸光度值。
1.2.3 油红O染色 分别取对数生长期的各组细胞,以5×104/孔的密度接种于放玻片的 24 孔板上,细胞培养至密度达到60%~70%时,放入孵箱培养48 h后,取出培养板,PBS洗3次,用4%多聚甲醛固定15 min,蒸馏水洗,60%异丙醇浸洗,油红O染液染10 min;60%异丙醇分色至背景无色,蒸馏水洗;Mayer苏木素复染数分钟,自来水洗1~3 min;用水性封片剂封片,显微镜下观察细胞内的脂滴。
1.2.4 Western Blot检测ASM的蛋白表达 细胞按分组处理24 h后,提取各组细胞总蛋白,通过BCA法检测蛋白浓度。蛋白经凝胶电泳法分离后,再转至PVDF膜上,在5%脱脂奶粉于室温封闭2 h,按1∶1000稀释抗体ASM与抗体GAPDH,使PVDF膜浸泡于一抗孵育液中,4 ℃孵育过夜。次日 TBST漂洗3次,按1∶50 000稀释相应的HRP标记二抗,使PVDF膜浸泡于二抗孵育液中,37 ℃摇床孵育2 h。洗膜后ECL法压片显影。
1.2.5 实时荧光定量PCR检测ASM表达水平 Trizol法分别提取各组细胞总 RNA,用紫外分光光度计检测RNA的纯度和浓度,并逆转录为cDNA,采用实时荧光定量PCR检测ASM mRNA表达。以GAPDH为内参基因,最终数据以2-△△Ct进行分析。引物由擎科生物科技有限公司设计合成,引物序列:ASM上游引物为5′- CCGGCCCTTTTGATATGGTG-3′,下游引物为5′- GGGGAGGGAAGCTATTGACA-3′,扩增产物大小为189 bp;GAPDH上游引物为5′- TCAAGAAGGTGGTGAAGCAGG -3′,下游引物为5′- TCAAAGGTGGAGGAGTGGGT -3′,扩增产物大小为115 bp。
1.2.6 ELISA法测定细胞ASM、CE总水平 收集各组细胞培养液,1000 r/min离心20 min,取上清保存于-20 ℃备用。根据 ELISA 试剂盒说明书进行操作,检测细胞ASM、CE总水平。
1.2.7 生化指标的测定 TG、TC、ALT、AST由全自动生化分析仪检测,FFA含量按照FFA测定试剂盒说明书进行测定。

2 结果
2.1 NAFLD细胞模型的建立 HepG2和L02细胞的增殖率随FFA浓度的增加而降低。与空白组比较,FFA浓度为2 mmol/L时,两种细胞的吸光度值及增殖率下降明显(表1)。选择FFA浓度为1 mmol/L进行后续实验,诱导细胞脂肪变,油红O染色结果显示,正常对照组HepG2和L02细胞生长形态呈梭形或卵圆形,胞质无明显红染或淡染,NAFLD模型组细胞胞质广泛染色,橘红色脂滴聚集明显增多(图1);与正常对照组比较,NAFLD模型组细胞内TG、TC、FFA水平明显增加(P值均<0.05)(表2),表明 NAFLD细胞模型建立成功。
2.2 不同浓度Ami对NAFLD细胞模型脂质蓄积的影响
正常对照组,NAFLD模型组,Ami 25 μmol/L、50 μmol/L、100 μmol/L干预组的HepG2和L02细胞均生长良好,吸光度值和细胞增殖率组间比较,差异均无统计学意义(P值均>0.05)(表3)。油红O染色结果可见,与NAFLD模型组相比,Ami干预的各组细胞内橘红色脂滴聚集减少,且脂滴随Ami浓度的增加而减少,这一变化在HepG2细胞中更为明显(图2)。进一步定量检测结果显示,与正常对照组比较,NAFLD模型组细胞内TG、TC、FFA水平明显升高;Ami干预组细胞内TG、TC、FFA水平随Ami浓度的升高而降低,与NAFLD模型组比较,Ami 50 μmol/L与Ami 100 μmol/L组细胞内TG、TC、FFA水平下降明显(P<0.05)(表4、5)。综上,Ami可抑制NAFLD细胞模型的脂质蓄积,且在一定浓度范围内,抑制作用随浓度的增加而增强。故选择浓度为100 μmol/L(抑制作用最佳)的Ami进行进一步研究。

表1 不同浓度FFA干预细胞的OD值和细胞增殖率

图1 油红O染色结果(×200)

表2 正常对照组和NAFLD模型组细胞内TG、TC、FFA含量比较

表3 不同浓度阿米替林干预脂肪变细胞的OD值和增殖率
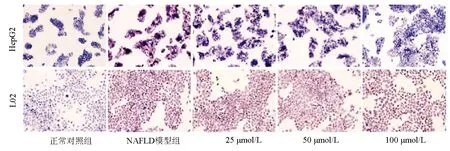
图2 不同浓度Ami干预HepG2和L02细胞的油红O染色结果(×200)
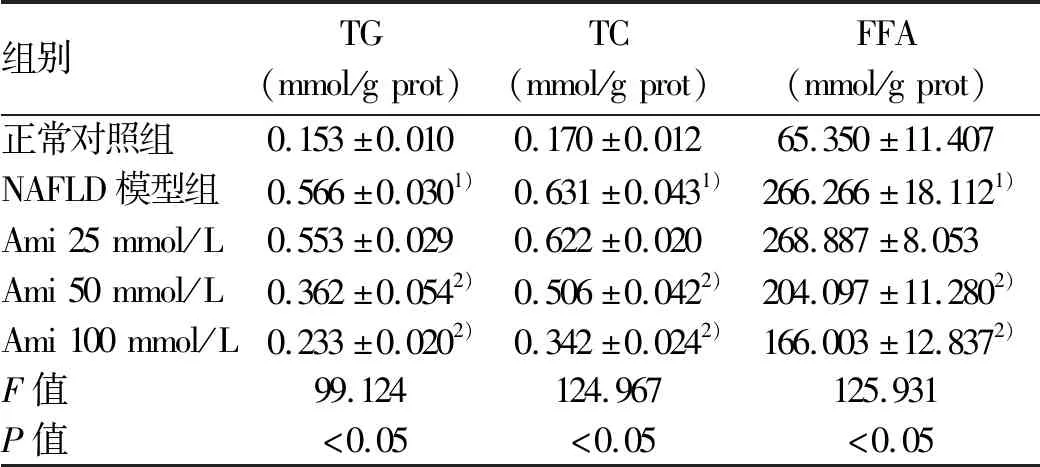
表4 各组HepG2细胞内TG、TC、FFA水平比较

表5 各组L02细胞内TG、TC、FFA水平比较
2.3 TNFα及Ami对ASM/CE通路的影响 为了验证TNFα对ASM的激活作用以及Ami对ASM的抑制作用,对ASM的蛋白及mRNA表达进行检测。与正常对照组比较,NAFLD模型组ASM的蛋白及mRNA表达量明显升高(P<0.05);与NAFLD模型组相比,Ami组明显降低了ASM蛋白及mRNA表达,而TNFα明显增加了细胞中ASM的蛋白及mRNA表达(P值均<0.05);与TNFα组比较,Ami+TNFα组ASM的蛋白及mRNA表达量降低明显(P值均<0.05)(图3,表6)。ELISA检测细胞内总CE、ASM的水平,与正常对照组比较,NAFLD模型组OD值明显升高(P值均<0.05);与NAFLD模型组相比,Ami组OD值明显降低,TNFα组OD值明显升高(P值均<0.05);与TNFα组比较,Ami+TNFα组OD值降低明显(P值均<0.05)(表7),提示Ami可抑制TNFα所致的ASM及CE的表达改变。

图3 各组细胞ASM蛋白的表达水平

表6 各组细胞ASM的mRNA相对表达量

表7 各组细胞的ELISA检测结果(OD值)
2.4 ASM/CE通路对生化代谢的影响 在明确Ami及TNFα对ASM/CE通路的作用后,进一步研究抑制或激活该通路对生化代谢的影响。与正常对照组比较,NAFLD模型组细胞内TG、TC、FFA及细胞上清中ALT、AST水平明显上升(P值均<0.05);与NAFLD模型组比较,Ami组TG、TC、FFA、ALT、AST水平明显下降(P值均<0.05),TNFα组中两细胞系的TG、FFA、ALT、AST水平均上升;与TNFα组比较,Ami+TNFα组TG、TC、FFA、ALT、AST水平明显下降(P值均<0.05)(表8、9)。
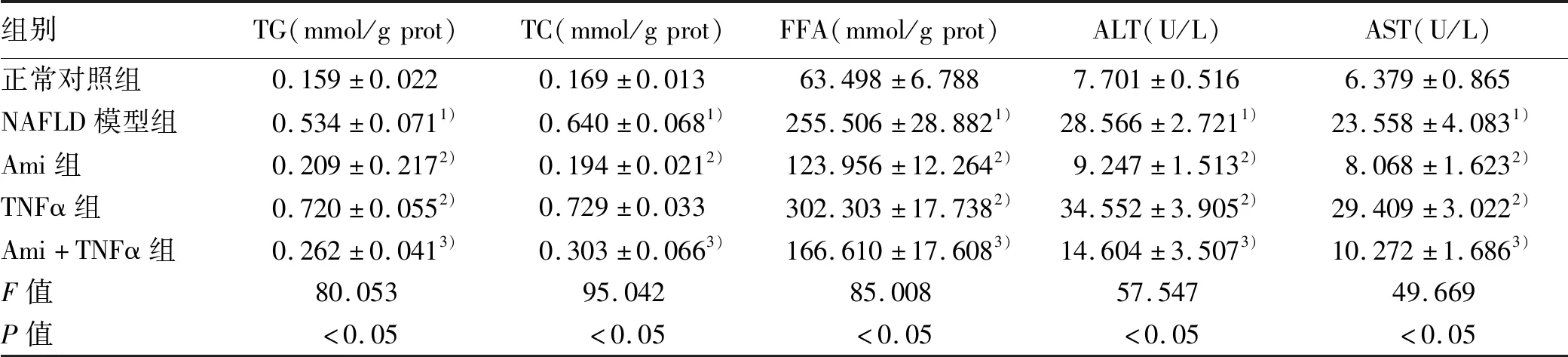
表8 各组HepG2细胞的生化指标比较
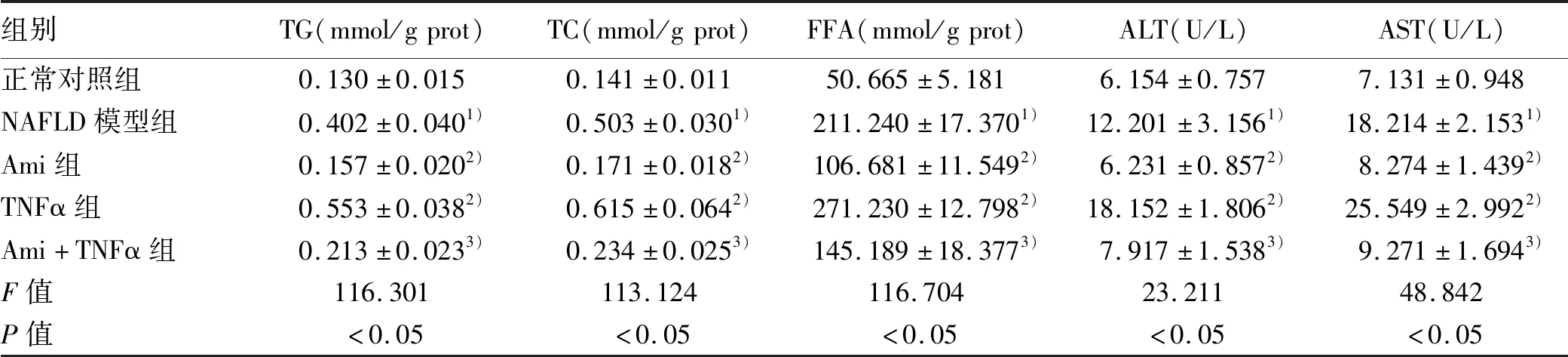
表9 各组L02细胞的生化指标比较
3 讨论
近年研究发现CE及ASM在NAFLD的发病机制中发挥重要作用。CE属于鞘脂类脂质家族,是构成生物膜的重要组分,也是鞘磷脂信号通路的第二信使,可引起脂毒性,介导IR、炎症反应、ERS等多种发病机制,调节细胞凋亡、分化、增殖、自噬等多种细胞应答[4-5],且CE被脂毒性学说的首位提出者Unger[6]描述为脂毒性事件中“最重要的有害途径”。有研究[7]表明,血浆CE水平与青少年肝脂肪变性密切相关,且C14∶0 CE可能成为青少年非肥胖型肝脂肪变性的预测指标。合并IR的非酒精性脂肪性肝炎(NASH)患者中CE合成显著增加,促进肝脂肪变、氧化应激与炎症反应[8-9]。CE还参与了NAFLD大鼠模型肝细胞内的脂质沉积过程[10]。ASM是调控CE合成、分泌的关键酶,也是CE合成最快、最直接的途径。酒精性肝炎和NASH的动物模型中ASM明显激活,可调节ERS、自噬和溶酶体膜透化作用,进而引起IR、脂肪变性、纤维化、脂毒性[11-12],促进肝病的进展,而ASM抑制剂丙米嗪可改善乙醇喂养小鼠的肝脂肪变性[13],提示ASM/CE通路在 NASH 中是一个调控多条通路的关键靶点[14]。
ASM可被炎性因子TNFα激活,被Ami抑制。NAFLD时TNFα水平升高,而由此激活的ASM又能增加肝细胞对TNFα的细胞毒性作用的敏感性[15],如此相互作用可加速肝病进展。Ami是ASM的功能性抑制剂,可干扰ASM与溶酶体膜的结合,导致ASM蛋白降解失活[16],进一步抑制CE的生成及后续的毒性生物学效应。Ami可保护ASM+/+小鼠免于高脂饮食引起的肝脏脂肪变、炎症、ERS以及早期NASH和纤维化[12];明显减轻LDLR-/-小鼠肝脂肪变性、炎症及IR[17]。
关于Ami对NAFLD的影响及ASM/CE通路在 NAFLD发病机制中的探索,目前国际上仅有动物实验的研究,尚未见细胞实验的报道。本研究选择人肝癌细胞HepG2和正常人肝细胞L02两种细胞系,用FFA诱导建立了NAFLD细胞模型,发现NAFLD模型组细胞ASM的蛋白、mRNA表达量与CE含量较正常对照组明显升高,表明NAFLD中存在ASM/CE通路的异常活化。而TNFα组细胞中ASM的蛋白、mRNA表达与CE含量较NAFLD模型组明显升高,表明TNFα诱导的细胞中CE的增加主要源于ASM的激活,验证了TNFα对ASM/CE通路的激活作用。Ami可显著降低细胞模型中的脂滴含量,提示Ami可改善NAFLD肝细胞内脂质沉积。对NAFLD细胞模型进行Ami干预后,细胞内脂质含量及酶学水平均明显下降,细胞ASM的蛋白、mRNA表达量与CE含量也明显降低;采用TNFα激活ASM/CE通路,同时加以Ami干预,细胞内脂质含量、酶学水平,以及ASM的蛋白、mRNA表达量与CE含量较TNFα组也呈现明显下降。这表明ASM/CE通路促进脂质积聚、导致脂肪变,Ami可通过抑制ASM/CE通路改善NAFLD肝细胞的脂质沉积及肝功能生化指标,与前述已有的动物实验研究结果一致。
据了解,本研究系国内外首次关于Ami对脂质代谢影响的体外研究。研究表明在NAFLD病理过程中存在ASM/CE调控脂质代谢关键通路的激活,Ami作为ASM的抑制剂可通过调控ASM/CE通路改善NAFLD肝细胞的脂质沉积,提示ASM/CE通路可以作为 NAFLD的潜在治疗靶点,Ami作为靶向治疗药物的可行性,以及ASM、CE作为NAFLD诊断预测标志物的可能性,然而以上结论还需完善NAFLD模型体内实验进一步验证。同时,CE下游代谢产物或信号分子的确切变化规律,以及它们在 NAFLD发生、发展中的生物学作用特征也有待进一步深入研究。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突,特此声明。
作者贡献声明:刘勤负责课题设计与实验实施,资料收集整理,数据分析,撰写论文;张强参与实验实施,资料收集整理;李蓉负责实验质量控制及论文修改;吴方雄、闫蓉、王佳负责文献收集与整理;牛春燕进行课题设计,审核论文,并对论文负责。

