miR-335-5P 调控的TGF-β 通路介导妊娠糖尿病小鼠胰岛素抵抗和胰岛β 细胞分泌的实验研究
刘 洁温学娜冯 英李元元刘永莉
(1.石家庄市第四医院产科,石家庄 050011; 2.辛集市第一医院产科,河北辛集 052360)
妊娠期糖尿病(gestational diabetes mellitus,GDM)指妊娠期首次发现的胰岛素相对、绝对缺乏或胰岛素抵抗引起的高血糖临床综合征,我国发病率约1%~5%且呈逐年上升趋势[1]。 多数学者认为GDM 与胰岛素抵抗有密切关系,因妊娠期妇女本身存在葡萄糖相对不耐受。 随着孕期增加、机体对胰岛素敏感性增强,孕妇机体不能分泌足够胰岛素来满足机体需求而引起GDM[2-3]。 GDM 患者体内异常的胰岛素抵抗作用可导致体内代谢和生理指标异常,且对促进胰岛β 细胞分泌具有显著作用。 增强胰岛素抵抗作用、促进胰岛β 细胞分泌是治疗GDM 重要方向[4]。 miR-335-5P 抑制剂静脉给药可增强GDM 胰岛抵抗作用,可防止胰岛β 细胞过度分泌[5]。 miR 作为小型非编码 RNA,涉及转录抑制、靶向降解和基因沉默等生物过程[6]。 miR-335-5P 早被证实与人体胰岛素分泌指数呈显著负相关关系[7];且有文献显示在GDM 小鼠体内miR-335-5P 呈高表达,转化因子-β(transforming factor-β,TGF-β)也呈高表达,考虑两者具有协同促进作用[8]。 综合可得,miR-335-5P、TGF-β 可能与 GDM发生和发展有关,但目前对TGF-β 增强机制及对GDM 的影响尚存在争议。 因此本研究就此展开报道,以期探讨 miR-335-5P、TGF-β 与 GDM 胰岛素抵抗和胰岛β 细胞分泌的关系,现将研究结果报道如下。
1 材料和方法
1.1 实验动物
SPF 级 Balb/c 小鼠 105 只,雌性小鼠 70 只,雄性小鼠 35 只;体重 20~25 g,平均(23.56±2.54)kg,6~8 周,购于河北省中西医结合医药研究院[SYXK(冀)2020-006]。 动物使用和处理符合中华人民共和国国家卫生研究院实验动物保护法和使用指导要求,且通过河北省石家庄市医学动物伦理委员会批准(IACUC20180105),于河北医科大学(实验动物公共服务平台)[SYXK(冀)2020-002]完成实验,提供实验环境:室温 18℃ ~22℃、湿度 45% ~50%、12 h 明/12 h 暗、动物自由摄食摄水。 以雌性和雄性小鼠以 2 ∶1于 18℃ ~25℃温度、40%~70%湿度系统中合笼饲养;每天早晨7 点对雌性小鼠进行阴栓检查,发现阴栓即行阴超检查,于光镜下观察精子,精子和阴栓同时可见记为妊娠第1 天;持续观察7 d,7 d 内妊娠雌性小鼠(n=60)列为研究对象。实验过程中掌握熟练轻柔的操作技巧、经常观察小鼠状态、对废弃小鼠实施安乐死等,严格遵守动物实验过程中的3R 原则。
1.2 主要试剂与仪器
链脲佐菌素(湖南汇百侍生物科技有限公司,国药准字 H20020475);无义序列NC(北京百奥莱博科技有限公司);miR-335-5P 模拟物、miR-335-5P抑制剂、si-TGF-β 均购自上海科敏生物科技有限公司;酶联免疫试剂盒(北京索莱宝科技有限公司);注射用异戊巴比妥钠(上海上药新亚药业有限公司, 国药准字 H31021725); 磷酸缓冲盐溶液(Phosphate buffer solution, PBS)购于南京科佰生物科技有限公司;饱和碳酸锂(上海恒远生物科技有限公司);4%多聚甲醛(上海立瑶生物有限公司);二甲苯(北京百奥莱博科技有限公司);75%乙醇、80%乙醇、95%乙醇、100%乙醇购于上海恒远生物科技有限公司;苏木素-伊红(Hematoxylin eosin,HE)染色液试剂盒购于迈瑞生物科技有限公司;中性树胶(南京科佰生物科技有限公司);鼠抗人TGF-β 多克隆抗体(上海田源生物技术有限公司);DAB显色试剂盒(北京百奥莱博科技有限公司);羊抗鼠IgG(上海立瑶生物有限公司);柠檬酸钠缓冲液(长沙达尔锋生物科技有限公司);总RNA 提取试剂盒(上海硕嘉生物科技有限公司);异丙醇(苏州骏宇化工有限公司);反转录试剂盒(山东佰仟化工有限公司);miR-335-5P、TGF-β、c-Myc 引物均购自上海康润生物科技有限公司;琼脂糖(四川科伦药业有限公司);PCR 反应液(北京索莱宝科技有限公司);RT-PCR 扩增试剂盒购于Sigma;TRIzol 裂解液购于迈瑞生物科技有限公司。
1.3 实验方法
1.3.1 建模及干预方法
①将60 只妊娠小鼠分开喂养,随机分为空白组(n=10)和 GDM 组(n=50),禁食 12 h 后 GDM 组腹腔注射50 mg/kg 链脲佐菌素(必要时用0.1 mol/L柠檬酸溶液稀释,15 min 内完成),空白组注射等量柠檬酸溶液;4 h 后投喂普通饲料,自由饮水;于妊娠18 d 采用口服葡萄糖耐量试验(OGTT)测量空腹血糖(fasting blood sugar, FBG)、空腹胰岛素(FIRI)和胰岛素抵抗指数(IRI)。 GDM 组共得GDM 模型小鼠48 只,构建GDM 小鼠成功标准:妊娠第18 天妊娠小鼠 FBG<5.1 mmol/L,且 FIRI、IRI 均升高;②将48 只成功构建GDM 模型的小鼠随机分成A、B、C、D、E、F 组,每组各 8 只小鼠,A 组(模型组)、B 组(模型组+无义序列 NC 溶媒)、C 组(模型组+miR-335-5P 模拟物)、D 组(模型组+miR-335-5P 抑制剂)、E 组(模型组+si-TGF-β)、F 组(模型组+miR-335-5P 抑制剂+si-TGF-β),均经尾静脉注射,注射后可正常饮食和饮水。
1.3.2 OGTT 实验
妊娠第17 天晚上禁食禁水8 ~10 h,次日晨抽取空腹尾静脉血后灌喂2.0 g/kg 葡萄糖水溶液,并于服糖后0.5 h、1 h、2 h 同法抽取尾静脉血,1000 r/min 离心20 min 进行血清分离并存于-80℃冰箱中;采用血糖仪和血糖试纸条测量血糖浓度,图谱记录口服葡萄糖耐量;放射免疫法测定FINS,仪器为I2000sk 化学发光免疫分析仪(美国雅培生物有限公司);根据公式 IRI=-Ln(1/FINS×FPG)计算IRI,IRI 越大,表明机体对胰岛素敏感度越低,胰岛素抵抗力越强。
1.3.3 高葡萄糖钳夹技术
妊娠第19 天从GDM 组中各选择4 只小鼠共24 只、空白组中选择5 只小鼠进行高血糖钳夹技术:禁食4 h,经腹腔麻醉注射剂量为50 mg/kg 戊巴比妥钠,固定和颈静脉插管;待小鼠状态稳定后通过尾尖收集血样50 μL 用于测定FBG 和FINS;通过颈静脉插管注射初始剂量葡萄糖100 mg/kg 后,连续注射20%葡萄糖溶液,每5 min 监测血糖;调节葡萄糖输注速率(glucose infusion rate, GIR)使血糖维持于(14.0±0.5)mmol/L;在血糖稳定后5 个时间点获得平均GIR 作为稳态GIR;收集初始剂量葡萄糖负荷后1~15 min 内处于稳定状态的血液样品,确定第一时相胰岛素和最大胰岛素分泌;根据GIR 值观察β 细胞功能。
1.3.4 HE 染色
妊娠第19 天选择未经高血糖钳夹技术小鼠(GDM 组中各4 只小鼠共24 只、空白组中5 只小鼠)进行空气栓塞法处死,取小鼠胰岛组织用10%甲醛溶液固定,修剪,梯度乙醇脱水,二甲苯透明,石蜡包埋成块,切成5 μm 连续切片,二甲苯脱蜡,梯度乙醇脱水,苏木素染色,流水冲洗,1%盐酸溶液分化数秒,流水冲洗,伊红染色,梯度乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察HE 染色结果。
1.3.5 免疫组织化学法
取得“1.3.4”中样品于10%甲醛溶液中进行固定,脱水,用石蜡包埋,切成4 μm 连续切片,依次脱蜡、修复、梯度乙醇水化、PBS 漂洗、内源性过氧化物酶活性消除;滴加小鼠抗人TGF-β 多克隆抗体(浓度1 ∶100)4℃孵育过夜,PBS 漂洗;滴加即用型生物素化二抗37℃孵育30 min,PBS 漂洗;滴加辣根酶标记链霉卵白素工作液,37℃孵育20 min,PBS 漂洗,经DAB 显色、苏木素复染、脱水,透明,封片,用于观察TGF-β 表达。 判定标准:由两名具有执业资格的病理科医生采用双盲法对结果进行判断和分析,染色强度:0 分为不着色,1 分为淡黄色,2 分为深黄色,3 分为棕黄色;阳性细胞百分率:0 分为阳性细胞百分率0%~5%,1 分为阳性细胞率5%~25%,2 分为阳性细胞率26%~50%,3 分为阳性细胞率51%~75%,4 分为阳性细胞百分率>75%;两项之和进行综合判定:≤3 分为阴性,>3 分为阳性。
1.3.6 RT-PCR 法
采用总RNA 提取试剂盒提取血液总RNA,总RNA 逆转录成cDNA,以此cDNA 为模板参照引物和探针序列进行扩增,反应条件为:95℃预变性120 s,95℃变性30 s,72℃退火延伸15 s,35 次循环。 根据扩增曲线读取循环数(Ct),基因的相对表达量=2-△△Ct,以 β-actin 和 GAPDH 为内参照,计算 GDM小鼠血清中 miR-335-5P、TGF-β、c-Myc 含量。
1.4 统计学方法
采用SPSS 21.0 软件进行统计分析,多组间计量资料比较采用单因素方差分析,两组间比较采用Snk-q检验;采用非参数检验Mann-Whitney 法检验分级资料;P<0.05 为差异有统计学意义。
2 结果
2.1 各组OGTT 实验指标比较
空白组给药前后 FBG、FIRI、IRI 均低于 GDM 组(P<0.05);给药前,GDM 各组 FBG、FIRI、IRI 比较P>0.05;给药后,A、B 组 FBG、FIRI、IRI 与给药前比较 P>0.05,D、F 组 FBG、FIRI、IRI 低于给药前低于C、E 组(P<0.05);见表1。
2.2 各组胰岛β 细胞功能比较
空白组给药前后GIR、第一时相胰岛素、最大胰岛素均高于 GDM 组(P<0.05);给药前,GDM 组GIR、第一时相胰岛素、最大胰岛素比较P>0.05;给药后,A、B 组GIR、第一时相胰岛素、最大胰岛素与给药前比较P>0.05,D、F 组GIR、第一时相胰岛素、最大胰岛素高于给药前高于C、E 组(P<0.05),C、E组GIR、第一时相胰岛素、最大胰岛素低于给药前(P<0.05);见表2。
2.3 各组胰岛 β 细胞中 miR-335-5P、TGF-β 通路关键因子表达水平
空白组胰岛 β 细胞中 miR-335-5P、TGF-β、c-Myc 表达低于 GDM 组(P<0.05);C、E 组 miR-335-5P、TGF-β、c-Myc 表达升高,D、F 组 miR-335-5P、TGF-β、c-Myc 表达下降;且 D、F 组 miR-335-5P、TGF-β、c-Myc 表达低于 C、E 组低于 A、B 组(P<0.05);见图1。
2.4 miR-335-5P 与 TGF-β、c-Myc 关系
TGF-β 在胰岛β 细胞胞质内表达、为棕黄色,c-Myc 在胰岛β 细胞胞质或细胞膜内表达、可显示为黑色颗粒,在胰岛β 细胞中检测到miR-335-5P 表达时,TGF-β、c-Myc 均有不同程度表达,见图2。 D、F组 TGF-β 表达高于 C、E 组高于 A、B 组(P<0.05),见图3、图4。
表1 各组OGTT 实验指标比较( ±s)Table 1 Comparison of OGTT experimental indexes among groups

表1 各组OGTT 实验指标比较( ±s)Table 1 Comparison of OGTT experimental indexes among groups
注:给药后,与 A 组比较,①P<0.05;与 B 组比较,②P<0.05;与 C 组比较,③P<0.05;与 D 组比较,④P<0.05;与 E 组比较,⑤P<0.05。Note.After administration, Compared with group A, ①P<0.05.Compared with group B, ②P<0.05.Compared with group C, ③P<0.05.Compared with group D, ④P<0.05.Compared with group E, ⑤P<0.05.
组别Groups例数n空腹血糖(mmol/L)FBG空腹胰岛素(mIU/L)FIRI胰岛素抵抗指数IRI给药前Before给药后After给药前Before给药后After给药前Before给药后After空白组Blank group 10 2.63±0.41 2.58±0.36 19.11±6.63 18.44±5.21 2.43±0.65 2.41±0.74 A 组Group A 8 5.43±1.54 5.51±1.69 26.68±8.46 27.32±7.54 6.21±2.30 6.30±2.18 B 组Group B 8 5.55±1.62 5.49±1.73 25.71±9.97 26.01±8.66 6.18±2.26 6.28±2.24 C 组Group C 8 5.34±1.60 8.21±2.65①②④ 24.88±9.63 40.52±12.67①②④ 6.24±2.34 4.15±1.41①②④D 组Group D 8 5.60±1.46 3.11±0.42①②③⑤ 25.93±9.89 20.20±4.33①②③⑤ 6.30±2.18 3.05±0.06①②③⑤E 组Group E 8 5.62±1.55 8.33±2.53①②④ 26.35±8.57 41.36±13.68①②④ 6.23±2.41 4.22±1.23①②④F 组Group F 8 5.51±1.44 5.36±1.01①②③④⑤ 26.42±8.84 25.16±7.60①②③④⑤ 6.34±2.27 3.66±0.68①②③④⑤
表2 各组胰岛β 细胞功能比较( ±s)Table 2 Comparison of islet β cell function in each group

表2 各组胰岛β 细胞功能比较( ±s)Table 2 Comparison of islet β cell function in each group
注:给药后,与 A 组比较,①P<0.05;与 B 组比较,②P<0.05;与 C 组比较,③P<0.05;与 D 组比较,④P<0.05;与 E 组比较,⑤P<0.05。Note.After administration, Compared with group A, ①P<0.05.Compared with group B, ②P<0.05.Compared with group C, ③P<0.05.Compared with group D, ④P<0.05.Compared with group E, ⑤P<0.05.
组别Groups例数n葡萄糖输注速率mg/(kg·min)GIR第一时相胰岛素(ng/mL)First-phase insulin最大胰岛素(ng/mL)Maximum insulin给药前Before给药后After给药前Before给药后After给药前Before给药后After 5 30.54±12.36 30.10±15.45 18.26±5.64 18.51±5.14 202.43±50.65 203.61±49.87空白组Blank group A 组Group A 4 20.11±13.02 19.89±12.04 11.13±3.21 10.65±3.36 126.32±32.30 128.32±32.61 B 组Group B 4 20.43±12.65 20.14±11.58 10.79±3.55 11.06±3.43 128.63±30.54 126.74±30.87 C 组Group C 4 19.86±12.87 13.02±8.54①②④ 11.26±3.31 6.24±2.16①②④ 126.51±29.87 100.30±12.35①②④D 组Group D 4 20.33±13.13 28.63±14.21①②③⑤ 11.22±3.54 17.68±4.21①②③⑤ 126.74±30.51 193.54±35.30①②③⑤E 组Group E 4 20.14±12.25 13.32±8.36①②④ 10.87±3.20 6.13±2.30①②④ 127.69±32.13 104.15±11.36①②④F 组Group F 419.87±12.3621.49±10.72①②③④⑤ 11.16±3.18 15.09±3.54①②③④⑤ 1 2 6.59±33.06178.62±15.78①②③④⑤
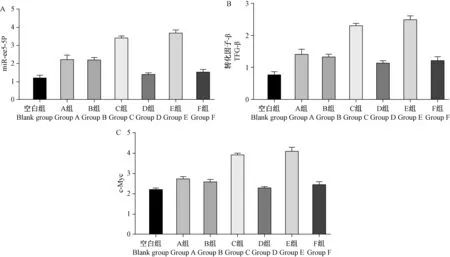
图1 各组胰岛β 细胞中miR-335-5P、TGF-β 通路关键因子表达水平Figure 1 Expression level of miR-335-5P and TGF - β key factors in islet β cells of each group
3 讨论
目前,关于GDM 发病机制主要归纳为:孕妇妊娠期间分泌孕激素、糖皮质激素、胎盘生乳素等具有胰岛素抵抗作用的激素;且随着孕周增加含量随之升高,造成体内肝、肌肉等组织对胰岛素敏感性下降,若无法补偿胰岛素抵抗的增加,可引起体内高胰岛素和高血糖,进而发展为GDM[9]。 GDM 可导致孕妇血糖、脂肪、蛋白质代谢功能紊乱,发生巨大儿、羊水过多、自然流产、胎儿畸形、死胎、死产、新生儿低血糖、高胆红素血症、孕妇酮症酸中毒等,对母婴危害较大[10]。 基于GDM 发病机制,最新研究认为胰岛素抵抗和胰岛β 细胞分泌与该病发生和发展关系密切。

图2 miR-335-5P 与 TGF-β、c-Myc 关系Figure 2 Relationship between miR-335-5P,TGF-β and c-Mycall

图3 TGF-β 阳性表达图Figure 3 TGF - β positive expression

注:A、B、C、D、E、F 分别表示为 A 组、B 组、C 组、D 组、E 组、F 组。图4 免疫组织化学染色图Note.A, B, C, D, E and F were expressed as group A, B, C, D, E and F, respectively.Figure 4 Immunohistochemical staining
早有研究证实,TGF-β 信号可调控细胞增殖、分化、凋亡及胚胎发育等,而TGF-β 信号通路的精准调控对疾病治疗具有积极意义[11]。 有研究指出在胰岛细胞损伤应答过程中,miR-335-5P 与TGF-β 信号通路间存在一定交叉对话,提示miR-335-5P 可能对调控 TGF-β 有一定价值[12]。 张琳[13]的研究指出,miR-335-5P 通过与胰岛表皮因子竞争结合位点抑制胰岛α 细胞糖化,由此激活各种细胞因子引起的TGF-β 信号通路,从而阻断其分泌胰高血糖素。miR-335-5P 现已广泛应用于各种疾病治疗,且在肝癌、乳腺癌等多种肿瘤疾病中均有应用。 本研究结果显示,miR-335-5P 上调,可提高 FBG、FIRI、IRI 水平,进一步减少胰岛素分泌,这与赵茜等[14]的研究结果较为一致。 探讨miR-335-5P 作用机制,考虑其临床有效性与激活TGF-β 信号转导通路,提高 c-Myc 表达有关。 c-Myc 是近年来发现的一个新的TGF-β 信号调控因子;且在多篇研究中已指出 c-Myc 可提高TGF-β 稳定性,促进其信号传递和靶基因转录[15-16];石永英等[17]文献指出c-Myc 可提高TGF-β 对癌细胞增殖、分化抑制作用。 综合文献可得,探讨c-Myc、TGF-β 表达水平可提高对机体分化和死亡情况预测价值。 另Tagoma 等[18]在研究中已表明,miR-335-5P 对减少胰岛素信号传导及脂质代谢相关基因有重要价值;Wang 等[19]发现miR-335-5P 表达较高组,胰岛素表达下降;Osorio-Yanez等[20]将miR-335-5P 作用于人胰岛细胞,发现其能特异性阻断炎性因子介导的信号转导通路,而激活TGF-β 通路信号。 这些发现与本研究结果一致,提示 miR-335-5P 可提高 TGF-β 表达。 为进一步证实miR-335-5P 与TGF-β 之间的关系,本文对其相对表达量进行探讨分析,得在胰岛β 细胞中miR-335-5P表达时,TGF-β、c-Myc 均有不同程度表达,且 miR-335-5P 上调时 TGF-β、c-Myc 表达也升高。 而当TGF-β、c-Myc 和 miR-335-5P 均呈高表达时,发现胰岛β 细胞中液泡和无序细胞减少,提示TGF-β、miR-335-5P 对GDM 小鼠葡萄糖耐量和胰岛素抵抗改善具有促进作用。
综上,miR-335-5P 通过激活TGF-β 信号通路对GDM 胰岛素抵抗和胰岛β 细胞分泌产生积极作用,可为GDM 治疗提供临床依据。 但由于本实验受时间限制,且实验主要涉及动物有待探索更多研究对象作进一步研究。

