超声造影联合超微血管成像在胆囊隆起性病变诊断中的应用
田思雨,戴 婷,孙志霞,刘美含
(吉林大学中日联谊医院 超声科,吉林 长春130033)
胆囊隆起性病变(PLG)又称胆囊息肉样病变,是指胆囊壁向胆囊腔内隆起的、或呈息肉样生长的所有非结石病变的统称,病理学上分为非肿瘤性病变和肿瘤性病变[1]。已有研究证实,肿瘤性病变的生长、浸润和转移均受新生血管影响[2],尽管常规二维超声检查能够清晰显示直径≥2 mm的病灶,彩色多普勒血流显像(CDFI)能初步判断病灶内的血流情况,然而对于微小、低速的血管显示并不理想,对于PLG性质的鉴别价值有限[3-4]。超声造影(CEUS)和超微血管成像(sSMI)是近年来超声领域的研究热点,是评价病灶内血流灌注的新技术。本研究通过对比上述两种检查方法,以探讨CEUS及SMI技术在胆囊隆起性病变诊断中的应用价值。
1 资料与方法
1.1 一般资料
收集2019年1月至2020年7月于吉林大学中日联谊医院收治的胆囊隆起性病变患者49人。其中男性22人,女性27人,年龄28-75岁,平均(52.67±12.97)岁。病灶直径1.0-3.2 cm,平均(1.33±0.44)cm。纳入标准:患者被告知检查方法及目的并签署知情同意书;病灶最大径线≥1.0 cm;具备完整的病理资料及临床资料。排除标准:患者不同意超声造影检查;存在超声造影禁忌症;未获得明确病理诊断。本研究为前瞻性研究,经吉林大学中日联谊医院医学伦理委员会批准。
1.2 设备和方法
常规超声及SMI检查使用Toshiba Apli0500超声诊断仪,探头频率2.0-3.5 MHz。CEUS检查使用Esaote MyLabTwice超声诊断仪,探头中心频率3.5 MHz。超声造影剂使用声诺维(SonoVue),造影前用生理盐水稀释造影剂冻干粉末(SF6)成混悬液,经肘部浅静脉团注。
常规超声检查:嘱患者空腹8-12 h,取仰卧位及左侧卧位,连续、多切面扫查,重点观察病灶的大小、回声、数目和胆囊壁连续性等。启用CDFI模式,观察病灶内部及附着处胆囊壁的血流情况。超微血管成像:保持体位不变,嘱患者平静吸气末屏气,启动SMI模式,于血流最丰富切面冻结,观察病灶内部及周边的血流分布情况。超声造影检查:患者体位不变,选取病灶径线最大切面,启动超声造影双幅成像,经肘正中静脉快速团注1.5 ml对比剂,随即快速冲注生理盐水5 ml,实时观察并保存动态造影过程,观察时间≥3 min。
图像判定标准:图像由两位有10年以上工作经验的超声医师共同讨论进行诊断。(1)CEUS诊断标准[5-6]:时相划分,0-30 s为增强早期,31-180 s为增强晚期;增强水平以病灶周围胆囊壁为参考;增强形态以均匀和非均匀描述;增强早期血管形态分为点状、单支状、分支状和不规则状;胆囊壁连续性以黏膜面是否连续或有无局部异常增强判断。非肿瘤性病变以 “慢退或同退、低或等增强、点状或单支状血管、壁连续”作为诊断的主要标准;肿瘤性病变以 “快退、高增强、分支状或不规则状血管、壁不连续”作为诊断的主要标准。(2)SMI诊断标准参考Adler半定量法进行判断[7-8]:0级,病灶内无血流信号;1级,病灶内见1-2个点状或短条状血流信号;2级,病灶内见3-4个点条状或1条主要血流信号;3级,病灶内见5个以上点条状或2条以上长条状血流信号。0-1级倾向考虑为非肿瘤性病变,2-3级倾向考虑为肿瘤性病变。
1.3 统计学处理
应用SPSS 22.0软件进行统计学分析。计量资料采用均数±标准差表示,以病理结果为金标准,分别计算CEUS、SMI及CEUS联合SMI 3种检查模式的敏感度、特异度、阳性预测值、阴性预测值及准确度,构建受试者工作特征曲线 (ROC),计算曲线下面积(AUC)。采用Z检验比较,以P<0.05为差异有统计学意义。
2 结果
2.1 病理检查结果
根据病理诊断结果分为两组。(1)非肿瘤性病变组:共29例,胆囊胆固醇性息肉18例,胆囊腺肌增生症11例;年龄28-75岁,平均(49.55±13.62)岁,病灶大小1.0-1.5 cm,平均(1.16±0.23)cm。(2)肿瘤性病变组:共20例,胆囊腺瘤13例,胆囊癌7例。年龄33-73岁,平均(57.4±10.63)岁。病灶大小1.0-3.2 cm,平均(1.58±0.55)cm。
2.2 CEUS和SMI诊断结果与病理结果比较
(1)CEUS图像分析:非肿瘤性病变组主要表现为同退或慢退,增强水平多为等增强或高增强,增强形态均匀,呈点状血管,胆囊壁连续,无异常强化。肿瘤性病变组主要表现为快退,高增强,增强形态不均匀,呈分支状和不规则状血管,胆囊壁不连续或黏膜面有异常增强,见表1。(2)SMI图像分析:非肿瘤性病变Adler分级主要为0级和1级,肿瘤性病变SMI血流分级主要为2级和3级,见表2。(3)CEUS及SMI误诊病例:肿瘤性病变组中,CEUS诊断错误4例,SMI诊断错误3例;非肿瘤性病变组中,CEUS诊断错误4例,SMI诊断错误5例,见表3。(4)应用CEUS、SMI及CEUS联合SMI诊断肿瘤性PLG的灵敏度、特异度、阳性预测值、阴性预测值、准确度及AUC详见表4、图1。CEUS与SMI在诊断效能方面差异无统计学意义(Z=1.20,P>0.05)。CEUS与SMI联合应用诊断的灵敏度、准确度均最高。
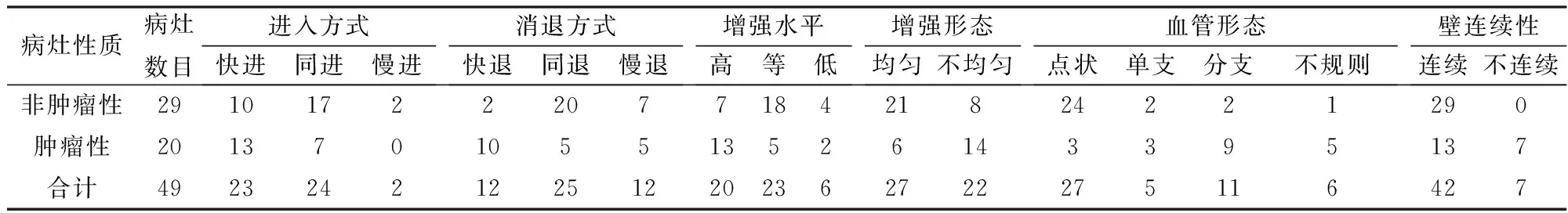
表1 超声造影增强方式与病理结果对照(个)
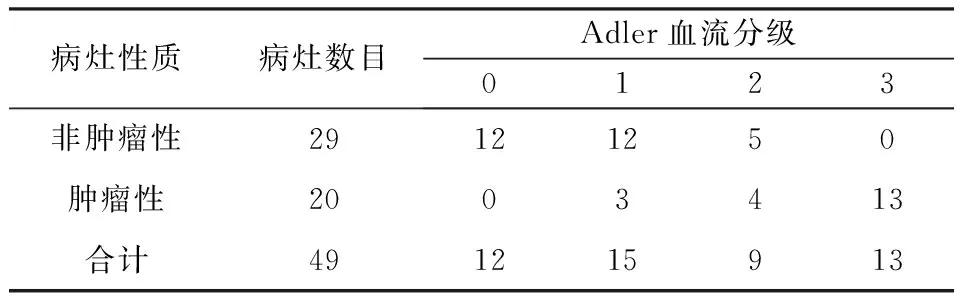
表2 SMI血流分级与病理结果对照(个)

表3 CEUS、SMI与病理结果对照(个)
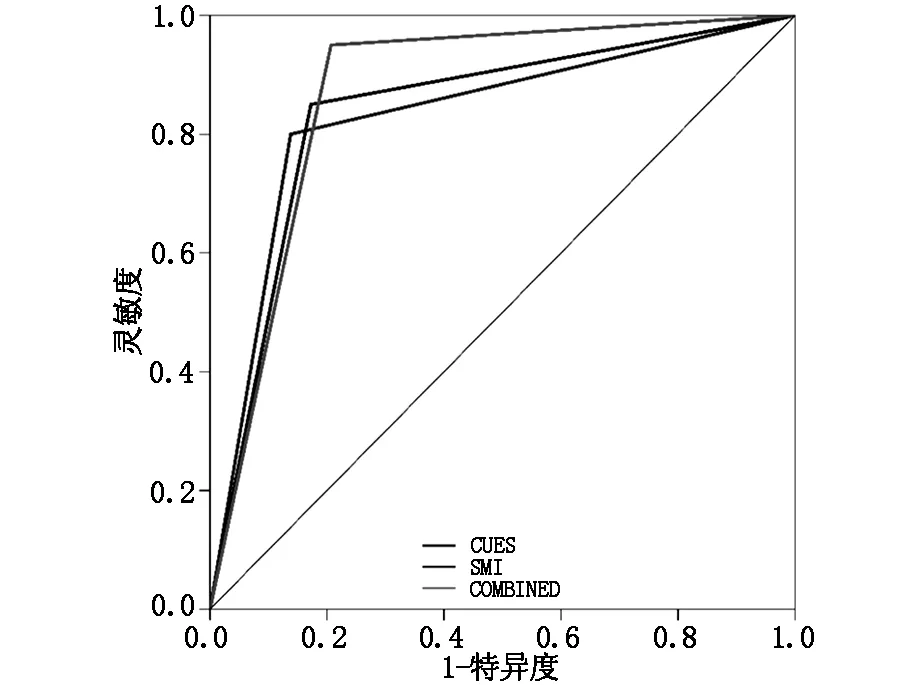
图1 应用CEUS、SMI及CEUS联合SMI诊断肿瘤性PLG的ROC曲线
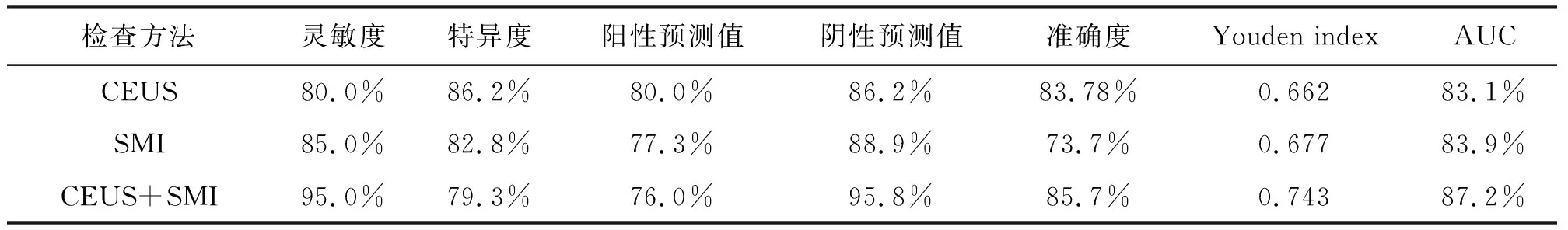
表4 CEUS、SMI、CEUS联合SMI三种方法诊断价值比较
3 讨论
PLG在病理学上分为非肿瘤性病变与肿瘤性病变,前者主要包括胆固醇性息肉、炎性息肉和腺肌增生症,后者主要包括腺瘤,胆囊癌和转移癌等[1-2]。非肿瘤性病变多为胆固醇性息肉,可以临床观察、定期随访;肿瘤性病变以腺瘤居多,潜在恶性,且体积越大恶性几率增加,是外科手术的绝对适应症[9]。尽管目前研究认为最大径线≥1.0 cm的PLG有恶变倾向,但通过回顾我院近年来手术切除的PLG病例发现,长径在0.4-0.9 cm的腺瘤性息肉内亦可发生不同级别的不典型增生甚至原位癌。这与Roa等[10]的研究结果一致,故对于拟诊为胆囊肿瘤性病变的患者,无论病灶大小均应行积极的手术切除治疗[9-11]。
影像学检查技术对于病灶内新生血管、微血管的评价有助于PLG肿瘤性病变与非肿瘤性病变的鉴别。CEUS检查为纯血池显像,较CDFI能更敏感、更真实地反映病灶大小和其内的血流灌注情况,且能实时动态观察[12]。SMI技术通过计算机自适应算法抑制组织运动产生的信号,识别并提取真正的血流信号,最低可显示管径为1 mm或速度为1 cm/s的微血流[13-14]。
在本研究非肿瘤性病变组中,胆固醇性息肉CEUS表现为增强早期与胆囊壁同步、均匀的等增强,病变附着处胆囊壁无异常强化,血管形态为点状;SMI无明显血流信号或偶检出小点状血流信号,评为0或1级。胆囊腺肌增生症CEUS增强早期病灶边缘呈不均匀的、等或稍高增强,隆起处胆囊黏膜连续、呈细线样,中心呈低增强,内可见小灶状无增强区为其特征性表现,原因可能是黏膜过度增生、内陷,深入肌层形成的小囊腔内无造影剂充填所致;SMI血流信号多为0或1级,较大者可显示为2级血流信号。肿瘤性病变组中,胆囊腺瘤CEUS多表现为快进慢退,呈均匀的、持续的高增强,内见单支状或分支状血管,胆囊壁连续,当病变附着处有异常强化时要警惕腺瘤伴恶变可能[15];SMI多可见一短条状血流信号,评为2级。胆囊癌的CEUS多表现为增强早期快速的、不均匀的高增强,增强晚期快退、呈低增强,血管形态多为分枝状,较大的或有周围侵犯者表现为不规则状血管,胆囊壁有不同程度的破坏,病变附着处黏膜面不连续,或呈异常高增强;SMI血流信号较多、杂乱,为3级。
分析部分典型误诊病例。其中1例胆囊癌CEUS表现与胆囊腺肌增生症相似,增强早期病灶与其附着处胆囊壁同步增强,边界清晰,呈稍高增强,内见小片状无增强区,增强晚期慢退呈低增强,被归为非肿瘤性病变组;SMI检查病灶内见2处条状血流信号,评为3级,被归为肿瘤性病变组。综合临床资料、常规超声、CEUS及SMI表现分析,超声检查提示为肿瘤性病变,倾向胆囊癌,后经病理结果证实为胆囊腺癌,癌肿内伴灶状坏死。有2例胆囊腺瘤,SMI检查血流丰富,呈长条状,评为3级;CEUS均表现为同进同退、不均匀的高增强、分支型血管,超声提示为肿瘤性病变,倾向胆囊癌,最终病理结果均为腺瘤,局部伴高级别上皮内瘤变。分析上述病例误诊原因可能由于:(1)胆囊腺肌增生症病灶内的囊腔与癌肿内部坏死区在CEUS上均表现为无增强,鉴别有难度;(2)SMI技术检查受患者呼吸配合影响较多,检查者可能将SMI伪像判定为真实的血流信号。所以,对于PLG的鉴别需多指标综合判断,除了对病灶血流灌注的评价,需结合常规超声特点,观察胆囊壁的连续性、有无周围组织侵犯及异常肿大的淋巴结等其他间接征象。SMI检查前可对患者进行简单的呼吸训练以提高检查时患者的配合度。
综上所述,SMI技术对于PLG血流的显示能力与CEUS有较好的一致性,在诊断效能方面无明显差异。CEUS联合SMI技术,可以提高PLG诊断的灵敏度及准确度,对于有严重肝肾功能障碍不能耐受增强CT或MRI检查的患者,或尚未普及CEUS检查的基层医院,SMI技术为PLG的诊断提供了新的思路和方法,有较高的应用价值。

