非阻塞性冠状动脉粥样硬化患者内皮功能不全的影响因素
谭静,高敬,张迎花,司瑾,左雪冰,李静
(首都医科大学宣武医院心脏内科,北京100053)
内皮功能障碍是非阻塞性冠状动脉疾病(冠状动脉管腔狭窄<50%)患者胸痛发作的病理机制之一[1]。衰老等动脉粥样硬化危险因素通过多种途径介导内皮细胞的结构和功能发生改变,从而引起损伤,内皮祖细胞(endothelial progenitor cells,EPCs)在血管重塑过程中发挥重要作用,其数量或功能异常是导致内皮修复障碍的可能机制之一[2]。本研究通过检测血流介导内皮依赖性血管舒张功能(flow mediated dilatation,FMD),探讨非阻塞性冠状动脉粥样硬化患者内皮功能不全的影响因素。
1 对象与方法
1.1 研究对象
选取2013年6月至2015年6月首都医科大学宣武医院心脏内科收治的冠状动脉非阻塞性粥样硬化症(冠状动脉管腔狭窄<50%)患者110例,年龄36~85(60.9±10.8)岁,其中男性46例,女性64例。纳入标准:因胸痛疑诊冠心病、并经冠状动脉造影检查证实为冠状动脉非阻塞性粥样硬化症。排除标准:(1)心肺大血管及外周血管疾病、心肌病、心脏瓣膜病、心力衰竭、脑卒中;(2)肿瘤、甲状腺疾病、自身免疫性疾病;(3)严重肝肾功能异常以及合并急、慢性感染。根据FMD分为2组:对照组(n=32)和内皮功能不全组(n=78)。本研究经我院伦理委员会批准,患者或家属均签署知情同意书。
1.2 方法
1.2.1 资料收集 由专业培训人员采用标准化问卷调查进行资料收集,内容包括:(1)人口学资料;(2)传统心血管疾病危险因素,如高血压、高脂血症、糖尿病、吸烟史等;(3)病情描述;(4)治疗药物;(5)实验室检测指标;(6)测量身高、体质量,计算体质量指数=体质量(kg)/身高(m2)。
1.2.2 冠状动脉造影 采用5F造影导管经桡动脉途径行冠状动脉造影,冠状动脉狭窄程度由心导管医师采用Gensini评分定量评价,冠状动脉有粥样硬化斑块但管腔狭窄<50%定义为非阻塞性冠状动脉粥样硬化。
1.2.3 FMD检测 由同一位超声专业研究者操作,使用美国飞利浦IE33彩色多普勒超声仪对肱动脉扫描。受试者取仰卧位,选择右侧上臂肱动脉为受检动脉,该侧手臂轻度外展15°,按照测量血压标准方法将血压计袖带缚于上臂,袖带下缘位于肘横纹上5 cm处。以纵切面扫描肱动脉,扫描位置取肘横纹处至肘上3~5 cm。首先记录基础肱动脉二维图像及其多普勒血流频谱,然后将袖带充气高于收缩压50mmHg(1 mmHg=0.133 kPa),并完全阻断血流5 min,5 min内监测袖带内压力,使压力波动不超过10 mmHg。5 min后迅速放气,记录放气前30 s至放气后2 min内肱动脉二维图像及放气后15 s内肱动脉多普勒血流信号图像。一般FMD>10%为正常值[3],FMD≤10%为存在内皮功能不全。FMD=(动脉反应性充血后内径-动脉基础内径)/动脉基础内径×100%。
1.2.4 EPCs检测与鉴定 将CD133/KDR、CD34/KDR或CD34/CD133/KDR表面抗原双阳性或全部阳性的细胞定义为EPCs,采集外周血进行直接免疫荧光标记,经BD LSRFortessa流式细胞仪(BD Biosciences,美国)检测计数,并以BD FACS Diva软件(BD Biosciences,美国)做数据处理,计数CD133+/KDR+、CD34+/KDR+以及CD34+/CD133+/KDR+细胞,以每105个单核细胞中上述细胞的个数作为计数单位。
1.3 统计学处理
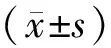
2 结 果
2.1 2组患者临床资料比较
内皮功能不全组患者的年龄显著高于对照组(P=0.002),FMD、血清总胆固醇及低密度脂蛋白胆固醇水平均显著低于对照组(P<0.05;表1)。
2.2 2组患者循环EPCs计数比较
2组患者CD133+/KDR+,CD34+/KDR+及CD34+/CD133+/KDR+循环EPCs数量比较,差异无统计学意义(P>0.05;表2)。
2.3 影响内皮功能不全的多因素分析
以是否存在内皮功能不全为因变量,以单因素分析中P<0.200的因素为自变量,进行多因素logistic回归分析。结果显示,年龄是影响内皮功能不全的独立危险因素(P<0.05),即年龄增长,内皮功能不全的危险性增加(表3)。
3 讨 论
内皮不仅是血管壁的屏障,还能合成和分泌多种生物活性物质,具有维持血管张力、调节血压以及平衡凝血与抗凝等功能。内皮功能障碍是动脉粥样硬化的始动环节,并参与动脉粥样硬化的进展,可增加心血管事件发生风险。血管内皮功能检测对于早期识别、预防管理及有效干预血管疾病的进展具有重要意义。FMD反映了血流介导的内皮细胞一氧化氮释放功能,作为简单、无创的评估内皮功能的方法广泛应用于临床。研究发现,FMD与已知的动脉粥样硬化危险因素相关[4],并独立于传统的危险因素,对心血管事件发生风险具有附加的预测价值[5]。我们通过检测FMD,发现非阻塞性冠状动脉粥样硬化患者内皮功能不全的独立影响因素是年龄,循环EPCs数量并未发生显著性变化。
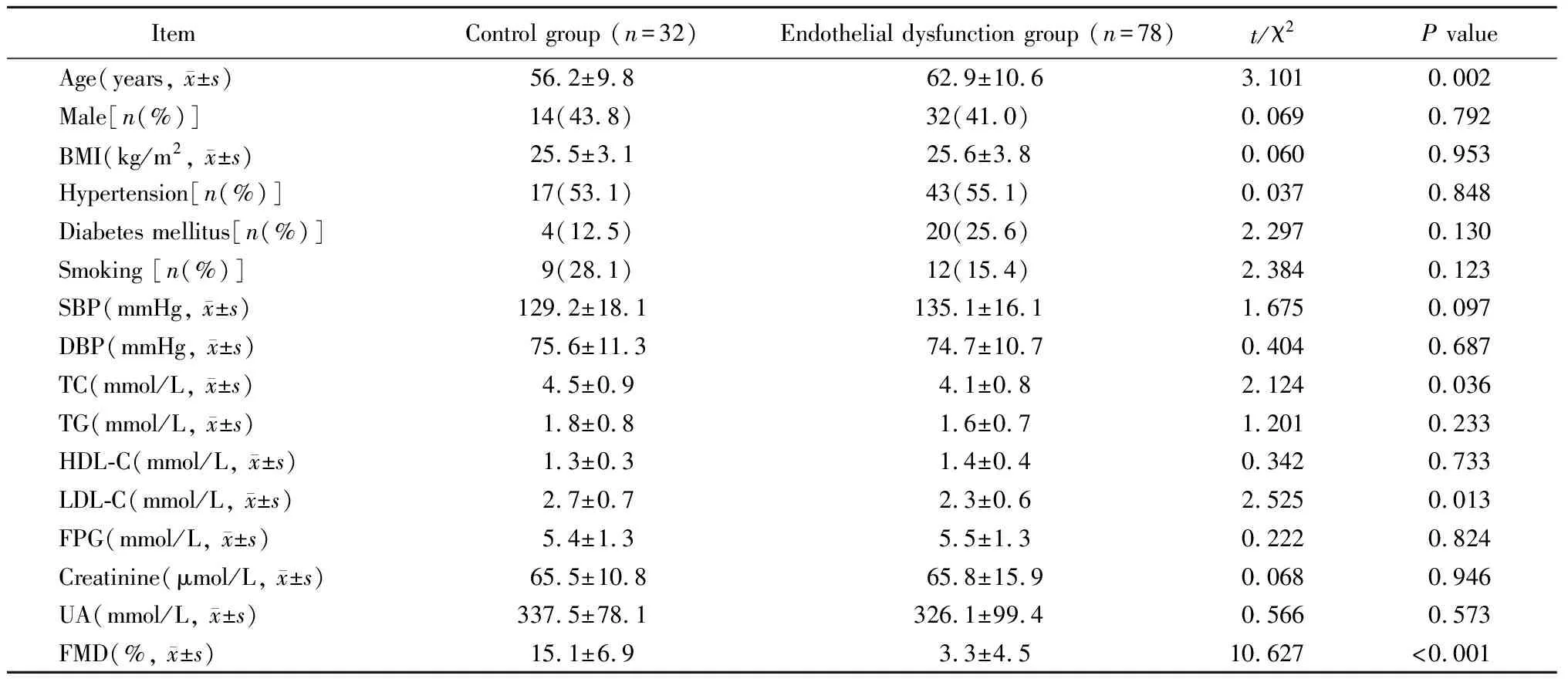
表1 2组患者临床资料比较Table 1 Comparison of clinical characteristics between two groups

表2 2组患者循环EPCs计数比较

表3 内皮功能不全影响因素的logistic 回归分析Table 3 Logistic regression analysis of influencingfactors for endothelial dysfunction
EPCs来源自骨髓,可通过检测细胞表面特有的抗原标志物来鉴定,如CD34+、CD133+、KDR+等广泛应用于EPCs的识别[6,7]。基础研究发现,缺血、损伤、应激等因素可使骨髓源性EPCs向外周血迁移,使循环EPCs的数量和活性提高,促进血管再生和损伤血管的再内皮化,但临床研究结论并不一致。Hill等[8]对45例无心血管疾病人群研究发现,外周血循环EPCs数量与Framingham危险评分、血流介导的肱动脉反应性均密切相关,认为EPCs数量可作为反映血管功能和心血管危险的替代生物标志物。而一项对1 948例社区人群的研究发现[9],调整了传统危险因素后,循环EPCs数量与血管功能或动脉僵硬度并无明显相关性。Lev等[10]研究发现,循环EPCs数量减少与晚期支架内血栓形成有关。而另一项对接受经皮冠状动脉介入治疗患者随访1年的研究发现[11],循环EPCs数量与冠状动脉再狭窄及不良心血管事件无显著相关性。
衰老对内皮细胞的影响表现在多个方面,不仅可使细胞形态发生改变,如胞体增大、胞核明显甚至双核、胞质内颗粒增加变浑浊,也可使其生理、生化等方面也发生变化,如线粒体、内质网等细胞器减少退化、氧化磷酸化功能障碍。衰老机体氧化应激增强,从而促进内皮细胞凋亡、打破内皮源性舒张和收缩因子平衡,最终导致内皮损伤[12]。内皮功能随增龄变化的规律是普遍现象,但其对合并心血管疾病危险因素人群的损害更为明显。一项对无动脉粥样硬化危险因素的健康人群的研究发现[13],男性在40岁以后FMD每年下降0.21%,女性50岁以后FMD每年下降0.49%。Saka等[14]研究证实,FMD在健康人群中随年龄增加而下降,在合并高血压的人群中,随增龄下降的趋势更显著。另外,衰老导致的血管内皮修复能力减退也是影响因素之一。有研究认为,随着年龄增长,循环EPCs数量减少,然而也有研究结果与之相矛盾[15,16]。Heiss等[17]研究发现,健康老年人较青年人FMD降低,循环EPCs(CD34/KDR或CD133/KDR双阳性细胞)数量并没有显著差异,但EPCs存活、迁移、增殖功能减退,提示随着年龄增加内皮依赖性血管舒张功能减退与EPCs功能减退相关。
综上,衰老作为动脉粥样硬化性心血管病的重要危险因素已经确立,年龄增长可导致血管内皮功能受损,但血管内皮功能、心血管事件风险是否与循环EPCs数量、功能存在相关性,文献报道并不一致,考虑原因可能与研究人群不同、EPCs检测鉴定方法不同以及样本量不同等因素有关。本研究未发现非阻塞性冠状动脉粥样硬化患者内皮功能不全与循环EPCs数量有关,衰老导致血管内皮损伤及修复障碍的机制仍有待进一步揭示。

