乳香通过PTEN/Akt/COX-2通路诱导胃癌细胞SGC7901凋亡
孙梦雪,何晓璞,黄佩云,刘高双,吴胜男,孙为豪
(南京医科大学第一附属医院老年消化内科,南京210029)
胃癌是全球范围内最常见的消化系统肿瘤之一。目前胃癌的主要治疗方法包括手术、放疗和化疗,但是预后均较差[1]。因此,继续寻找有效的天然抗肿瘤药物并探究其作用机制具有重要意义。乳香是乳香树或同属植物树皮渗出树脂的活性成分。现已证实,乳香中分离纯化的乳香酸在肝癌、前列腺癌、结肠癌和恶性胶质瘤等肿瘤中具有抗癌功效[2]。胃癌被认为是与幽门螺旋杆菌感染相关的炎症性疾病,之前研究表明,乳香可以通过其抗炎机制抑制幽门螺旋杆菌感染,诱导胃癌细胞凋亡,从而阻止胃癌的进展[3]。
环氧化酶2(cyclooxygenase-2,COX-2)是肿瘤预防和治疗的靶点。COX-2参与胃癌发生发展的相关过程,如血管生成、侵袭和免疫逃避等[4]。COX-2受多种因素和信号通路的调控,在所有的上游调控因子中,PI3K/蛋白激酶B(protein kinase B,PKB, 亦称Akt) 通路的激活对COX-2的调控非常重要[5-7]。同源性磷酸酶张力蛋白(phosphatase and tensin homology deleted on chromosome ten,PTEN)是第一个被发现的具有磷酸化酶功能的抑癌基因, 在许多肿瘤组织中都存在PTEN缺乏[8]。PTEN拮抗Akt信号通路,当PTEN基因突变或丢失时,Akt信号通路被激活,导致细胞无限增殖形成肿瘤。
本研究以COX-2高表达的人胃癌细胞株SGC7901为研究对象,旨在确定乳香是否能通过PTEN/Akt途径下调胃癌细胞COX-2的表达,从而阻止胃癌的发生和发展。
1 材料与方法
1.1 细胞株、主要试剂及仪器
胃癌细胞SGC7901(中国科学院上海细胞生物学研究所,上海); 乳香(南京大学分子医学重点实验室,南京),配制过程详见文献[9]描述;RPMI-1640培养基、胎牛血清、青/链霉素[以色列Biological Industries(BioInd)公司,以色列];二甲基亚砜、 噻唑兰(MTT)、 凋亡检测试剂盒(上海碧云天生物技术有限公司,上海); PTEN、 p-Akt、 Akt、 COX-2、 GAPDH抗体(Abcam公司,英国);裸鼠(南京青龙山动物场,南京);CO2细胞培养箱(Heraus公司,德国);流式细胞仪(Becton Dickinson公司,美国);蛋白免疫印迹系统(Bio-rad公司,美国)。
1.2 建立人胃癌裸鼠移植瘤模型
所有实验动物的使用均符合南京医科大学动物保护与使用委员会制定的规程。
12只无胸腺裸鼠:雄性,5周龄,体质量18~22 g,无特定病原体级。在(24±2)℃、湿度60%~80%和照明12 h光/暗循环条件下饲养,提供标准的裸鼠饲料及蒸馏水,7 d后开始实验。调整SGC7901细胞浓度为1×107个/ml,每只裸鼠的右侧腋窝皮下接种0.2 ml。在胃癌细胞植入7 d后(肿瘤体积达到0.1 cm × 0.1 cm×0.1 cm),将所有裸鼠随机分成2组,每组6只。实验组裸鼠灌胃乳香80 mg/(kg·d),连续灌胃14 d。对照组裸鼠每日用等体积的生理盐水灌胃。每隔2 d记录裸鼠的体质量,测量肿瘤体积(0.5×最短直径2×最长直径)。
1.3 细胞培养与细胞传代
复苏胃癌SGC7901细胞后,用含有10%胎牛血清和1%青霉素/链霉素的RPMI-1640培养基常规培养。细胞贴壁生长融合至 70%~80%时,用胰酶消化及传代, 接种于新培养皿中继续培养。
1.4 MTT检测乳香对细胞增殖的影响
调整SGC7901细胞浓度为4×104个/ml接种于96孔板,每孔100 μl。不同浓度的乳香0.0、0.5、1.0、2.0、4.0和8.0 mg/ml分别处理细胞12、24和48 h,以只含培养基无细胞为空白对照组。检测时每个孔中加入200 μl MTT(0.5 mg/ml),4 h后加入200 μl二甲基亚砜避光15~20 min。酶标仪检测570 nm波长处各孔的吸光度值(A570nm)。
1.5 流式细胞术检测细胞凋亡
调整细胞悬液浓度为1×105/ml接种于6孔板中,每孔2 ml。用不同浓度的乳香(0.0、0.5、1.0、2.0、4.0和8.0 mg/ml)处理细胞24 h。用不含乙二胺四乙酸的胰酶消化后收集细胞,预冷磷酸缓冲盐溶液(phosphate buffer saline, PBS)漂洗细胞2次,1 ml的结合缓冲液将细胞重悬,加入10 μl的Annexin V 异硫氰酸荧光素和10 μl碘化丙啶(propidium iodide,PI),避光孵育20 min,1 h内完成检测。
1.6 Western blotting检测细胞中相关蛋白的表达
用不同浓度的乳香(0.0、2.0、4.0 mg/ml)处理SGC7901细胞24 h后收集细胞。加入裂解液冰上裂解30 min。4℃,14 000 转/min离心30 min后收上清液。BCA蛋白定量试剂盒测定蛋白浓度。蛋白样品进行聚丙烯酰胺凝胶电泳,电泳后将蛋白转印至聚偏二氟乙烯膜,室温下5%脱脂牛奶封闭1 h,4 ℃一抗孵育过夜。抗体:PTEN(1∶10000),p-Akt(1∶1000),Akt(1∶1000),COX-2(1∶2000)和GAPDH(1∶10000)。4℃二抗孵育2 h,ECL发光试剂盒显影。
1.7 细胞划痕实验检测细胞迁移能力
在6孔板底外用记号笔画3条间隔为0.5 cm的水平直线,将浓度为 4×105/ml的细胞悬液接种于 6孔板中,每孔2 ml,常规培养至 90%融合状态。用 10 μl微量移液器枪尖在细胞板上划垂直于水平线的划痕。PBS清洗 2 次后,在每个孔中加入浓度为0.0、2.0、4.0 mg/ml的乳香培养48 h。于划痕后0、24、48 h用显微镜(原始放大倍数100倍)拍摄相同部位的图像。
1.8 统计学处理
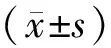
2 结 果
2.1 乳香对细胞增殖的影响
MTT法检测乳香对细胞增殖的影响,结果详见图1。乳香以剂量依赖性和时间依赖性抑制胃癌细胞SGC7901的增殖(P<0.05)。
2.2 乳香对细胞凋亡的影响
统计Q3象限(Annexin V+/PI-)的早期凋亡细胞和Q2象限(Annexin V+/PI+)的晚期凋亡细胞。分析发现,乳香能以剂量依赖性诱导胃癌细胞凋亡(图2)。
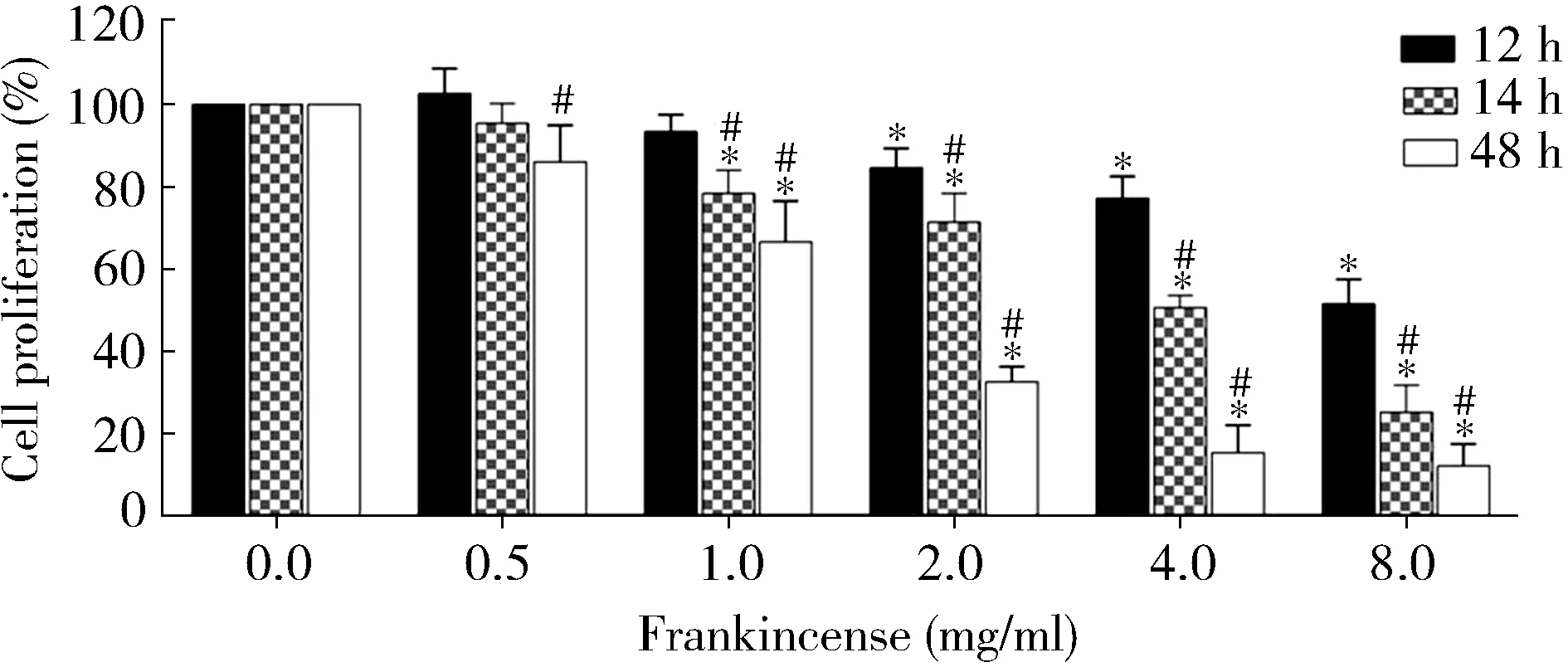
图1 乳香对SGC7901细胞增殖的影响Figure 1 Effect of frankincense on proliferation of SGC7901 cellsCompared with 0.0 mg/ml, *P <0.01; compared with 12 h, #P <0.01.
2.3 乳香对胃癌细胞中PTEN、p-Akt和COX-2蛋白表达的影响
不同浓度的乳香(0.0、2.0、4.0 mg/ml)干预细胞24 h后,PTEN表达上调,p-Akt和COX-2表达下调,且呈剂量依赖性(图3)。
2.4 乳香对细胞迁移能力的影响
乳香以剂量依赖性和时间依赖性抑制胃癌细胞SGC7901的迁移(P<0.05;图4)。

图2 乳香对SGC7901细胞凋亡的影响Figure 2 Frankincense induces apoptosis of SGC7901 cellsA:flow cytometry-based annexin V-FITC/PI labeling of apoptotic cells;B:statistical analysis. Compared with 0.0 mg/ml, *P<0.01. FITC: fluorescein isothiocyanate isomer; PI: propidium iodide.
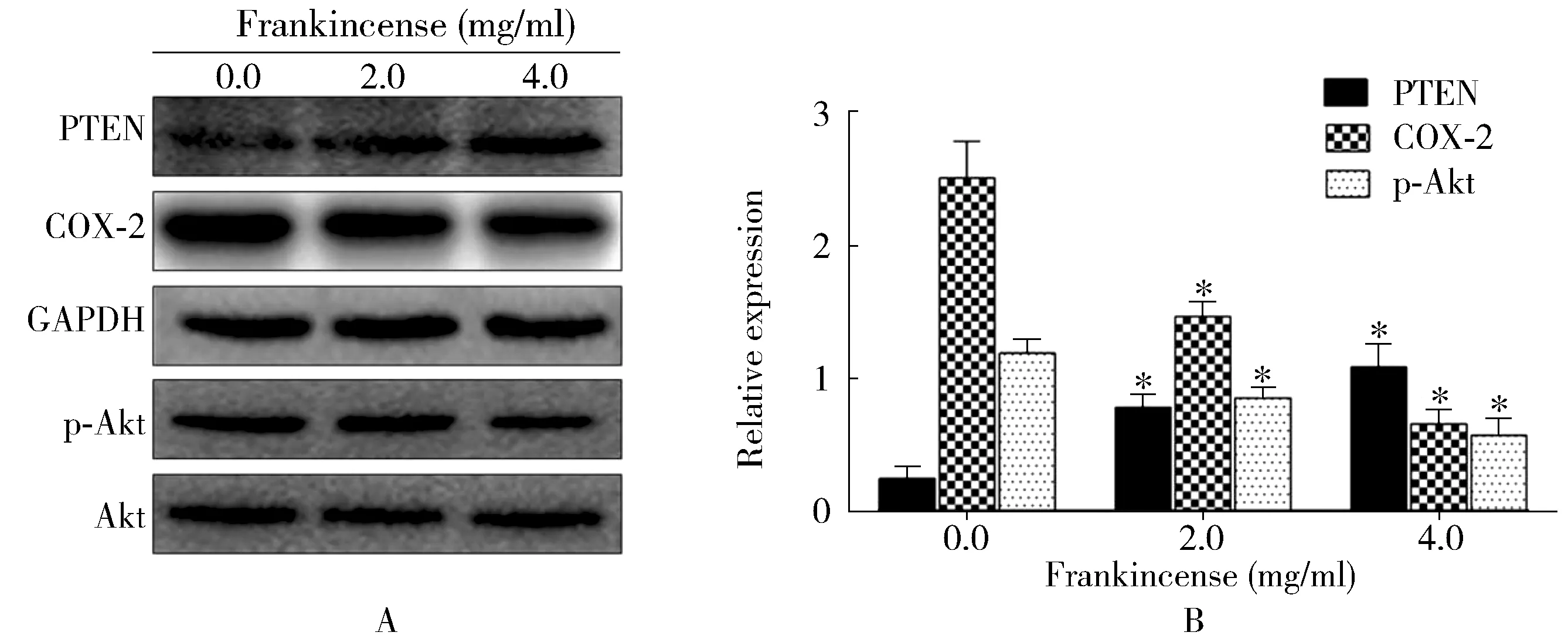
图3 乳香对胃癌SGC7901细胞中PTEN、COX-2 and p-Akt蛋白表达的影响Figure 3 Effect of frankincense on expression levels of PTEN, COX-2 and p-Akt in SGC7901 cellsA:Western blotting;B:statistical analysis.PTEN: phosphatase and tensin homolgy deleted on chromosome ten; COX-2: cyclooxygenase-2; Akt: protein kinase B; p-Akt: phosphatased Akt. Compared with 0.0 mg/ml, *P<0.01.
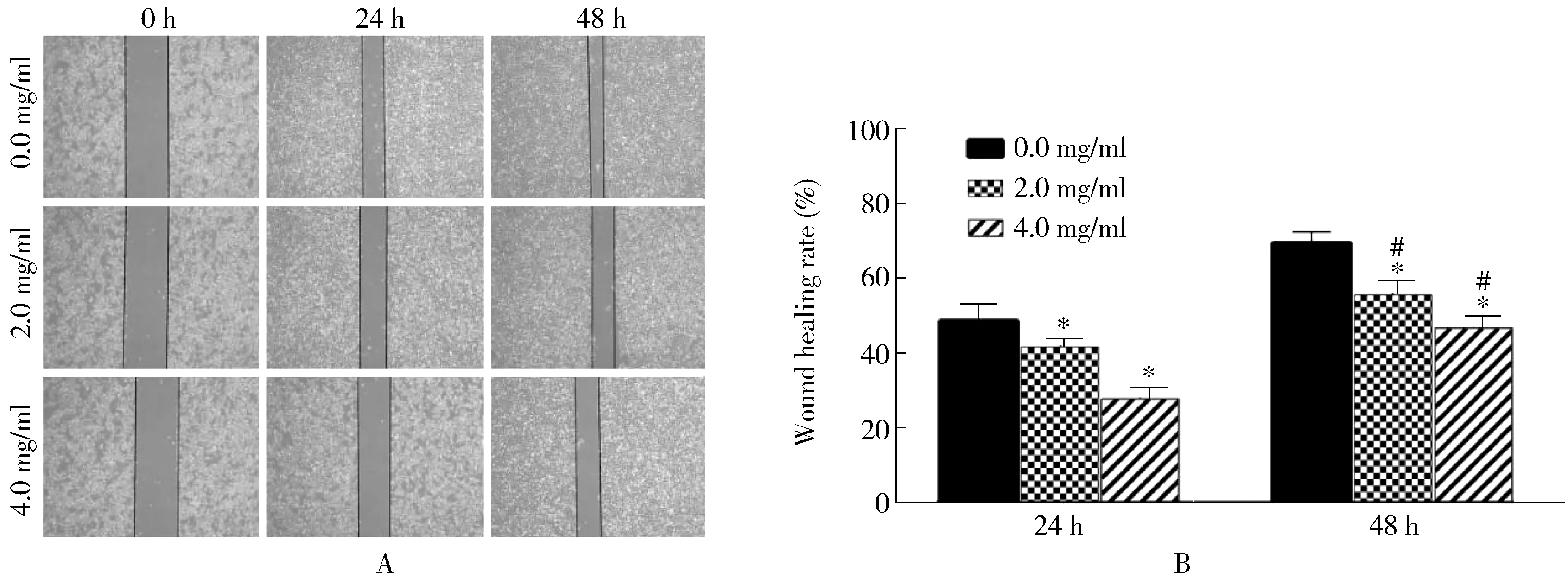
图4 乳香对SGC 7901细胞迁移的影响Figure 4 Effect of frankincense on migration of SGC7901 cellsA:phase micrographs of SGC7901 cells at various times after monolayer wounding (×100);B:quantification analysis of cell migration Compared with 0.0 mg/ml, *P <0.01; compared with 24 h, #P<0.01.
2.5 乳香对裸鼠皮下移植瘤生长的影响
实验组裸鼠的肿瘤体积明显小于对照组(P<0.05;图5A)。乳香灌胃6 d后,差异有统计学意义(P<0.05;图5B)。实验组与对照组的裸鼠体质量比较,差异无统计学意义(P>0.05;图5C)。本实验中未出现裸鼠的死亡。研究结果显示,乳香能够抑制胃癌移植瘤的生长。
3 讨 论
本研究结果发现乳香能够通过下调胃癌细胞COX-2的表达,从而诱导胃癌细胞凋亡,抑制胃癌细胞增殖,这可能与PTEN/Akt信号通路有关。COX-2是一种前列腺素过氧化物合成酶,在炎症细胞和多种肿瘤组织中呈过表达[10]。COX-2过表达与胃癌的发生发展和预后密切相关,抑制COX-2的表达能有效诱导胃癌细胞凋亡[11]。Akt通路能够调控COX-2的表达,它是重要的细胞凋亡通路,对癌症细胞的增殖和凋亡具有重要的调控作用[12,13]。PTEN可负性调节Akt通路。本研究结果发现,乳香能够通过下调人胃癌SGC7901细胞中的COX-2的表达而诱导胃癌细胞凋亡。本研究在体外检测了PTEN/Akt通路相关蛋白的表达,Western blotting结果显示乳香能上调PTEN的表达,下调p-Akt和COX-2的表达。
在体外实验中,本研究采用MTT法和细胞划痕实验分别检测了乳香对胃癌细胞株SGC7901的增殖能力和迁移能力的抑制作用。结果表明:随着给药剂量增加及药物作用时间的延长,乳香对胃癌细胞株SGC7901增殖和迁移的抑制作用逐渐增强。流式细胞术观察到乳香作用于SGC7901细胞后,细胞凋亡率均升高,且呈剂量依赖性,与MTT结果一致。既往研究已经证实,乳香能够抑制裸鼠体内乳腺癌[14]、前列腺癌[15]、肝癌[2]、恶性胶质瘤[16]等肿瘤的生长。为了检测乳香在体内的抗胃癌作用,本研究建立了人胃癌细胞SGC7901移植瘤裸鼠模型,与之前的研究[2,14-16]结果一致,本研究结果同样证明了乳香在裸鼠体内对胃癌具有抗肿瘤作用。乳香灌胃处理的裸鼠与对照裸鼠相比,肿瘤明显较小。乳香能抑制肿瘤的生长,且不会引起裸鼠体质量明显减轻、精神状态及活动度变差等。若要将研究结果推及到人体,我们仍需对乳香进行进一步的安全性分析与剂量研究。
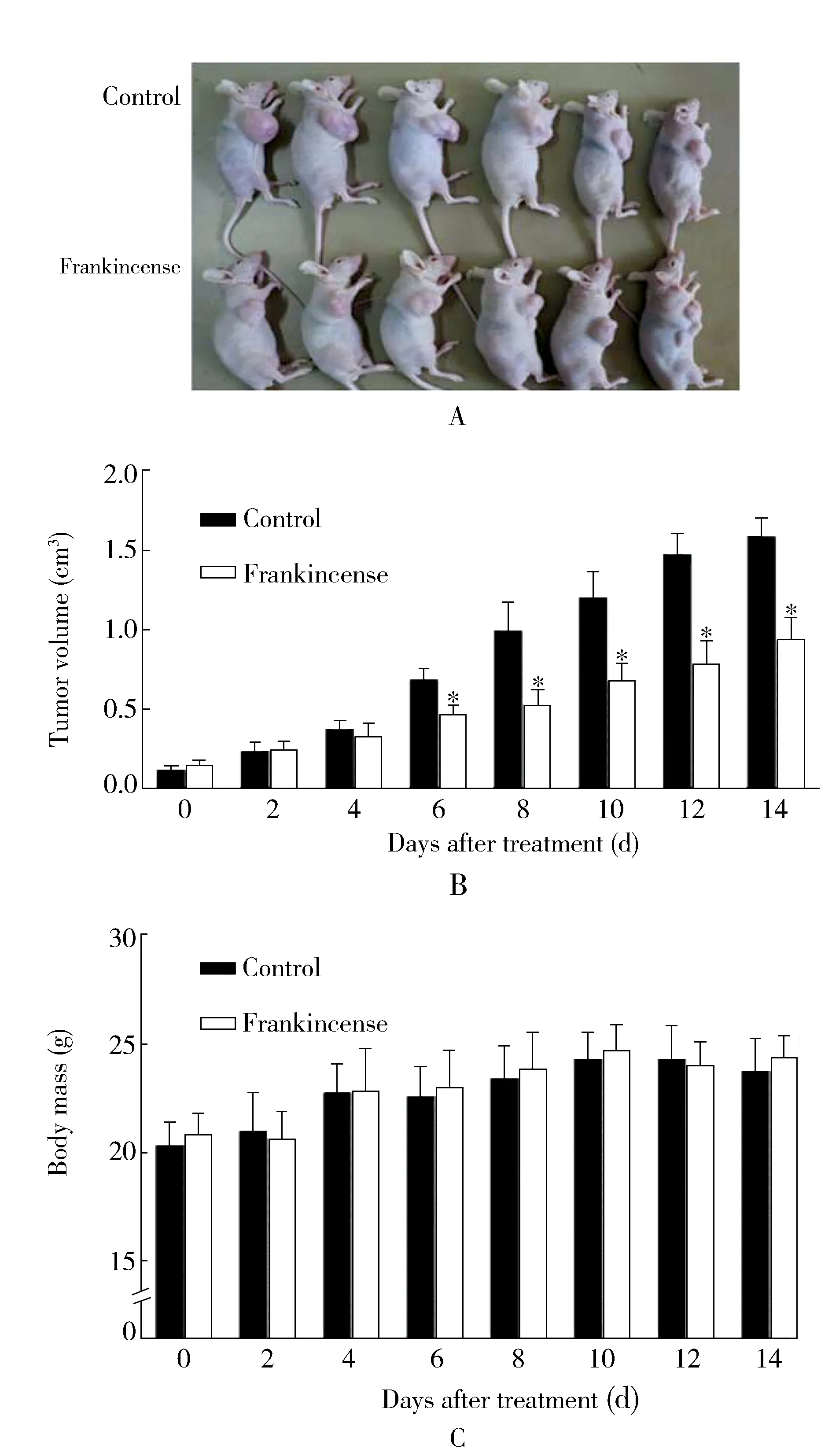
图5 乳香抑制裸鼠体内移植瘤生长Figure 5 Frankincense inhibits gastric tumor growth in vivoA:gastric cancer xenograft tumor growth in vivo;B:tumor volume change;C:body mass change. Compared with control group, *P<0.01
综上,由于细胞信号转导机制十分复杂,乳香抑制胃癌细胞COX-2表达也可能受其他通路调控,不同信号通路之间也会相互影响,要想全面了解调控COX-2表达的作用机制还需要更深入的研究。

