低剂量60CO-γ射线对斑马鱼胚胎发育及行为的影响
徐 超,李天阳,胡晨剑,郭杭钦,周依铂,邹德靓
(1.浙江工业大学 环境学院,浙江 杭州 310014;2.浙江省辐射环境监测站,浙江 杭州 310012)
近年来,核能与核技术利用的快速发展在带来益处的同时,其放射性污染也越来越受到公众的关注。2011年日本福岛核电站事故导致周边环境被大量放射性物质污染[1],并影响水生生物[2]。而在天然环境中,铀矿区周围的放射性水平基本处于较高的水平,范围为76~214 nGy/h[3],而全球的年均值为59 nGy/h[4]。目前,针对高剂量γ射线辐照的生物学效应已有大量研究报道[5-6],而针对低剂量电离辐射的生物效应研究是有限的[7]。Garnier-Laplace把0.01 mGy/h(0.24 mGy/d)作为风险评估筛选值,低于该值时,确信暴露不会导致不良影响[8]。γ射线是原子核裂变时释放出的射线,穿透力强,容易对水生生物造成损伤。有研究表明:γ辐射会对水生生物有遗传毒性和生殖影响[9],并且会引起DNA的损伤[10]。比如,γ射线诱导斑马鱼和大西洋鲑鱼组蛋白修饰富集位点的基因特异性变化[11],诱导斑马鱼胚胎发育毒性及细胞凋亡[12],对胚胎的孵化率和孵化时间也有一定影响[13]。
斑马鱼作为模式生物,具有饲养容易,胚胎透明,胚胎内器官和结构的变化在显微镜下易观察[14],基因与人类高度相似[15]的优点,并能提供多个毒理学终点以供参考。斑马鱼行为学是一种比较简单有效的分析神经整合功能的方法,并已形成了许多相关的实验模型[16]。斑马鱼不仅被广泛应用于环境化学物的危害识别[17]和风险评估[18-19],在电离辐射评价领域也有应用[18]。笔者拟采用斑马鱼作为研究对象,以胚胎的存活率、孵化率、畸形率和斑马鱼行为能力为毒理学终点,研究低剂量γ射线辐照对斑马鱼胚胎的发育和行为毒性效应,为低剂量γ射线辐照对水生生物的安全性评价提供基础数据。
1 材料与方法
1.1 仪 器
ZebraLab行为测试系统(ViewPoint Life Science,法国),荧光倒置显微镜,其他仪器均为实验室常规仪器。
1.2 斑马鱼饲养和胚胎收集
成年斑马鱼购于中国科学院水生生物研究所。斑马鱼在温度为28 ℃,光照周期为 14 h光照/10 h黑暗的水循环系统中饲养,并驯化一段时间。斑马鱼的养殖水曝气24 h以上,并经紫外光杀菌和活性炭过滤(pH值7.2~7.6)。每天喂食两次丰年虫,早晚各一次。选择健康和性成熟的斑马鱼进行产卵,雌雄数量比例1∶2,将鱼放入上部装有渔网的鱼缸中,使鱼限制在上半部活动,避免吸食鱼卵。鱼缸上方装有定时灯,设定时间,次日清晨8点自动打开,斑马鱼受光照刺激产卵。产卵后使用虹吸管吸出鱼卵。去除粪便和死卵等杂质后加入适宜浓度的亚甲基蓝消毒,最后将胚胎放置在28 ℃的水浴锅中。
1.3 胚胎辐射
收集斑马鱼胚胎后,设置1 个对照组,4 个辐照组,以两个6 孔板为容器,每个孔中加入10 mL水溶液并随机分配15 颗斑马鱼胚胎。采用270 KBqCo-60标准放射源照射(不考虑水溶液对辐照剂量的吸收),连续照射5 d(24 h不间断),5 d后撤去放射源。对照组不作辐照处理。辐照组累积辐射剂量分别为1,2,2.5,15 mGy,每个辐照剂量重复3 个平行。每24 h更换一半水溶液,并定时检查,及时挑除死卵。
1.4 斑马鱼幼鱼发育毒性的测定
于12,24,48,72,96 h用荧光倒置显微镜(Ti-S,日本尼康公司)对胚胎进行形态学观察,记录死亡率、孵化率和畸形率(包括心胞囊肿、卵黄囊肿、脊柱弯曲),并及时挑出死卵。
1.5 斑马鱼幼鱼行为分析的测定
选取辐照120 hpf(受精后120 h)后的受精胚胎,从每个辐照组中挑选出10 条成活的幼鱼,放入96 孔板中(孔板外围一圈不放鱼),每个辐照组重复3 个平行。每个孔中加入100 μL的去离子水,在28 ℃的环境中适应30 min后放入ZebraLab行为测试系统(ViewPoint Life Science,法国)检测斑马鱼运动活力。设置光照周期为10 min光照/10 min黑暗,经20 min光照条件的适应之后,开启行为分析系统检测,并记录50 min内幼鱼的运动活力随光暗周期改变的变化规律。
1.6 数据分析
使用Origin 9.1软件对数据进行作图,所有结果以平均值±标准偏差的形式表示。使用SPSS 19.0统计软件对实验数据进行统计分析,采用单因素方差分析对处理组和对照之间的差异显著性进行检验。其中:*表示P<0.05为显著性差异;**表示P<0.01为差异极显著。
2 实验结果与讨论
2.1 幼鱼发育毒性
斑马鱼胚胎经低剂量γ射线辐照后,出现的畸形现象包括卵黄囊水肿(YSE)、心胞囊水肿(PE)和脊柱弯曲(CB),如图1所示。
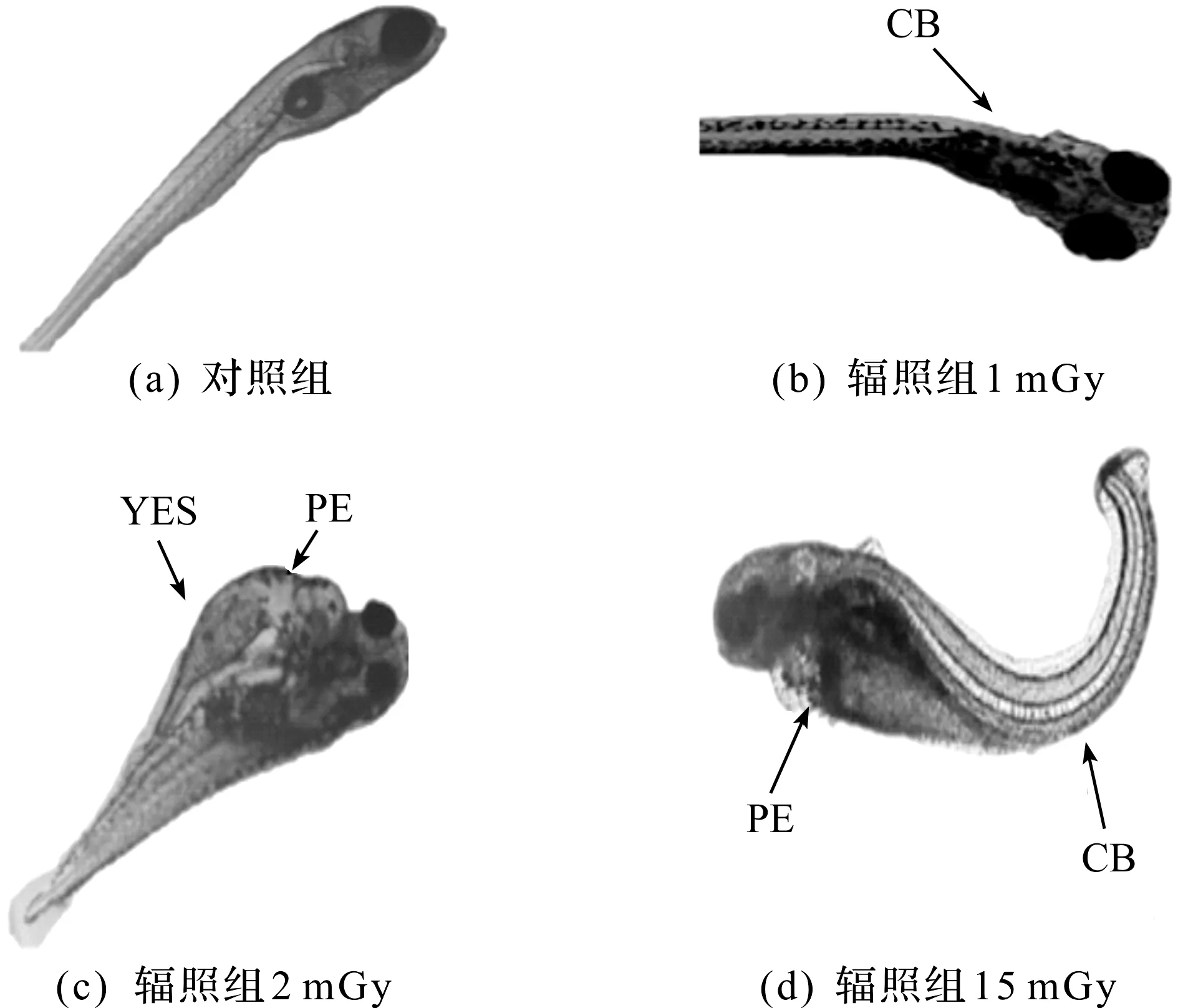
CB—身体弯曲;YES—卵黄囊水肿;PE—心包囊水肿。
不同累计剂量γ射线辐照对斑马鱼幼鱼死亡率(48 h)、孵化率(72 h)和畸形率(96 h)的结果统计于图2。由图2(a)可知:随着辐照剂量的增加,辐照组死亡率呈现出先下降后上升的趋势,但均无显著性差异,P>0.05。与对照组死亡率20%相比,在累积辐照剂量为2 mGy时,死亡率为3.3%,达到最低。由图2(b)可知:孵化率与死亡率正好相反,随着辐照剂量的增加,辐照组孵化率呈现出先上升后下降的趋势,但均无显著性差异,P>0.05。与对照组孵化率80%相比,在累积辐照剂量为2 mGy时,孵化率为96.7%,达到最高。由图2(c)可知:与对照组畸形率2.5%相比,辐射组1,2,2.5,15 mGy的畸形率分别为10.0%,10.0%,25.0%,31.4%。其中,累积辐照剂量为2.5 mGy时,辐照组畸形率有显著性差异,为25.0%,P<0.01。累积辐照剂量为15 mGy时,辐照组畸形率有显著性差异,为31.4%,P<0.01。其他辐照组畸形率无显著性差异。
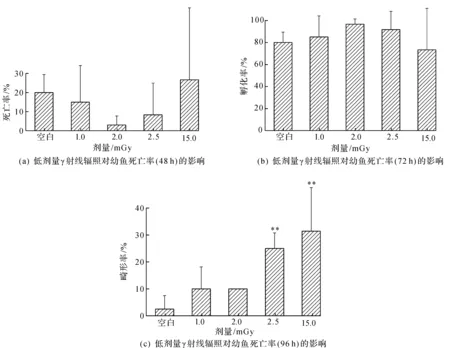
图2 低剂量γ射线后对幼鱼死亡率的影响
虽然斑马鱼胚胎具有孵化率先上升后下降的趋势和死亡率先下降后上升的趋势,但没有显著性差异,赵维超等[19]用0.01 Gy的γ射线对斑马鱼胚胎辐照后,存活率和孵化率无显著影响。Selma等[20]发现在低剂量辐照下,孵化率和存活率无显著性影响,在高剂量辐照下,孵化率和存活率显著下降。由此可见,低剂量辐照对斑马鱼胚胎的死亡率和孵化率无显著影响。
相比存活率和孵化率,60Co低剂量γ射线辐照对斑马鱼胚胎畸形率的毒性效应更为显著。宋经娥[21]用4 Gy的X射线对斑马鱼胚胎辐照后,畸形率显著增加。赵维超等[19]用0.01 Gyγ射线对斑马鱼胚胎辐照后,畸形率显著提高。有研究发现:低剂量的γ射线照射可分别通过Hh和PI3K/Akt信号通路诱导斑马鱼胚胎的发育毒性[11]。Kumar等[22]认为DNA损伤与胚胎发育异常之间存在剂量效应关系,DNA单链断裂对斑马鱼胚胎的物理畸形起到诱导作用,并且导致发育基因sox2的下调,这可能共同导致研究中观察到的所有发育缺陷。
2.2 幼鱼行为分析
斑马鱼幼鱼经不同低辐射剂量辐照后,在光/暗周期刺激下产生了不同的周期性运动变化。图3为光照/黑暗周期变化下,低剂量γ射线对斑马鱼幼鱼(120 h)运动活力的影响,横坐标轴上的黑白棒分别代表黑暗与光照。
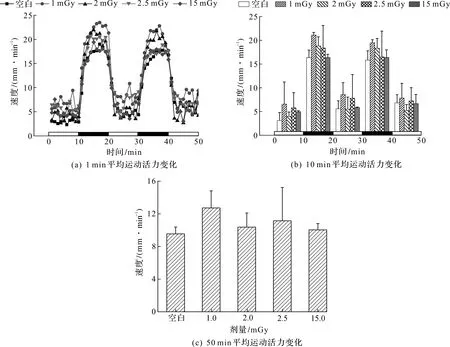
图3 低剂量γ射线对斑马鱼幼鱼(120 h)运动活力的影响
由图3(a)可知:不同辐射剂量组的斑马鱼幼鱼在光照/黑暗周期环境下的运动游速均表现出黑暗上升光照下降的趋势,各辐照组之间运动轨迹相同。与对照组相比,辐射组1,2,2.5,15 mGy每分钟斑马鱼幼鱼的运动速度在黑暗条件下均高于对照组,但随着辐照剂量的增加呈现下降的趋势。图3(b)显示幼鱼在不同低剂量辐照下10 min平均游动速度在光暗周期下的变化,也呈现出与图3(a)相似的趋势,即相比对照组,辐射组1,2,2.5,15 mGy每10 min斑马鱼幼鱼的运动速度在黑暗条件下均高于对照组,但随着辐照剂量的增加呈现下降的趋势。由图3(c)可知:先经过20 min光照适应,50 min检测时间内,10 min光照/10 min黑暗的光照周期下,在不同低辐射剂量辐照下,幼鱼的运动速度在低剂量辐照处理下呈现不同程度的增加。辐射组斑马鱼幼鱼的平均自由运动速度都高于对照组。与对照组幼鱼(9.54±0.8)mm/min相比,1,2,2.5,15 mGy下斑马鱼每分钟的平均游速为(12.7±2.1),(10.3±1.7),(11.1±4.1),(10.0±0.8)mm/min,而辐射剂量为1 mGy时游速最高,达到(12.7±2.1)mm/min。有研究发现:低剂量γ辐射辐照造成斑马鱼幼鱼体内AChE活性降低,并且对幼鱼的肌肉造成影响。这些结果表明:γ辐射可以诱导幼鱼神经传递的损害,这可能会对运动产生影响[23]。本研究实验结果表明:1,2,2.5,15 mGy辐照均刺激了斑马鱼幼鱼运动,这可能是由于低剂量辐射兴奋效应所引起的,适宜的低水平辐射对生物存在有益作用,在邓晔坤[24]的研究中也发现了低剂量辐射兴奋效应。
3 结 论
低剂量γ射线辐照对斑马鱼胚胎有显著的致畸效应。相比对照组,2.5 mGy和15 mGy辐照对斑马鱼胚胎的畸形率有显著影响,但对死亡率和孵化率无显著影响。此外,1,2,2.5,15 mGy辐照均能刺激斑马鱼幼鱼运动,斑马鱼幼鱼在黑暗条件下的运动速度均高于对照组,但随着辐照剂量的增加而减少。

