阿尔兹海默病发病危险因素概况
杨晓敏,鲍天昊,阮 冶
(昆明医科大学附属精神卫生中心,云南省精神病医院,云南 昆明 650224*通信作者:阮 冶,E-mail:ruanye2006@163.com)
阿尔兹海默病(Alzheimer’s Disease,AD)是一种慢性神经退行性疾病,其临床表现以渐进性记忆减退、认知功能障碍以及其他神经精神症状和行为障碍为特征,起病隐匿,进行性发展,严重影响老年人的身心健康和生活质量,也给社会带来沉重的医疗和经济负担,且目前缺乏针对阿尔兹海默病的有效疗法。截止2016年,全球痴呆总人数约为4 380万,已成为全球第五大死亡原因[1],阿尔兹海默病是老年痴呆病例中的最常见类型。Norton等[2]研究表明,约有1/3的阿尔兹海默病发病归因于可控的危险因素,通过不可控因素确定危险人群,对其可控因素部分进行早期干预,可作为阿尔兹海默病预防的主要思路。因此,明确危险因素的范畴,全面了解危险因素的宏观现状及可能的发病机制,能为识别危险人群、进行干预研究及临床试验提供参考,也对预防宣教工作有重要的指导意义。
1 资料与方法
1.1 资料来源与检索策略
对PubMed、Web of Science、中国知网、万方医学数据库进行检索,检索时间设置为建库至2020年7月。检索关键词为阿尔兹海默病(Alzheimer’s disease)、危险因素(risk factors)、一级预防(primary prevention)、二级预防(secondary prevention)。英文检索式:(Alzheimer disease or Alzheimer’s disease)and(risk factors),(Alzheimer disease or Alzheimer’s disease)and(prevention and control),(Alzheimer disease or Alzheimer’s disease)and(early intervention),中文检索式:阿尔兹海默病and危险因素,阿尔兹海默病and预防与控制,阿尔兹海默病and早期干预。
1.2 文献纳入与排除标准
纳入标准:①研究对象符合《精神障碍诊断与统计手册(第5版)》(Diagnostic and Statistical Manual of Mental Disorders,fifth edition,DSM-5)阿尔兹海默病诊断标准;②关于阿尔兹海默病发病机制及危险因素的原始研究和综述。排除标准:①重复的文献;②研究内容为其他类型痴呆的文献;③非中英文文献;④研究内容和主题与参考文献相似,且绝大部分被参考文献覆盖。
1.3 文献筛选与质量评价
由两名研究者进行文献筛选,严格按照文献纳入和排除标准筛选符合要求的文献全文,由于研究领域广泛,研究对象和实验方法同质性差,不适合进行Meta分析,故进行定性分析,最终纳入42篇文献。
2 结 果
2.1 纳入文献基本情况
初步检索共获取文献7 037篇,其中文献发布时间为1986年-2020年,通过对标题、摘要及全文进行阅读,最终符合纳入标准且不符合排除标准的文献共42篇。文献检索流程见图1。
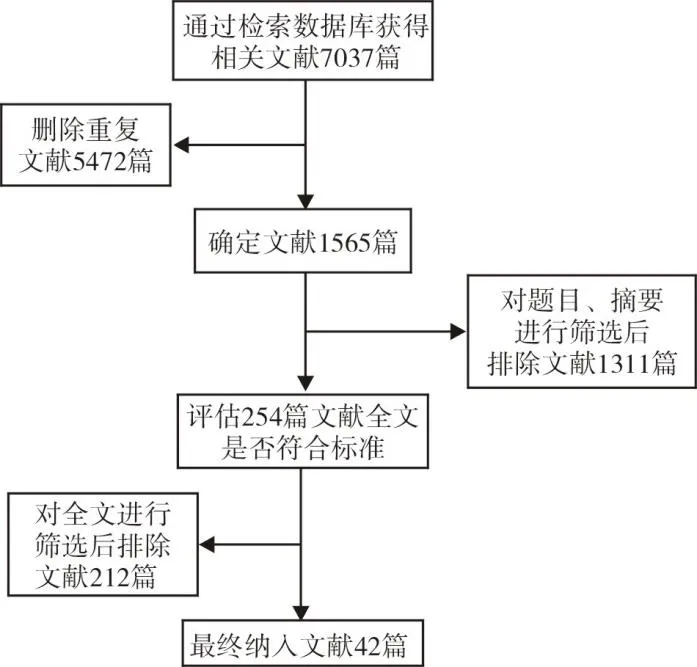
图1 文献检索流程
2.2 可能的发病机制概况与发展
过去关于阿尔兹海默病发病机制上长期占据主导地位的是淀粉样蛋白级联学说,即β-淀粉样蛋白(Amyloid beta,Aβ)是阿尔兹海默病病理通路的初始事件,Aβ的产生和清除失衡,Aβ沉积及毒性作用引起后续的老年斑块(Senile plaques,SP)、神经纤维缠结(Neurofibrillary tangles,NFT)的形成,进而导致突触和神经元损伤或死亡、神经炎性突触功能失调、神经递质缺失,逐渐导致发病[3]。但这一假说不能解释以下问题:①Aβ沉积、老年斑块及神经纤维缠结形成等改变也可见于认知正常的老年人;②以清除Aβ为目标的药物临床试验都相继失败[4]。近年来,阿尔兹海默病的病理学机制相继出现一些补充和发展的观点,如:基因和环境因素导致大脑免疫炎症系统失调,其中早期神经元损伤后神经胶质细胞激活,导致炎症因子、氧化应激和一氧化氮介导的细胞毒性,而神经元损伤再次激活神经胶质细胞,形成恶性循环[5-6];线粒体功能紊乱相关的线粒体级联学说,线粒体功能障碍存在独立于Aβ,可能早于Aβ沉积的发生,并介导、驱动或促成多种阿尔兹海默病病理学改变[7]。
2.3 影响阿尔兹海默病发病的不可控危险因素
2.3.1 可能的致病基因
早发性阿尔兹海默病(Early Onset Alzheimer Disease,EO-AD)约占所有阿尔兹海默病患者的10%,目前已明确三种主要的早发型家族性常染色体基因:淀粉样前体蛋白基因(Amyloid Precusor Protein,APP)、早老素 1基因(Presenolin-1 Gene,PS1)和早老素2基因(Presenolin-2 Gene,PS2),它们致病机理支持向淀粉样蛋白级联学说,APP基因不利突变后表达的APP蛋白更容易被β分泌酶识别,而PS1和PS2基因编码γ分泌酶的活性成分,因此APP基因不利突变及PS1、PS2基因突变都将导致更多的致病性Aβ42产生[8]。迟发性阿尔兹海默病(Late Onset Alzheimer Disease,LO-AD)占全部阿尔兹海默病的大多数,遗传因素在其病理生理机制中也扮演着重要角色,载脂蛋白Eε4亚型(ApolipoproteinEε4,ApoEε4)等位基因是 LO-AD最重要的遗传危险因素,拥有一个ApoEε4等位基因将使发病风险提高3倍,纯合子则将增加12倍的发病风险,而拥有载脂蛋白Eε2亚型等位基因(ApolipoproteinEε2,ApoEε2)将会降低阿尔兹海默病的发病风险[9]。随着全基因组关联分析(Genome-Wide Association Studies,GWAS)等技术的发展,陆续发现了一系列基因的单核苷酸多态性与LO-AD发病相关,包括丛集素基因(clusterin,CLU)、补体受体1基因(complement C3b/C4b Receptor 1,CR1)、磷脂酰肌醇结合网格蛋白组装蛋白基因(phosphatidylinositolbindingclathrin assemblyprotein,PICALM)、桥联整合蛋白1基因(bridging integrator 1,BIN1)、CD2 相关蛋白基因(CD2 associated protein,CD2AP)、跨膜4结构域亚家族A成员4A/6A/4E基因(membrane spanning 4-domains A4E,MS4A4E/membrane spanning 4-domains A6A,MS4A6A)、产促红细胞生成素的肝细胞受体A1基因(EPH receptor A1,EPHA1),以及三磷酸腺苷结合盒亚家族A成员7基因(ATP binding cassette subfamily A member 7,ABCA7)、CD33基因(CD33 molecule,CD33)等。这些基因的表达多涉及APP内吞、脂质代谢、Aβ清除、免疫炎症系统激活等过程,不利突变可能会增加阿尔兹海默病的发病风险[8-9]。
2.3.2 性别和年龄因素
性别与阿尔兹海默病患病率的关系尚不明确,但流行病学研究表明:有2/3的阿尔兹海默病患者为女性[10]。可能的原因是女性有更多的阿尔兹海默病病理学改变,尤其是tau蛋白缠结,也存在更多的小动脉硬化[11],但也有研究指出临床上男性患者数量较少可能是因为男性患者的临床表现不典型所致的漏诊[12]。年龄是阿尔兹海默病发病最重要的影响因素,从流行病学特征上看,在50~80岁人群中,年龄每增加5岁,患病率则增加一倍[1]。早期阿尔兹海默病患者和正常老化者的SP数量相似,只是密度不同,这提示高龄会使得阿尔兹海默病相关病理改变增加,并且随着年龄增长,鞘磷脂分解、脑干核团细胞丢失、血脑屏障损伤都会增加[13]。
2.4 影响阿尔兹海默病发病的可控因素
Norton等[2]研究表明,美国及欧洲范围内有7个潜在的阿尔兹海默病发病的可控风险因素:糖尿病、中年期高血压病史、中年期肥胖病史、缺乏运动锻炼、抑郁、吸烟、低教育水平,若采用合适的预防方式,每年的发病率降低10%。Yu等[14]的Meta分析提示,除上述因素外,还存在认知活动、晚年高体重指数、高同型半胱氨酸血症、脑创伤史、长期压力、直立性低血压等较为重要的危险因素,吸烟、睡眠、心脑血管疾病等是与阿尔兹海默病发病关系稍弱的可控危险因素[14]。
2.4.1 脑血管疾病及相关因素
Arvanitakis等[15]横断面研究提示,脑动脉粥样硬化和小血管硬化严重程度与阿尔兹海默病患病和认知功能损害的几率呈正相关[15]。大多数阿尔兹海默病患者存在淀粉样血管病及小动脉硬化性疾病伴随着出血、梗死的情况[16]。脑血管病导致阿尔兹海默病发病的机制可能是由于脑血管病所致的脑血流减少和血脑屏障损伤,而后神经元细胞缺氧、神经毒素累积等造成神经元损伤;同时,由于脑血管疾病导致APP基因表达增多和血脑屏障清除作用减弱,最终导致Aβ累积[17]。
高血压、糖尿病、肥胖、高脂血症、吸烟、冠心病、脑血管疾病、缺乏运动等是阿尔兹海默病发病的危险因素,且这些危险因素之间的相互作用对阿尔兹海默病进展具有累加效应,尤其是在APOEε4携带者中[18]。高血压和高胆固醇血症都不仅涉及脑血管疾病的促成,还与Aβ形成、血脑屏障损伤有关[19]。糖尿病患者可能因为体内胰岛素抵抗、胰岛素缺乏、晚期糖基终产物的副作用等机制直接引发阿尔兹海默病相关病理路径。同时,糖尿病和肥胖相关的外周神经炎症也可发生在大脑,从而引起认知功能下降和阿尔兹海默病发生[20]。也有研究提出,肥胖和体重的作用受年龄的影响,老年人群的高体重指数可能是保护因素[21],这可能与低体重老年患者常存在消瘦、恶病质、尿路感染、肺部感染、叶酸及各种脂溶性维生素的缺乏等躯体情况有关,这些状态易导致Aβ沉积、TNF形成[13]。
2.4.2 生活方式
随着人们对阿尔兹海默病预防重视程度的增加,逐渐出现了一些探索预防阿尔兹海默病的大型干预性临床试验,这些试验采用的干预方式都是以养成健康生活习惯为主的多种因素联合干预,涉及脑血管疾病的管理、饮食、运动、认知训练等方面[22],且取得了较好的效果,这表明生活方式相关的危险因素对于阿尔兹海默病预防决策的重要性及有效性。
2.4.2.1 饮食习惯
近年来,以高水平摄取蔬菜、豆类、水果、鱼类、坚果、谷物和不饱和脂肪酸、低饱和脂肪和肉类、低中度奶制品、规律的中度饮葡萄酒为特征的地中海饮食(Mediterranean diet,MEDi)以及相关的阻止高血压饮食法(Dietary Approaches to Stop Hypertension,MEDi-DASH)、神经退行性延迟饮食(Mediterranean-DASHInterventionforNeurodegenerativeDelay,MIND)等饮食方法引起了研究人员的注意,其抗炎、抗氧化特性(富含维生素E、维生素C、维生素B6、维生素12、DHA、类胡萝卜素、类黄酮和其它多酚等)有助于减少大脑内的炎症、氧化应激反应,减少神经元损伤,保持白质微观结构的连接性[23-24],防止认知功能减退。Pelletier等[25]研究表明,长期遵循地中海饮食这一饮食结构的人群大脑内有着更高水平的脑血流灌注和更低水平的Aβ,且在2年的随访时间内脑血流灌注下降及Aβ上升速度均更慢。
2.4.2.2 运动锻炼因素
相关Meta分析提示,长期高强度阻抗或基本有氧训练可预防认知功能下降和老年痴呆症,也能改善阿尔兹海默病患者的认知功能,可能是由于长期运动锻炼促进脑血流灌注及脑源性神经营养因子分泌的直接作用,以及改善高血压、糖尿病、肥胖等因素、提升身体整体健康水平的间接作用[26]。
2.4.2.3 睡眠紊乱因素
随着年龄增长,睡眠时长和质量都会下降[27],Shokri-Kojori等[28]研究表明,一夜未眠后可检测到海马、丘脑等区域明显增多的Aβ,而长期睡眠时间不足和睡眠质量下降者也会出现脑内Aβ增加。可能是因为睡眠紊乱导致脑皮质活动增加、Aβ合成增加,以及在深睡眠期间负责清除Aβ的脑部类淋巴系统无法进行有效工作,还有可能是因为睡眠障碍会损害细胞的内质网应激反应,导致Aβ折叠加工错误,以上改变都可能导致Aβ沉积[28-29]。此外,在睡眠紊乱的人群中,额叶、颞叶、岛叶、顶叶灰质的萎缩都有报道[30-31],提示睡眠紊乱与阿尔兹海默病发病具有相关性。
2.4.2.4 烟酒习惯
目前普遍认为吸烟是阿尔兹海默病发病的危险因素,吸烟对认知功能的影响可能与尼古丁的神经毒性作用以及吸烟对众多慢性病的促成有关[32]。Zhou等[33]研究显示,吸烟会增加老年男性患阿尔兹海默病的风险,在联合饮酒习惯时风险更高。饮酒史是独立于阿尔兹海默病的认知下降的危险因素,而与阿尔兹海默病的关系尚不明确[34]。
2.4.3 影响阿尔兹海默病发病的环境因素
2.4.3.1 环境中的金属元素
长期以来,铝、铅、铁、铜、锌等金属元素在体内的失衡作为阿尔兹海默病的潜在危险因素被广泛讨论,随年龄增长所致的体内必需微量元素稳态失衡,同时暴露于饮食和环境中的其他金属元素,最终引发阿尔兹海默病病理路径。Wang等[35]的Meta分析提示,阿尔兹海默病发病风险与血清铜水平呈正相关,而与血清锌、铁水平呈负相关,Richard[13]则强调相关金属元素的多样性及不同金属元素间的相互作用。
2.4.3.2 大脑高级功能相关的社会环境因素
低教育水平是阿尔兹海默病的重要危险因素,而高教育水平、脑力工作性质以及长期积极广泛的社交关系等认知刺激活动能提高大脑“认知储备”,这与“脑储备”所指的大脑本身结构和神经元数目差异不同,更高的“认知储备”使得个体在相同神经元数目的情况下能更好地感知和应对各种认知相关任务,对大脑衰老具有更高的“耐受性”,老年期表现出对周围事物更强的兴趣、更高的感知和思维活动程度,形成的信息刺激是维持大脑神经细胞正常功能、延缓大脑衰老极其重要的因素。最新观点指出,女性在老年阶段的这一“耐受性”低于男性[36]。
2.4.3.3 精神压力相关因素及抑郁症的影响
社会负性事件、长期精神压力、晚年抑郁症病史都可能是阿尔兹海默病的危险因素,可能的原因是以上因素导致下丘脑-垂体-肾上腺轴的失调,糖皮质激素释放增加,且此时负反馈轴无法有效抑制皮质醇水平,过量的皮质醇通过皮质醇受体作用于神经元锥体细胞及海马齿状回的颗粒细胞,引起神经退行性病变,这些脑区都是阿尔兹海默病的脑组织病理学改变较为特异的区域[37-38]。长期压力也可导致APP合成增多、tau蛋白磷酸化的情况[38]。以上机制都可能参与了阿尔兹海默病的发病。
2.5 其他与阿尔兹海默病发病相关的病史或指标
脑创伤病史是阿尔兹海默病的危险因素,这可能与头部创伤后短时间内APOEε4等位基因的阿尔兹海默病病理学改变、血脑屏障的损伤、免疫系统对暴露的脑部自身抗原的激活等有关[13,39]。Liu等[40]横断面研究显示,与轻度认知障碍患者和健康人群相比,阿尔兹海默病患者的粪便微生物多样性降低,且患者在细菌类群中,厚壁菌门的比例降低(P=0.008),而变形菌(P=0.024)高度富集,从健康对照组到轻度认知障碍患者再到阿尔兹海默病患者,认知下降与降低的微生物组的多样性之间存在相关性。提示肠道菌群紊乱可能是阿尔兹海默病的危险因素,可能的机制是肠道生态失调所致的氧化应激可能会导致铁的调节失衡,这刺激了需铁微生物生长,并导致脂多糖的产生,脂多糖引发炎症,导致海马神经退行性改变[5]。甲状腺激素水平与阿尔兹海默病及认知下降的关系还存在争议,这可能与年龄及脑血管事件等中间因素有关[41],也有相关研究显示,超敏-C反应蛋白、同型半胱氨酸、血糖、低密度脂蛋白等炎性和代谢指标的异常与阿尔兹海默病早期认知功能障碍相关[42]。
3 小结与展望
阿尔兹海默病的危险因素涉及生物学、社会学等范畴,各种因素相互影响,共同决定发病风险,这些危险因素的发病机制多与β-淀粉样蛋白在脑内的沉积、免疫炎症的慢性激活,以及由此相关的神经元损伤、神经退行性病变等过程有关。有效预防是应对当前阿尔兹海默病挑战的重要任务,目前针对脑血管疾病相关危险因素、饮食、生活习惯等可控因素的多因素联合干预方式对阿尔茨海默病的保护作用得到了一定的临床试验认可,且这些干预方式易接受。但优化预防决策、有效药物研发等需要对危险因素之间相互影响关系、作用机制及程度、早期筛查方法等方面有全面清晰的认识,也需要不断发掘新的危险因素,这都是研究需要努力的方向。

