利用传感器探究压强对氨与氯化氢反应速率的影响
肖中荣 周萍




摘要: 选择氨气和氯化氢反应为体系,向50mL氨(气)分别注入30mL、 50mL的HCl气体,用温度传感器和压强传感器绘制压强-时间(P-t)曲线、温度-时间(T-t)曲线,记录反应速率的变化;向体积相同的氨(气)中充入氯化氢气体越多,P-t、 T-t曲线越陡,曲线最高点的ΔP/Δt与ΔT/Δt量值越大,呈现压强越大反应速率越大的现象。
关键词: 反应速率; 压强影响; 传感器实验; 实验探究
文章编号: 1005-6629(2021)10-0075-03
中图分类号: G633.8
文獻标识码: B
影响化学反应速率的外界因素有浓度、压强、温度和催化剂等。人教版化学选择性必修1《化学反应原理》第二章第一节“化学反应速率”安排了浓度、温度、催化剂影响反应速率的演示实验,没有安排压强影响反应速率的实验,但在章节“整理与提升”栏目却要求学生填写压强对反应速率的影响[1]。苏教版《化学反应原理》也没有安排演示实验,只是进行了理论描述: 密闭恒温容器中对于气体参加的反应,增大压强相当于增大反应物浓度,使反应速率增大[2]。由于学生缺乏通过实验现象直观理解压强对速率的影响,故弱化了教学效果。
1 有关的文献评述
中国知网收录了一篇压强影响速率的实验演示文献[3]: 用点燃的细香插入预先收集有一定浓度氧气的密闭容器,注射器注入蒸馏水以减少容器容积、增大氧气浓度,观察细香由暗变亮的燃烧现象,说明增大压强反应速率增大。实验原理虽简单,但操作难度较大(氧气浓度一般控制在47%左右才能观察到明显现象),实验成功率较低,不适合作为课堂教学的演示实验。
2 利用传感器探究压强对氨与氯化氢反应速率的影响
氨气和氯化氢生成氯化铵的知识在人教版必修2教材[4]已出现,本文利用此知识点作为反应原理探究压强对反应速率的影响,可以充分发挥已学知识的价值,减轻学生的认知负荷。实验通过压强和温度传感器精确捕捉反应过程中压强和温度的变化,基于“宏观—微观—曲线”三重表征的比较、分析不同压强下的反应速率的大小,呈现压强对反应速率的影响,培养学生科学探究、证据推理的素养。
2.1 实验原理
HCl(g)+NH3(g)NH4Cl(s), ΔH<0 ΔS<0,反应速率较快,反应过程体系压强、温度均会发生变化,可用压强和温度随时间的变化描述反应速率;改变反应物的体积可以探讨压强对化学反应速率的影响。
2.2 实验仪器和装置
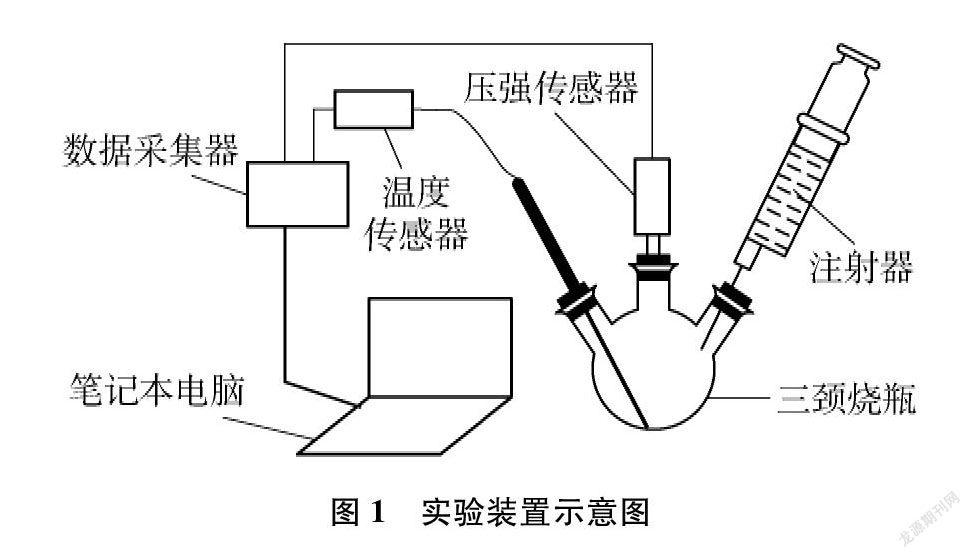
100mL、 50mL三颈烧瓶若干支,100mL、 50mL、 30mL玻璃针筒若干支,19#、 14#橡皮塞,温度传感器(LW-T801,量程-20~+130℃),压强传感器(LW-T722,量程0~700kPa),数据采集器,DISLab8.0软件,制备收集NH3、 HCl气体的装置。主要实验装置如图1所示。
2.3 实验药品
浓盐酸,浓硫酸,氢氧化钠固体,浓氨水,碱石灰等
2.4 实验操作
如图1所示,在三颈烧瓶中间管口插入压强传感器,左侧管口插入温度传感器。
收集一定量干燥的NH3(体积记为V1)于三颈烧瓶中,右侧管口用橡皮塞密封,固定到铁架台上。开启电脑并将传感器通过数据采集器与电脑相连,打开DISLab8.0软件,选择“通用软件”点击开始,软件程序自动识别出温度传感器和压强传感器。设置采集图线左边Y轴为压强坐标,右边Y轴为温度坐标,采集频率为5/s,采集数据表格间隔0.2s,采集时长约10min。用玻璃针筒收集一定量干燥的HCl气体(体积记为V2)。先点击“启动采集”,迅速将HCl气体从三颈烧瓶的右侧管口全部注入(因为氯化氢的密度大于氨的密度,快速注入氯化氢气体,便于充分混合气体;但注气速度不要太快、防止内压过大蹦出橡皮塞)。电脑记录软件中图线的变化,当温度和压强的曲线基本趋于平稳,停止采集并保存P-t曲线、T-t曲线,对曲线进行数学处理,分别求出曲线最高点的ΔP/Δt和ΔT/Δt量值。
2.5 实验现象与数据记录
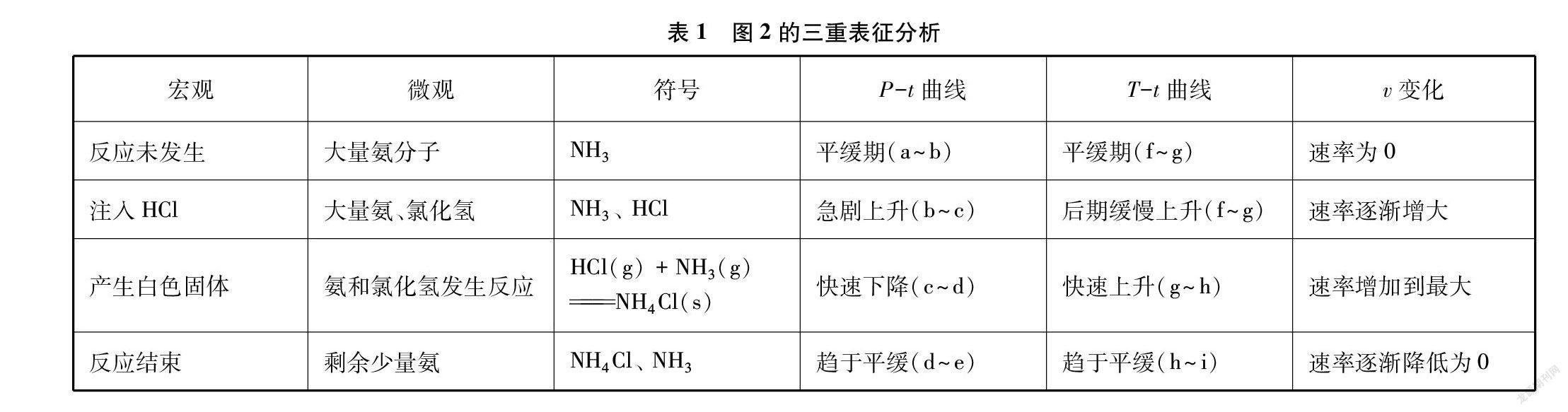
(1)V1=50mL NH3、 V2=30mL HCl体系起始压强为96.8kPa(a点)。将HCl气体注入三颈烧瓶压强增大,当HCl气体完全注入后体系压强最大为134.3kPa,同时产生大量白色固体,压强随之减小,反应结束后压强降为71.6kPa(d点)。体系起始温度为18.5℃(f点),反应放热温度升高,最高温度为38℃(h点)(压强降到最低时温度几乎上升到最高),然后温度慢慢降低,反应结束温度T2为35℃(i点)(截图上显示的是反应结束后一段时间的温度,此时温度高于起始温度,下同),如图2所示。
P-t曲线图、T-t曲线图
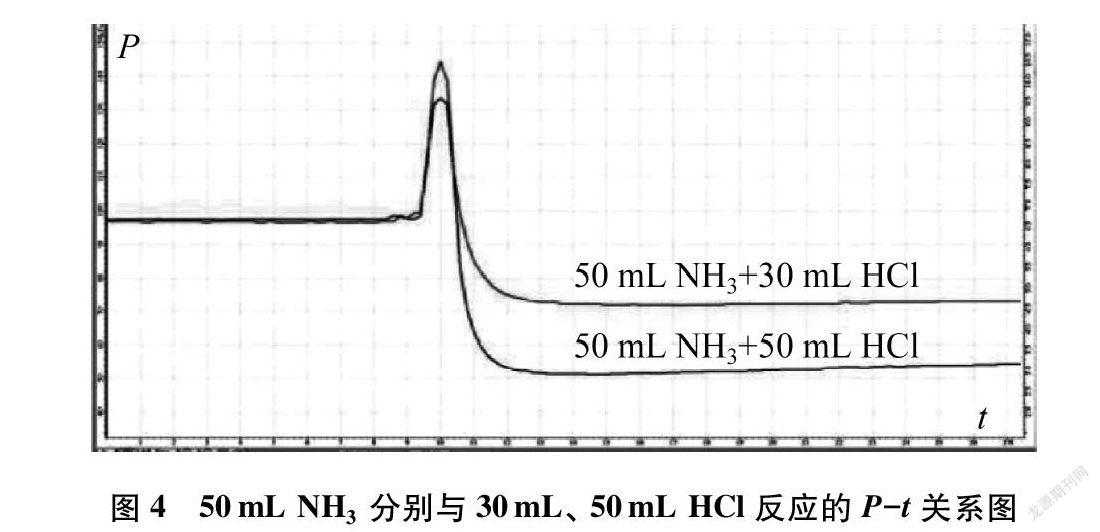
(2)V1=50mL NH3、 V2=50mL HCl体系起始压强为97.4kPa,将HCl气体注入三颈烧瓶压强增大,当HCl气体完全注入体系后压强最大为143.3kPa,同时产生大量白色固体,压强随之减小,反应结束后压强为51.1kPa。体系起始温度为22.9℃,反应放热温度升高,最高温度为67.1℃(压强降到最低时温度几乎上升到最高),然后温度慢慢降低,反应结束温度T2为49.2℃,如图3所示。
2.6 现象分析与结论
对图2进行“宏观-微观-曲线”三重表征分析,如表1所示。
将图2、图3的P-t曲线图、T-t曲线图整合得到图4、图5。
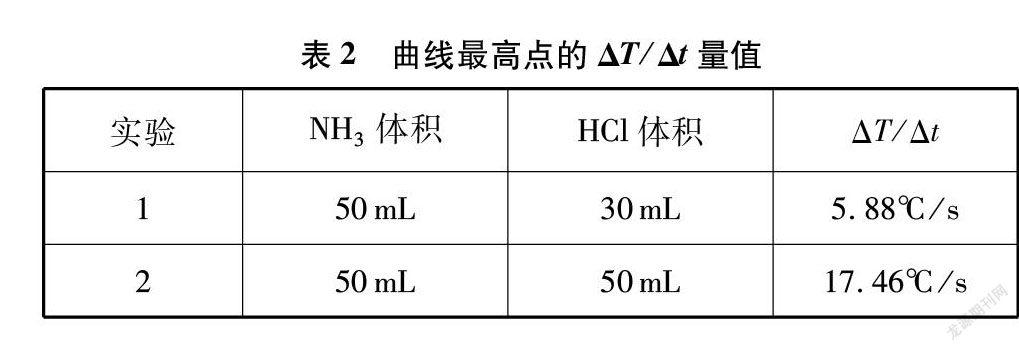
计算图4、图5的曲线最高点的ΔP/Δt、 ΔT/Δt量值,如表2所示。
分析上述曲线和数据表格,可以得出如下结论:
(1) NH3和HCl反应的P-t曲线、T-t曲线可以精确记录反应速率先变大后减小的变化。
(2) 氨的体积相同时充入氯化氢气体越多,P-t、 T-t曲线越陡,曲线最高点的ΔP/Δt与ΔT/Δt量值越大,说明此时的反应速率越大。
做了多组平行实验探究(如V1=100mL、 V2=50mL; V1=100mL、 V2=100mL),曲线形状与实验(1)、(2)的曲线形状相似,实验重现性好。
说明: 实验均在室温20℃左右进行,注入HCl气体压缩三颈烧瓶气体做功,影响体系的温度与压强,实验误差不可避免,平行实验获得的曲线图像是相同的,不影响实验结论。
以氨气和氯化氢气体为反应体系,用压强传感器和温度传感器精确捕捉反应过程中压强和温度随时间的变化,绘制P-t、 T-t曲线,描述反应速率的变化。向同体积氨气充入氯化氢气体体积越大,P-t、 T-t曲线越陡,曲线最高点对应的ΔP/Δt与ΔT/Δt量值越大,直观演示了“恒容密闭容器中,有气体参与的化学反应,增大压强反应速率增大”的现象。
本实验可以选作课堂演示实验或学生课外探究实验。
参考文献:
[1]人民教育出版社,课程教材研究所. 普通高中教科书·化学反应原理[M]. 北京: 人民教育出版社, 2020: 50.
[2]王祖浩主编. 普通高中课程标准实验教科书·化学1[M]. 南京: 江苏凤凰出版传媒集团, 2012: 37.
[3]谭文生等. 压强对化学速率影响实验的创新改进[J]. 中学化学, 2018, (2): 31.
[4]人民教育出版社,课程教材研究所. 普通高中教科书·化学必修(第二册)[M]. 北京: 人民教育出版社, 2020: 14.

