红细胞生成素基因修饰内皮祖细胞移植对大鼠糖皮质激素性股骨头坏死的影响
杨 青,吴 磊
(武汉市第五医院骨科,湖北 武汉 430050)
临床上大剂量或长时间使用激素所致的非创伤性股骨头坏死最为常见,其发病率较以往明显升高且伴有年轻化的趋势[1-3]。临床和实验研究发现,短时间内大量激素冲击或长期中小剂量使用均能导致糖皮质激素性股骨头坏死(glucocorticoidinduced osteonecrosis of the femoral head,GIONFH)。据统计,美国每年GIONFH新发病人数10000~20000例[4]。研究表明,GIONFH的早期病理改变以骨细胞及成骨细胞凋亡为主,继而出现血管病变,最终导致股骨头缺血坏死。如能够有效阻断或修复血管病变过程,则可起到预防和治疗GIONFH的作用。生理状态下,人体骨髓组织中存在大量内皮祖细胞(endothelial progenitor cells,EPC)[5-7]。EPC动员后可从骨髓组织向外周血迁移,提高血管血液内EPC水平,对损伤血管有修复作用。体内EPC或干细胞的动员、转移到损伤部位,并且修复组织损伤,是人体组织修复的重要方式之一[8-10]。当然外源性的移植或输注EPC亦可以发挥上述作用,红细胞生成素(erythropoietin,EPO)因其具有抗血管损伤及对细胞组织的保护作用亦被广泛应用于多种缺血性疾病的治疗[11-13]。故本研究探讨经EPO基因修饰后EPC(EPO-EPC)移植,对大鼠GIONFH的影响及机制,为临床治疗GIONFH提供实验依据,以进一步提高治疗效果。
1 材料与方法
1.1 动物、试剂和主要仪器
清洁级SD大鼠66只,雌雄各半,体质量为245~280 g,由武汉大学动物实验中心提供〔动物质量合格证号:SCXK(鄂)20120024,SYXK(鄂)2014-0083〕。醋酸泼尼松龙注射液(国药准字H20023134,浙江仙琚制药股份有限公司);5%胎牛血清、DMEM培养基和25%胰蛋白酶(美国Gibco BRL公司);TMR-Red调亡试剂盒和苏木素伊红染色试剂盒(武汉博士德生物工程有限公司);荧光染料 CFSE(CFDA-SE)(美国 Sigma公司);Lipofectamine TM2000 Trizol(美国Invitrogen公司):RT-PCR反转录试剂盒(北京Promega公司);Taq酶(加拿大BBI公司产品);dNT(大连TaKaRa公司);Western印迹化学发光试剂(美国Santa cruz公司);兔抗人EPO、兔抗大鼠活化胱天蛋白酶3、P53正向细胞凋亡调控因子(p53 up-regulated modula tor of apoptosis,PUMA)、BCL-XL单克隆抗体和HRP标记山羊抗兔IgG抗体和PVDF膜(均美国Pierce公司)。UVP凝胶图像扫描仪(美国Bio-Rad公司);二氧化碳培养箱(英国RS Biotech公司);荧光显微镜(日本Nikon公司);超净工作台(北京亚泰科隆)。
1.2 细胞、细胞复苏培养和CFSE标记
EPC(购于中国医学科学院),复苏接种于一次性细胞培养瓶(25 cm2)中,加入DMEM培养液5 mL,放入37℃,5% CO2培养箱培养,每隔2 d换液1次。连续传代3次后,离心去掉上清,将EPC密度调整为3×109L-1,进行荧光染色。弃去培养基,用胰酶消化生长10 d的EPC,用培养基吹匀EPC,将CFSE加入细胞悬液中,通过DMEM培养液调整其浓度为5 μmol·L-1,随后将标记的细胞摇匀后转入细胞培养箱内培养15 min,将CFSE标记的EPC进行荧光显微镜观察。
1.3 EPO基因转染和Western印迹检测EPC中EPO蛋白表达
选取对数期的EPC,按细胞密度3×109L-1接种于6孔板(含DMEM完全培养液),EPO基因转染通过脂质体介导法进行,参照Lipofectamin TM 2000说明书实施。3 d后换液,加入筛选培养基(含G418 400 mg·L-1)培养6 d后,再换筛选培养基(含G418 200 mg·L-1)培养2周,可见阳性克隆形成,选单个克隆继续扩大培养及传代后调整细胞密度至6×1011L-1。在EPO转染后第2和4周,取生长良好EPO-EPC 6×1011L-1,提取细胞蛋白。以BCA法测定蛋白质浓度,蛋白上样,SDS-PAGE电泳,电泳后的蛋白样品转至PVDF膜。转膜后用5%脱脂奶粉4℃封闭4 h,TBST漂洗后与一抗(1∶1500)37℃孵育2 h;TBST洗去一抗,加入HRP标记山羊抗兔IgG抗体(1∶1000)结合1 h;加入ECL显影,洗片后采用图像分析仪处理实验结果,Quantity One-1-D软件分析结果。
1.4 动物模型制备和分组
SD大鼠66只,im给予醋酸泼尼松龙注射液49 mg·kg-1,连续注射7 d造模,7 d后随机抽取6只大鼠观察股骨头病理变化确定造模成功。余60只大鼠随机分为3组(每组20只)。模型组:尾静脉注射L-DMEM 0.5mL;EPC组:尾静脉注射EPC悬液6×108L-10.5mL;EPO-EPC组:尾静脉注射EPO-EPC悬液6×108L-10.5 mL。每天1次,连续治疗7 d。
1.5 RT-PCR检测股骨头坏死组织EPO、活化胱天蛋白酶3、Puma和Bcl-xImRNA表达水平
各组随机取大鼠5只,取双侧股骨头坏死组织,液氮至冻研磨后,按照Trizol试剂说明书步骤提取股骨头组织总RNA,通过紫外分光光度计测定RNA的总含量,通过RT-PCR两步法试剂盒将mRNA逆转录为cDNA,然后再将cDNA进行PCR扩增。引物见表1。反应条件:94℃预变性1 min,94℃变性30 s,58℃退火30 s,72℃延伸30 s,共40个循环。PCR产物经电泳分离,通过凝胶分析系统对扩增条带进行分析,以目的基因与GAPDH灰度值比值表示目的基因相对表达水平。
1.6 Western印迹法检测股骨头坏死组织EPO、活化胱天蛋白酶3、Puma和BCL-XL蛋白水平
将1.5提取RT-PCR后剩余物按400×g离心30 min,取上清为粗体蛋白,Bradford法测定蛋白质浓度。取各组等量蛋白上样,SDS-PAGE电泳,电泳后将蛋白转至PVDF膜上,转膜后5%的脱脂奶粉4℃封闭4 h,加入EPO、活化胱天蛋白酶3、Puma、BCL-XL和GAPDH抗体(1∶1500稀释),孵育12 h后洗膜,加入HRP标记山羊抗兔IgG抗体(1∶1000)结合1 h,加入ECL显影,洗片后采用图像分析仪处理实验结果。Quantity One-1-D软件分析结果进行半定量分析,以目的蛋白条带积分吸光度值与内参条带积分吸光度值的比值表示目的蛋白相对表达水平。
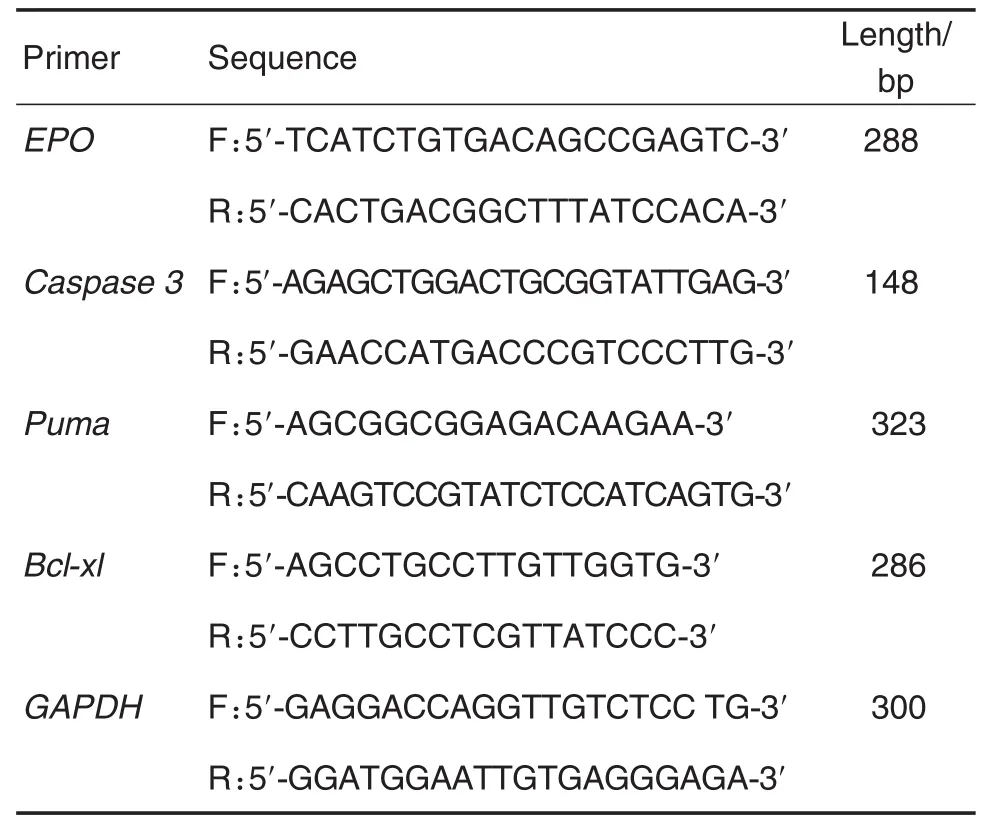
Tab.1 Sequences of primers
1.7 TUNEL法检测股骨头骨细胞凋亡率
各组另随机取大鼠5只,取双侧股骨头坏死组织,4%多聚甲醛固定,常规进行石蜡包埋及超薄切片(4 μm),制备股骨头组织切片(均沿着股骨长轴同一方向纵向切片)。采用TMR-Red调亡试剂盒根据说明书进行股骨头坏死组织细胞凋亡检测。红色表示调亡细胞核,蓝色(DAPI)表示全部细胞核。随机选取10个高倍视野计算股骨头细胞凋亡率(%)(凋亡细胞核/全部细胞核×100%)。
1.8 行为学实验测定大鼠活动总距离、自主活动次数和抓力
4周后,各组剩余的10只大鼠进行行为学检测。每次实验均在7∶00 am-12∶00 am进行。①开场实验:在环境安静下,实验在立方形敞箱(40 cm×80 cm×80 cm)内进行,周壁、底面为黑色,箱底面被白线划分为25块相等的面积,实验前10 min将大鼠放入到测试实验室内进行适应后,操作人员握住大鼠尾根部的1/3处,轻轻把大鼠放人到旷场箱的中央区中心方格内,并开始同步进行摄像、计时,每只大鼠测定1次,每次测定10 min。记录大鼠的平均速度及运动总长度以观察其活动度。②大鼠自主活动次数测定:将大鼠置于自主活动仪内,预适应10 min,然后进行摄像记录每只大鼠在3 min和5 min内的活动次数,每只大鼠测定1次,代表大鼠的自主活动量。③大鼠抓力测试:抓持大鼠尾根处,待大鼠抓紧抓力板时同时加力后拉,测到最大抓力值,测定3次,取平均值。
1.9 HE染色观察股骨头形态及骨小梁面积百分数、骨小梁宽度增加和骨小梁分离度的检测
行为学实验结束后,随机取各组大鼠5只,取双侧股骨头组织,10%甲醛固定,制备股骨头组织切片(均沿着股骨长轴同一方向纵向切片);经过梯度乙醇逐级脱水后,石蜡包埋,4~5 μm连续切片,脱蜡后,进行HE染色,光学显微镜观察各组大鼠股骨头病理形态变化。通过半自动图像数字化分析仪,包括光镜和荧光显微镜、数字化板、电脑和形态学程序“Stereology”体视学软件,测量大鼠股骨头组织的骨小梁面积百分数、骨小梁宽度增加和骨小梁分离度
1.10 荧光显微镜观察移植的CFSE标记EPC在股骨头的分布
将1.9中切片荧光显微镜下观察,通过CFSE标记的EPC在股骨头组织中的存活及分布。对每张组织切片在视野中随机选取出3个视野并对其进行拍照记录。通过Image J软件对每个视野进行计数,3个视野计数后取均值。每组5只大鼠,测量后取均值,为荧光细胞平均数。
1.11 统计学分析
2 结果
2.1 EPC形态观察和转染标记
接种培养1周内,显微镜下可见贴壁细胞逐渐增多且体积增大,细胞形态为纺缍形、多边形或类圆形;培养1~2周,显微镜下可见贴壁细胞形态呈“铺路石”样外观(图1A)。第3代细胞可见EPC的标记,CFSE标记的EPC在荧光显微镜下绿色荧光(图1B),表明CFSE标记后,阳性标记率合格,标记细胞形状完好,可见细胞在体外的诱发分化。
2.2 EPO-EPC中EPO蛋白的表达
Western印迹检测结果显示(图2),较之空白对照及空载质粒组,转染后2周和4周,EPO蛋白在基因修饰组表达均显著升高(P<0.01)。由此可知,基因修饰处理可以使EPC高表达EPO至少持续4周。
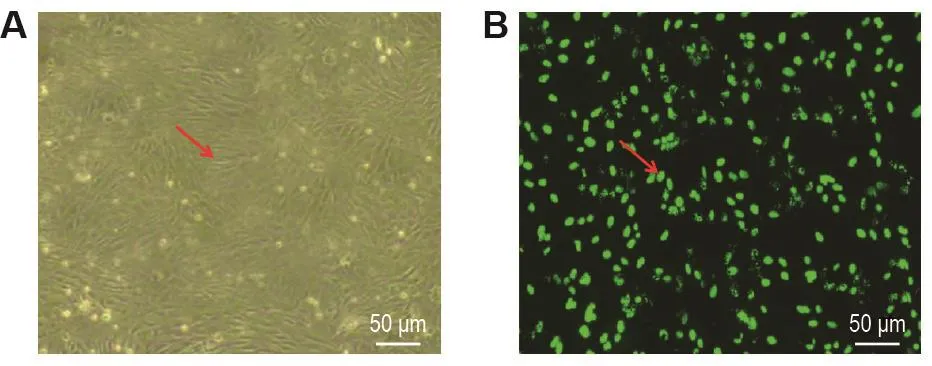
Fig.1 EndotheIiaI progenitor ceII(EPC)morphoIogy(A) and carbox fIuorescenceindiacetate succinimidyIester(CFSE)IabeIing(B).Arrows show the appearance of"paving stone"in Fig.A and CFSE labeled EPC in Fig.B.
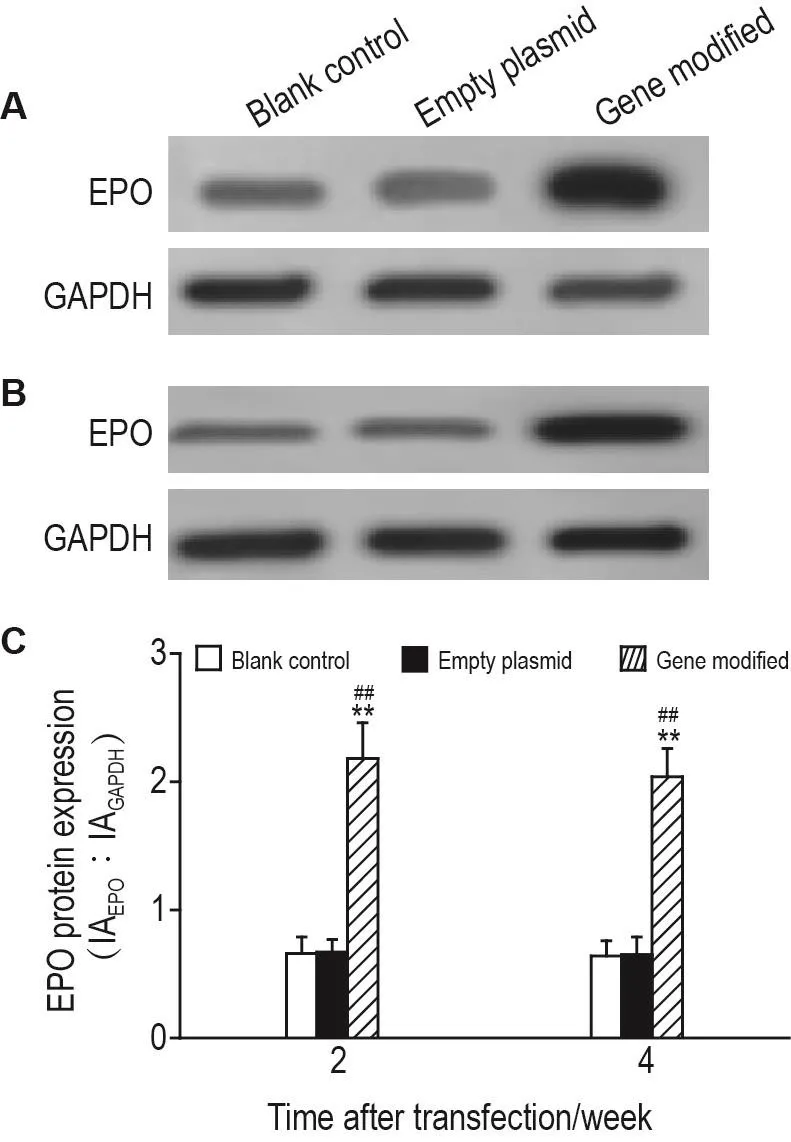
Fig.2 EPO protein expression in EPCs at 2(A)and 4(B)weeks after EPO transfection by Western bIotting.C was the semi-quantitative result of A and B.±s,n=3.**P<0.01,compared with blank control group;##P<0.01,compared with empty plasmid group.
2.3 移植EPO-EPC对GIONFH大鼠股骨头组织中EPO、活化胱天蛋白酶3、Puma和Bcl-xImRNA表达水平的影响
RT-PCR结果显示(图3),与模型组相比,EPC组大鼠股骨头区组织活化胱天蛋白酶3和Puma mRNA明显降低(P<0.05),Bcl-xl和EPO mRNA表达明显升高(P<0.05);与EPC组相比,EPO-EPC组大鼠股骨头区组织活化胱天蛋白酶3和Puma mRNA明显降低(P<0.05),Bcl-xl和EPO mRNA表达明显升高(P<0.05)。
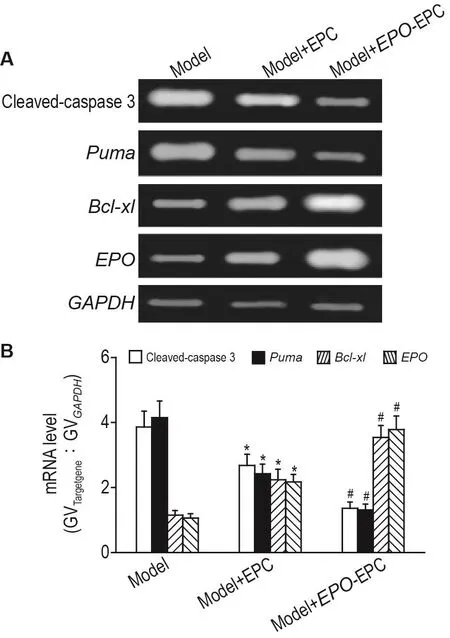
Fig.3 Effect of EPO gene-modified EPC(EPO-EPC)transpIantation on mRNA expressions of EPO,cIeavedcaspase 3,Puma and Bcl-xl in femoraI head necrosis tissue of rats with gIucocorticoid-induced osteonecrosis of the femoraI head(GIONFH)by RT-PCR.SD rats were injected with prednisolone acetate injection(49 mg·kg-1 intramuscular injection)for one week.They were randomly divided into 3 groups,model group(0.5 mL L-DMEM via tail vein injection),EPC group(0.5 mL EPCs 6×108L-1via tail vein injection)and EPO-EPC group(0.5 mL EPO modified EPCs 6×108L-1via tail vein injection),once per day for 7 d.B:the semi-quantitative result of A.±s,n=5.*P<0.05,compared with model group;#P<0.05,compared with model+EPC group.
2.4 移植EPO-EPC对GIONFH大鼠股骨头组织中EPO、活化胱天蛋白酶3、Puma和BCL-XL蛋白表达水平的影响
如图4所示,移植后7 d,与模型组相比,EPC组活化胱天蛋白酶3和Puma蛋白表达增高(P<0.05),BCL-XL和EPO蛋白表达显著降低(P<0.05);与EPC组相比,EPO-EPC组活化胱天蛋白酶3和Puma蛋白显著降低(P<0.05),BCL-XL和EPO蛋白表达显著升高(P<0.01)。
2.5 移植EPO-EPC对GIONFH大鼠股骨头骨细胞凋亡的影响
TUNEL结果(图5)显示,蓝色荧光为DAPI标记细胞核,红色荧光为TUNEL凋亡细胞细胞核。模型组骨细胞凋亡率(64±9)%,EPC组骨细胞凋亡率(42±6)%(P<0.01),EPO-EPC组细胞凋亡率(18±3)%(P<0.01)。

Fig.4 Effect of EPO-EPC transpIantation on protein expressions of EPO,cIeaved-caspase 3,Puma and BCL-XL in femoraI head necrosis tissue of rats with GIONFH by Western bIotting.See Fig.3 for the rat treatment.B:the semi-quantitative result of A.±s,n=5.*P<0.05,compared with model group;#P<0.05,##P<0.01,compared with model+EPC group.
2.6 移植EPO-EPC对GIONFH大鼠行为的影响
EPO-EPC组大鼠10 min活动总距离显著大于EPC组和模型组(P<0.05),EPC组大于模型组(P<0.05);EPO-EPC组大鼠自主活动次数显著大于EPC组和模型组(P<0.05),EPC组大于模型组(P<0.05);EPO-EPC组大鼠抓力大于EPC组和模型组(P<0.05),EPC组大于模型组(P<0.05)(表2)。
2.7 移植EPO-EPC对GIONFH大鼠股骨头坏死组织病理和形态的影响
由图6所示,治疗后4周,模型组大鼠骨小梁变窄,形态不规则,明显变稀疏,骨小梁分割程度亦明显下降,骨髓腔扩大(图6A)。EPC组骨小梁变窄较之减轻,断裂明显减少,部分骨小梁较粗,骨小梁分割程度、骨小梁连接程度优于股骨头坏死组(图6B)。EPO-EPC组上述病理变化进一步减轻,骨小梁坏死、缺失进一步减轻,骨陷窝内骨细胞进一步增多(图6C)。骨组织形态参数测定结果(表3)显示,与模型组相比,EPC组和EPO-EPC组骨小梁面积百分数、骨小梁宽度增加(P<0.05),骨小梁分离度减少(P<0.05)。
2.8 移植EPO-EPC对GIONFH大鼠坏死股骨头组织CFSE标记阳性细胞数量的影响
如图7所示,模型组未见CFSE标记的阳性细胞,EPC组高倍视野可见CFSE标记的EPC为32±4,EPO-EPC组CFSE标记的EPC为54±5,明显多于EPC组(P<0.01)。

Tab.2 Effect of EPO-EPC transpIantation on hindIimb motor abiIity of rats with GIONFH
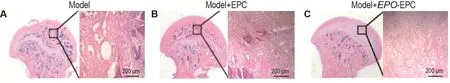
Fig.6 Effect of EPO-EPC transpIantation on pathoIogicaI changes of femoraI head tissue of rats with GIONFH by HE stainning.See Fig.3 for the rat treatment.

Tab.3 Effect of EPO-EPC transpIantation on behavior of rats with GIONFH
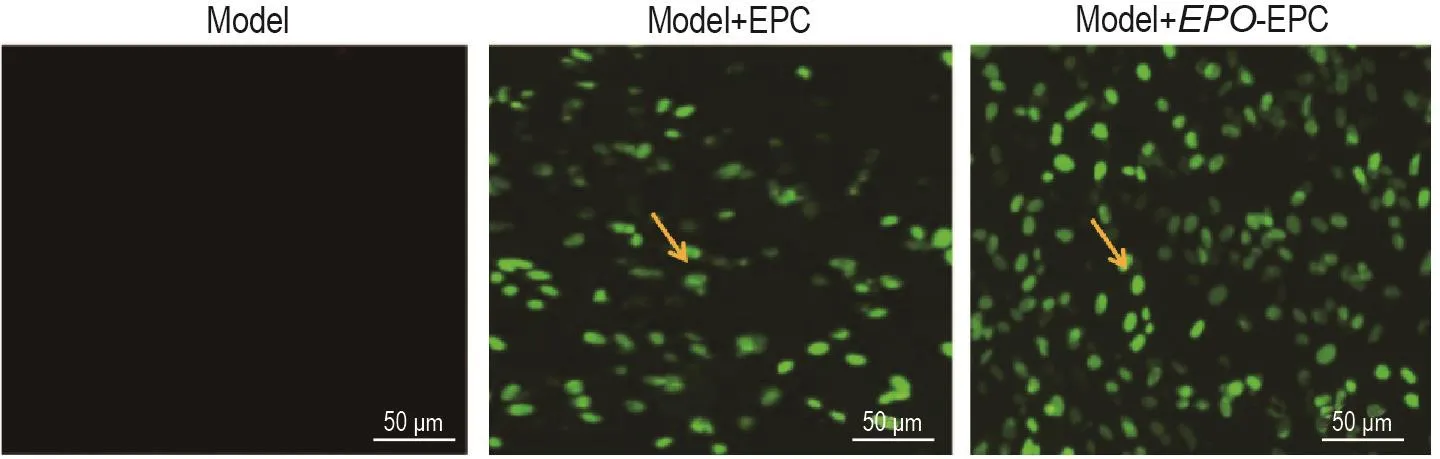
Fig.7 Effect of EPO-EPC transpIantation on distribution of CFSE-IabeIed EPCs in femoraI head tissue of rats with GIONFH by fIuorescence microscope observation.See Fig.3 for the rat treatment.Arrows show CFSE-labeled EPCs.
3 讨论
本研究发现,真核表达质粒pcDNA3-EPO转染EPC后,EPO能够稳定表达4周;EPO-EPC移植能够有效缓解大鼠GIONFH坏死区病理损伤,使得骨小梁面积百分数、骨小梁宽度增加,骨小梁分离度减少,局部凋亡率降低,CFSE标记的EPC移植后存活率升高。进一步研究发现,EPO-EPC组大鼠股骨头区组织活化胱天蛋白酶3、Puma基因和蛋白明显降低、BCL-XL和EPO基因和蛋白表达明显升高,表明EPO-EPC移植治疗大鼠GIONFH机制与移植EPC细胞的存活、高表达EPO及促进BCL-XL和抑制活化胱天蛋白酶3及Puma基因和蛋白表达有关。
临床研究表明,人体骨髓EPC的数量与骨密度成显著性正相关,表明EPC对骨组织新陈代谢可能有正调控作用,能够有效促进成骨作用[14-16]。由此可以推测,若通过静脉移植EPC提高体内成骨细胞的数量,可能对GIONFH发挥治疗作用。本研究结果显示,EPC移植或者EPO-EPC移植后能够有效缓解大鼠GIONFH区病理损伤,表明EPC移植具有修复坏死骨质的作用。
EPO是一种多效性细胞因子。研究表明,其在促进红细胞生成的同时能够在多种疾病中通过其抗凋亡作用实现对组织细胞的保护作用,其对GIONFH有预防和治疗作用[17-19]。另有研究表明,EPO可以协同其他生长因子加速红系组细胞的增殖及成熟,并能促进骨髓中红细胞的释放[20-22]。本研究结果显示,EPC在转染人EPO基因后2和4周EPO高表达,表明转染稳定可靠。将EPO-EPC尾静脉移植到大鼠GIONFH区,结果显示,EPO-EPC组病理变化较EPC移植组进一步减轻。EPO-EPC组大鼠股骨头坏死区组织活化胱天蛋白酶3和Puma基因和蛋白明显降低,BCL-XL和EPO基因和蛋白表达进一步升高,细胞凋亡进一步减少。EPO-EPC组骨小梁面积百分数、骨小梁宽度增加,骨小梁分离度减少,CFSE标记细胞进一步增多。行为学实验结果显示,大鼠活动总距离、自主活动次数及抓力EPO-EPC组明显高于模型组和EPC组。以上结果表明,EPO-EPC对GIONFH修复作用更为明显。
Puma是近十多年来新发现的一个促凋亡基因[23-25],在细胞凋亡中起到重要作用,其编码的Puma蛋白是BCL-2家族成员之一,经线粒体途径诱导细胞凋亡,与BCL-2/BCL-XL之间相互作用,促凋亡分子的释放及胱天蛋白酶级联效应是Puma凋亡效应的分子基础[26-28]。本研究发现,EPC移植可以显著下调活化胱天蛋白酶3、Puma基因和蛋白的表达,EPO-EPC组下调更为明显,提示EPO基因修饰EPC,改善GIONFH可能与其下调活化胱天蛋白酶3和Puma基因和蛋白的表达有关。有研究发现,骨细胞和成骨细胞的凋亡是GIONFH最早期的病理改变[29-30]。本研究发现,移植后7 d,成骨细胞和骨细胞凋亡指数EPO基因修饰组最低,推测对骨细胞和成骨细胞的凋亡进行阻断可能是GIONFH治疗的有效途径之一。EPO可能能通过抑制成骨细胞和骨细胞凋亡,发挥对大鼠GIONFH的保护作用。同时行为学检测结果表明,大鼠肢体活动能力明显改善,EPO-EPC组更明显,表明EPC移植对股骨头坏死有治疗作用,经EPO-EPC移植能进一步提高治疗效果。
综述所述,EPO-EPC移植到大鼠激素性股骨头坏死区,坏死病灶内有新骨生成和血管形成,减少成骨细胞和骨细胞凋亡指数,表明EPO-EPC移植治疗股骨头坏死的有效性。EPO-EPC移植对股骨头坏死治疗的具体作用机制尚需进一步探讨。

