3D 打印技术在生物医学领域的应用及展望
蔡军杰,魏晓慧,林 松*,刘丽娜,刘 博,刘士胜
(1.军事科学院系统工程研究院卫勤保障技术研究所,天津 300161;2.联勤保障部队第980 医院邯郸院区医学工程科,河北邯郸 056001;3.河北工程大学附属医院医学影像科,河北邯郸 056004)
0 引言
1990 年,美国麻省理工学院的Sachs 等[1]首次提出了3D 打印这一概念。20 世纪90 年代以来,3D 打印技术取得了蓬勃发展。2003 年,美国南卡罗纳大学的Mironov 等提出生物组织器官3D 打印的概念[2-3]。3D 打印是相对于传统平面打印而言,打印出来的物体是立体的。在立体成型方面,相对于传统加工的等材制造、减材制造,3D 打印是典型的增材制造,即逐层叠加形成三维结构。3D 打印作为决定未来经济和人类生活的颠覆性技术之一[4],有效地将材料、机械制造、信息处理、电子设备及工程设计等学科深度融合,突破了传统制造工艺受限于结构复杂性难以进行加工制造的困境。通过3D 打印定制个性化产品,将降低生产成本,引领一场新的工业革命[5]。目前,3D 打印广泛应用于生物医学、航空航天、建筑设计、文化产业、工业制造和军事装备等领域,特别是在生物医学领域,3D 打印发挥着越来越重要的作用[6]。
3D 打印技术的前身即快速成型技术。其基本思想是以数字化3D 模型为基础,对物体进行数字化分层,得到每层的二维加工路径等信息,利用合适的材料和工艺,通过自动化控制技术,沿着设定路径逐层打印,最终累积成三维物体。经过几十年不断探索和发展,3D 打印根据打印原理大致可分为7 类,分别是:(1)薄材叠层,包括叠层实体制造(laminated object manufacturing,LOM);(2)立体光固化,包括光固化成型(stereo lithography appearance,SLA)、数字光处理(digital light processing,DLP)、连续液面提取(continuous liquid interface production,CLIP)、双光子聚合(two-photon polymerization,TPP);(3)材料挤出,包括熔融挤出成型(fused deposition modeling,FDM)、直接墨水书写(direct ink writing,DIW);(4)材料喷射,包括纳米颗粒喷射(nanoparticle jetting,NPJ)、聚合物喷射(polymer jetting,PolyJet)、电喷印(electrohydrodynamic jet printing,E-Jet);(5)黏结剂喷射,包括三维打印与胶粘(three dimensional printing and gluing,3DP);(6)粉末床熔融,包括激光选区烧结(selective laser sintering,SLS)、激光选区熔化(selective laser melting,SLM)、直接金属烧结(direct metal laser sintering,DMLS)、电子束熔化(electronbeammelting,EBM);(7)定向能量沉积,包括激光立体成型(laser solid forming,LSF)、电子束熔丝成型(electron beam freeform fabrication,EBFF)[7-8]。
3D 打印可以同时融合多种打印技术原理,如PolyJet 喷出的是光固化树脂,喷射完成后进行紫外光固化。TPP、E-Jet 等可实现微纳尺寸结构(一般50 μm 以下)3D 打印[8]。受限于材料、工艺、技术水平等方面因素,目前成熟并广泛应用的3D 打印技术包括 LOM、SLA、FDM、SLS、SLM、3DP、DIW 及DLP。这些打印方式各有优缺点,适用于不同的打印场景。本文将重点介绍3D 打印技术在生物医学领域的应用及发展前景展望。
1 3D 打印在生物医学领域的应用
由于适用于小批量、高度定制等场合,3D 打印迅速与生物医学结合,形成生物3D 打印。生物3D打印有广义和狭义之分。广义生物3D 打印是指直接为生物医学领域服务的3D 打印。狭义生物3D 打印是指操作含有细胞的生物墨水构建活体组织结构,是生物3D 打印的高级阶段和终极目标。从发展进程来看,广义生物3D 打印可大致分为4 个层次,分别是医疗辅具、不可降解植入物、可降解植入物和载细胞打印[9]。
1.1 第一层次:医疗辅具
1.1.1 适用范围
医疗辅具是3D 打印技术在生物医学领域的初级应用,主要产品包括医学模型和体外医疗器械等,一般不要求生物相容性。在医疗辅具制备方面,3D打印技术通常与医学影像技术结合,模拟构建人体结构模型,有助于患者和医务人员更好地了解病情并拟定手术方案。
1.1.2 相关研究
Stoker 等[10]于1992 年首次将SLA 技术用于颅颌面外科整形手术的术前模拟,开启了3D 打印对外科手术指导的大门。张涛等[11]报道在156 例高血压性脑出血血肿穿刺术中,78 例使用了利用患者颅脑CT 数据进行3D 打印的手术导板确定穿刺导管的角度、深度及位置。相对于传统穿刺术,手术导板提高了定位准确性,更有效地清除了血肿,如图1 所示。Raisian 等[12]在10 例单侧眶底骨折修复术中,5 例根据患者未受影响的对侧眼眶CT 数据采用聚乳酸(polylactic acid,PLA)进行 3D 打印眼眶模型,由于PLA 具有良好的生物相容性,在模型标识点附近,可安全地个性化弯曲用于修复骨面的钛网。与另外5例常规弯曲钛网对比,在眼球内陷及其他并发症等方面,植入个性化钛网重建眶骨骨折具有更好的效果。顾飞等[13]在18 例初次单侧膝关节单髁置换术中,利用患者膝关节CT 及MRI 数据,在计算机软件上测量及模拟截骨,利用3D 打印技术打印个性化截骨导板并指导手术,术后下肢力线满意,早期膝关节功能得到明显改善。周路球等[14]利用30 例颅内动脉瘤患者的三维CT 血管造影数据将动脉瘤及毗邻重要组织等比例打印出来,进行术前模拟手术训练,为提高手术准备质量、改善患者预后效果提供了保障。3D 打印将实现传统医学模型向拟人化医学模型发展,通过硅胶材质、多色彩材质、多X 射线吸光度材质、嵌入式系统及传感器技术等,实现医学模型材质拟人化、色彩拟人化、影像学拟人化、功能拟人化及智能化,大大提高医务人员技能培训水平及手术规划能力等[15]。
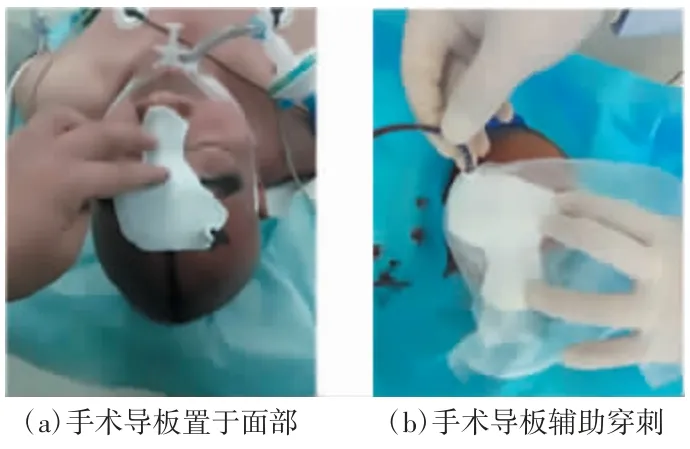
图1 3D 打印手术导板辅助血肿穿刺术[11]
1.1.3 评价
将3D 打印医疗辅具用于教学、培训、手术辅助、手术模拟及术前规划等,可促进医学知识的传播,有效减少手术时间和出血量,提高手术精度和成功率[16-17]。相对于传统医学模式,3D 打印医疗辅具能大大提高医务工作者的医学认知和手术水平。
1.2 第二层次:不可降解植入物
1.2.1 适用范围
不可降解植入物主要是使用钛、钛合金、钽等不可降解生物惰性金属材料进行3D 打印,这些材料具有优异的生物相容性、强耐腐蚀性、高强度等优点[18]。钛和钛合金是目前牙齿、骨植入物的主要金属原材料,钽等金属材料仍处于研究阶段,临床应用刚起步。根据金属材料的结构和特性,金属3D 打印方式主要包括SLS、SLM 及EBM。
1.2.2 相关研究
游嘉等[19]利用3D 打印技术打印出连通多孔结构的钛金属多根牙种植体,孔隙300~400 μm,通过动物实验及对照,骨组织长入种植体表面孔隙内,且具有高骨组织致密性,表明3D 打印牙种植体具有良好的骨结合能力。张豪等[20]对13 例患者使用3D打印钛合金胸肋骨植入物进行胸壁缺损重建手术,随访观察1 a,未发生植入物断裂、移位、排斥、过敏等情况,临床效果良好,可满足个性化胸壁重建修复需求。郭宇等[21]根据8 名患者骨盆CT 数据,根据髋臼骨缺损形态设计并打印钛合金骨小梁金属臼杯(如图2 所示),结合植骨等技术,重建髋臼骨缺损。临床结果显示,术后患者大大改善了髋关节功能,可恢复关节旋转中心,早期临床疗效满意。裴延军等[22]行6 例患者下肢骨肿瘤切除术,骨缺损长度(18.19±3.74)cm,利用3D 打印技术打印钛合金假体并植入,与缺损部位匹配良好。至末次随访,无肿瘤复发及转移,假体稳定,未发生假体周围感染等,5 例患者能正常活动,获得良好的短期临床疗效。Wauthle 等[23]通过SLM 制备多孔钽植入物,具有高孔隙率、高弹性模量、无细胞毒性等特点,满足骨植入材料要求。动物实验表明,植入体内后有明显骨组织长入,与骨界面形成较好的结合,证明3D 打印多孔钽植入物具有优良的力学性能、生物相容性和骨传导性等,可以用来修复治疗骨缺损。
1.2.3 评价
钛等金属植入物在临床应用中被广泛使用,并在今后相当长一段时间内仍是临床使用主流,但因其射线不可透、不可生物降解等缺陷,在特定场合有必要研制新型材料进行替换。

图2 3D 打印钛合金骨小梁金属臼杯[21]
1.3 第三层次:可降解植入物
1.3.1 适用范围
可降解植入物主要用于骨组织工程支架、神经支架等。根据材料属性可分为3 类,分别是:(1)金属,包括铁合金、镁合金;(2)生物陶瓷无机材料,包括羟基磷灰石(hydroxyapatite,HA)、β-磷酸三钙(betatricalcium phosphate,β-TCP)、硅酸钙(CaSiO3)、硅酸二钙(2CaO·SiO2);(3)聚合物,包括聚己内酯(polycaprolactone,PCL)、聚乳酸-羟基乙酸共聚物(poly(lactic-co-glycolic acid),PLGA)[24]。植入物可定制合适的刚度和孔隙度,最大限度促进组织融合及自身降解。金属材料力学性能好,生物相容性较差;生物陶瓷无机材料力学性能差,生物相容性好;聚合物力学性能和生物相容性均较好。为了平衡力学性能及生物相容性等方面因素,多采用复合材料进行可降解植入物的生物3D 打印。
1.3.2 相关研究
Chou 等[25]通过黏结剂喷射打印、烧结等过程形成铁锰合金可生物降解骨支架,支架表现出与天然骨相似的拉伸力学性能、良好的生物相容性,是一种较为理想的生物应用材料。Bose 等[26]将氧化铁和二氧化硅混入β-TCP 中,利用3D 打印形成支架,动物实验表明,掺杂Fe3+、Si4+能促进早期新骨和血管的形成,加速骨缺损愈合。Lai 等[27]以镁(Mg)粉、PLGA、β-TCP 为原料,采用低温3D 打印技术制备了新型多孔PLGA/TCP/Mg(PTM)支架。在兔类固醇相关性骨坏死实验中表明,PTM 能显著促进新骨形成及血管生长,表现出较好的力学性能,是一种很有前途的复合生物材料。Zhang 等[28]采用3D 凝胶打印多孔硅酸钙骨组织工程支架,通过调整配比、固化成型、自然干燥、脱脂、烧结等过程,得到的支架具有均匀的孔隙和微孔,支架的孔隙率和抗压强度与人体松质骨相当,如图 3 所示。Williams 等[29]使用 SLS 制备多孔PCL 支架用于骨组织工程,研究表明,支架抗压强度和模量均在松质骨范围内,支持骨组织入内生长。Vijayavenkataraman等[30]以PCL 和还原氧化石墨烯(reduced graphene oxide,rGO)采用 E-Jet 打印出PCL/rGO 支架,实验表明,PCL/rGO 支架比 PCL 支架更能促进PC12 细胞的神经分化,为解决周围神经损伤、制作神经引导导管提供了可选方案。
1.3.3 评价

图 3 3D 打印 CaSiO3 支架[28]
在特定情况下,具有安全降解产物的可降解植入物比不可降解植入物对人体影响更小,更有利于人体组织生长及功能恢复。部分可降解植入物已在临床上初步使用,但需要突破的技术瓶颈还有很多,如降解周期的优化、降解产物对患者的长期影响及生产成本等,还需要科研人员不断研究探索。
1.4 第四层次:载细胞打印
1.4.1 适用范围
载细胞打印是指活体细胞包裹在水凝胶等生物材料中形成生物墨水,以3D 打印的方式构建器官或器官原型,可广泛应用于组织修复、组织发育机制及药物筛选等场合[31]。水凝胶是由分散在水介质的亲水聚合物链通过各种交联机制形成的,常用的亲水聚合物包括海藻酸盐、明胶、甲基丙烯酸酐化明胶(methacrylate gelatin,GelMA)。交联是指液态转变为锁水网络状固态的过程,交联机制包括热诱导纠缠、分子自组装、静电相互作用、离子交联和化学交联[32]。水凝胶等生物材料的作用是打印时保护细胞不受损坏,使细胞分布均匀、防止沉降,打印后为细胞生长模拟体内环境。常见的载细胞打印方式有DIW、SLA和E-Jet 等[33],前2 种打印方式使用最为广泛。目前载细胞打印的研究主要集中在皮肤、血管、软骨、组织器官及肿瘤模型等方面。
1.4.2 相关研究
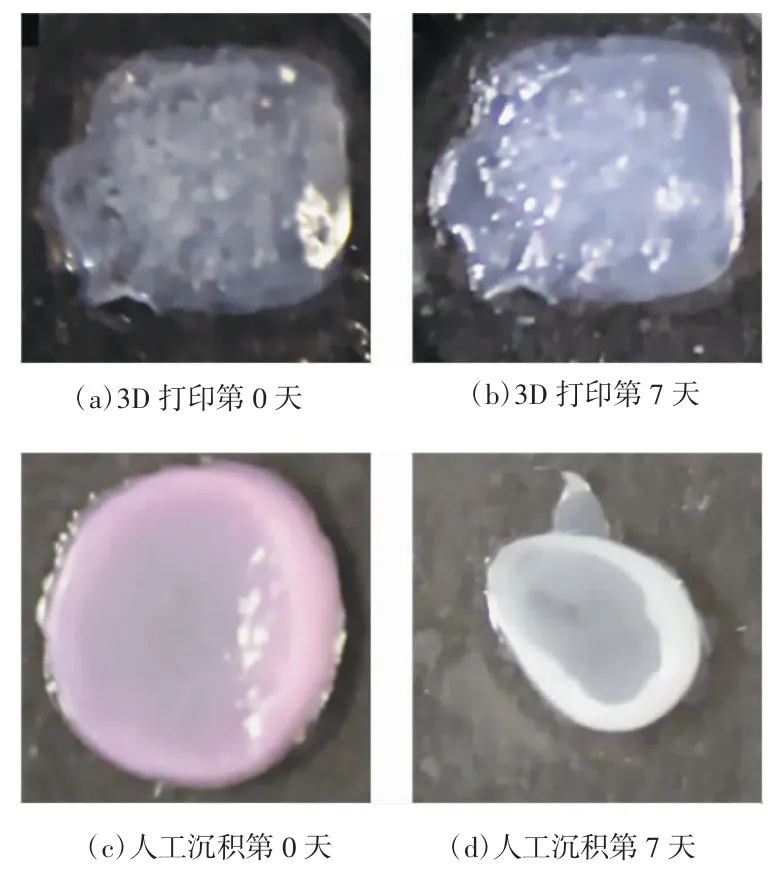
图4 3D 打印与人工沉积制备皮肤组织的对比[34]
Lee 等[34]运用挤出式生物打印技术以角质形成细胞和成纤维细胞作为表皮和真皮的组成细胞、胶原作为真皮基质,分层对皮肤进行模拟打印,组织学和免疫荧光表征表明,3D 打印的皮肤组织在形态学和生物学上可代表人类活体皮肤组织。对比传统皮肤工程方法(人工沉积),3D 生物打印皮肤具有灵活性、重复性、形状保持和培养能力等方面的优势,可作为进一步研究皮肤病模型的基础,如图4 所示。Kolesky 等[35]利用人骨髓间充质干细胞(human mesenchymal stem cells,HMSCs)、新生儿真皮成纤维细胞(human neonatal dermal fibroblasts,HNDFs)、脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)组成的多种生物墨水打印血管,将实质、基质和内皮整合到血管厚组织中,形成可灌注、内皮化的血管网络组织,为人体组织制作和研究开辟了新的路径。Nguyen 等[36]利用人诱导多能干细胞(human induced pluripotent stem cells,hiPSCs)、受辐射的人软骨细胞、纳米纤维素(nanofibrillated cellulose,NFC)和海藻酸盐组成生物墨水进行3D 打印,有明显的软骨生成,可作为未来关节软骨修复的一种治疗手段。Lee 等[37]使用悬浮水凝胶自由形式可逆嵌入(freeform reversible embedding of suspended hydrogels,FRESH)方法,用胶原蛋白进行3D 打印,形成具有一定功能的心脏“零件”,这项突破性研究向全尺寸打印心脏及人体其他器官迈近了一步。Ma 等[38]通过DLP 利用hiPSCs 来源的肝祖细胞(hepatic progenitor cells,HPCs)和支持细胞嵌入到三维微观六边形水凝胶结构,促进细胞成长,形成肝小叶结构,该模型具有天然肝脏结构,可用于肝病药物筛选和建模等。Yi 等[39]利用生物墨水直写构建高度仿生的体外胶质母细胞瘤模型,根据不同患者产生特异性的肿瘤类似物,观察体外环境放、化疗对患者肿瘤的细胞学影响及特异性反应,帮助评估方案的治疗效果,为临床精准用药提供依据。
1.4.3 评价
目前,载细胞打印仍处于实验室研究阶段,需要解决能不能造、能不能活、能不能用等问题,具体包括水凝胶等生物材料成型精度能否达到组织要求、营养素输送能否满足细胞需求、堆叠细胞能否发挥整体生物组织功能。尽管载细胞打印取得一些成绩,但依然任重而道远。
2 3D 打印在生物医学领域的前景展望
2.1 国家层面支持
近年来,国家有关部门对3D 打印产业发展高度重视,分别在标准化发展、规章制度保障等方面给予支持,大力推进3D 打印技术在生物医学领域标准化、规范化发展,先后出台了GB/T 35351—2017《增材制造术语》、GB/T 35021—2018《增材制造工艺分类及原材料》等十余项关于增材制造的国家或行业标准。根据国家药品监督管理局2019 年第53号公告和第70 号通告,发布了《定制式医疗器械监督管理规定(试行)》《无源植入性骨、关节及口腔硬组织个性化增材制造医疗器械注册技术审查指导原则》。随着生物3D 打印技术进一步发展成熟以及应用场景的拓展,国家将出台更多标准、规范和制度,进一步规范定制式医疗器械监督管理,保障定制式医疗器械的安全性、有效性。
2.2 生物材料发展
生物材料是用于人体修复、治疗等作用的特殊类型材料,生物3D 打印对生物材料有较高的要求。对于体外接触人体的生物材料,一般要求具有生物相容性,如壳聚糖、琼脂糖、纤维素、纤维蛋白、胶原蛋白、明胶、海藻酸盐等。对于植入体内的生物材料,一般要求具有生物活性或生物可降解性,如镁合金、羟基磷灰石、硅酸钙、磷酸钙和生物活性玻璃等。近年来,细胞作为一种生物材料进行3D 打印带来了更高的挑战,细胞的活性直接决定打印体的活性。目前,可选择的生物材料依然有限,随着材料科学的发展,特别是材料科学进一步与细胞生物学结合,将研发更多适合3D 打印的生物材料并应用于生物医学领域。
2.3 打印技术革新
为满足生物医学领域产业化需求,需进一步提高3D 打印技术的效率和精度等。目前,3D 打印效率普遍偏低且精度不足,特别是载细胞打印,打印产物表面粗糙度较高,流体的流变性能对打印精度有较大影响。此外,3D 打印成品需要大量人工参与,特别是支撑物去除和后处理等环节。3D 打印技术在工艺上有进一步提升的空间,例如可与等材、减材等传统制造工艺结合,实现优势互补及效益最大化;可与人工智能、云计算等技术结合,提高自主学习能力,推动3D 打印智能化发展。
2.4 多元交叉融合
与“互联网+”一样,3D 打印将作为一种技术手段融入人类生活的方方面面,形成“3D 打印+”,即“3D 打印+传统行业”,促进传统行业优化升级转型,推动科技不断进步。在生物医学领域,3D 打印技术将与传统医学技术深度融合,创造新的医疗产品,形成多元交叉。目前,3D 打印在药物制备、给药方式、伤口敷料等方面取得了较大的进步。在不改变配方的前提下,利用3D 打印技术打印具有特定形状的药片,通过调整体积和表面积等,控制药物释放曲线,定制个性化药物;利用SLA 等技术打印聚合物微针贴片,在微针贴片表面喷涂药品用于经皮给药(transdermal drug delivery,TDD);3D 定制打印具有较高孔隙率的水凝胶敷料,有望更有效促进感染伤口愈合,抑制瘢痕组织形成。随着3D 打印与不同元素交叉,将带来更多新型产品。
3 结语
3D 打印技术在理论上较为完备,技术工艺上也不断创新突破。作为一项革新的技术,3D 打印改变了人们的思维方式,给科学研究提供了强有力的工具,并有望创造出巨大的社会和经济效益。目前,3D打印技术已在生物医学领域广泛应用,未来将持续深入生物医学领域的各个方面,开启生物医学个性化设计和促进医疗水平质的提高,为人类健康事业提供广阔空间。

