全身交变电磁辐照疗法对2 型糖尿病小鼠神经病理性疼痛的作用效果研究
兰 娜,胡国花
(西电集团医院麻醉科,西安 710077)
0 引言
随着生活水平的不断提高,糖尿病已经成为继心脑血管病、肿瘤后影响人类健康的第三大因素。在所有糖尿病类型中,以2 型糖尿病最为常见,多发生于40 岁以上的中老年人[1-2]。2 型糖尿病患者人数占糖尿病患者的90%以上,也是最常见的严重危害中老年人健康的慢性疾病[3-4]。神经病理性疼痛是2 型糖尿病最常见的并发症之一,40%~50%的糖尿病患者存在神经病理性疼痛[5]。其临床表现为持续灼痛、间断刺痛、撕裂痛、电击痛等自发性疼痛以及痛觉过敏和痛觉超敏等刺激诱发性疼痛,严重影响患者的生活质量,疼痛长时间得不到解决则会出现抑郁甚至死亡。目前,临床应对2 型糖尿病神经病理性疼痛的常用药物包括镇痛剂、抗抑郁药、抗癫痫药、血管扩张剂、神经营养剂等,但是对于疼痛的治疗、改善效果十分有限,且会产生耐药性[6-7]。交变电磁辐照作为一种临床常见的物理治疗方法,已经在神经损伤、骨骼肌创伤、心血管疾病康复中发挥积极作用[8-9]。研究也发现交变电磁辐照具有积极的抗炎和镇痛疗效[10-11]。但是目前国内外尚未见交变电磁辐照对于糖尿病,尤其是发生率更高、危害更为广泛的2 型糖尿病所诱发的神经病理性疼痛的治疗效果的相关研究报道。本文以2 型糖尿病(db/db)小鼠为实验对象,对其进行行为学、神经电生理、分子生物学检测,旨在阐明交变电磁辐照对2 型糖尿病神经病理性疼痛的作用效果。
1 材料与方法
1.1 主要试剂及仪器
血糖分析仪,购于美国Lifescan 公司;Von Frey纤维丝,购于美国Stoelting 公司;热痛敏检测系统,购于意大利Commat 公司;麻醉剂戊巴比妥钠,购于美国Sigma 公司;cDNA 反转录试剂盒,购于北京天根生物技术公司;Maxima SYBR Green qPCR 试剂盒,购于美国Thermo 公司;Trizol(用于RNA 提取),购于美国Invitrogen 公司。
1.2 实验动物及分组
2 型糖尿病(db/db)小鼠(C57BKS 背景,BKS.Cg-m+/+Leprdb/J),3 月龄,雄性,SPF 级,购于美国Jackson 实验室;与db/db 小鼠同背景的野生型小鼠,3 月龄,雄性,SPF 级,购于美国 Jackson 实验室。全部动物实验方案遵从美国国立卫生研究院的实验动物使用指南。实验动物饲养于恒温22~24 ℃、恒湿50%~60%及恒定光照(12 h 光照、12 h 黑暗)的实验条件。全部动物适应本实验室环境1 周,随后通过尾静脉提取静脉血(晨血),测定随机血糖值,血糖值>16.7 mmol/L 且具有明显多饮、多食、多尿特征的小鼠被纳入本研究。30 只小鼠(20 只 db/db 小鼠及 10 只野生型小鼠)被分成3 组,每组10 只,分别为:野生型小鼠组(wild-type 组)、db/db 小鼠组(db/db 组)、db/db 小鼠接受交变电磁辐照(alternating electromagnetic fields,EMF)治疗组(db/db+EMF 组)。其中,db/db+EMF 组小鼠给予全身交变电磁辐照刺激,每天1 h。wild-type 组和db/db 组的小鼠予以假交变电磁辐照暴露干预。
1.3 电磁照射装置
电磁照射装置由电磁发生器和Helmholtz 线圈组成。电磁发生器由MSP430 单片机控制产生频率、强度线性可调的正弦交变电磁信号,该信号经过后续的信号调制、整合、滤波、放大处理后,将电流输出至Helmholtz 线圈。Helmholtz 线圈包含2 个相同直径(40 cm)且等轴放置的线圈组,线圈匝数为100,线圈间距为20 cm。实验所产生的交变电磁场峰值强度为5 mT,频率为50 Hz。
1.4 行为学检测
交变电磁辐照干预的第 0、1、2、3、4 周对 3 组小鼠分别进行足底机械痛阈值和热痛阈值的测定分析。机械痛阈值检测步骤:将小鼠置于单独的铁丝笼内,适应环境30 min 后,使用Von Frey 纤维丝对小鼠后足的足底给予刺激,在刺激过程中或移开纤维丝时,小鼠出现明显的抬足反射则记录为阳性,未出现抬足反射则记录为阴性。每一标号的纤维丝对每侧足刺激5 次(双侧10 次),如出现5 次以上阳性反应,则记录该纤维丝力度为被采集指标。如果发现实验动物出现5 次不抬腿的情况,则换用更高刻度的纤维丝。热痛阈值检测步骤:将小鼠置于单独的塑料笼内,适应环境30 min。应用热辐射测痛仪发射光束照射小鼠足底中部,小鼠无法耐受热痛出现抬足反射,此时光束自动切断,记录反应时间。每只小鼠单侧足底刺激5 次(双侧共10 次),每次间隔10 min,记录10 次的测量值并取平均值。
1.5 神经电生理检测
交变电磁辐照干预的第 0、1、2、3、4 周对 3 组小鼠感觉神经传导速率(sensory nerve conduction velocity,SNCV)进行测试。对各组小鼠行腹腔注射戊巴比妥钠溶液(40 mg/kg)进行麻醉,充分麻醉后将小鼠置于设有辅热装置的实验台。将2 个刺激电极分别插入小鼠的膝关节和踝关节中,待电极植入稳定后通入电流,采用生物信号采集系统记录复合动作电位的潜伏期(即神经传导时间),同时测定、记录电极和刺激电极之间的沿着神经走向的间隔距离,计算获得神经传导速率。
1.6 分子生物学检测
交变电磁辐照干预4 周后,对各组全部小鼠使用过量戊巴比妥钠溶液处死。随后通过RNA 提取试剂盒提取腰段脊髓L5 背角位置的总RNA,以2 μg RNA 为上样量,在20 μL 反应体系中对提取的RNA进行逆转录反应生成cDNA。使用Bio-Rad CFX96荧光定量PCR 仪对所选取目标基因行PCR 扩增,引物序列如下:白细胞介素-1β(IL-1β)上游引物 5′-GTGGCTGTGGAGAAGCTGTGGC-3′,IL-1β 下游引物 5′-TGGG-TCCGACAGCACGAGGC-3′;p38 丝裂原活化蛋白激酶(p38 MAPK)上游引物5′-TGAACTTCGCAAATGTATTTATTGGT-3′,p38 MAPK 下游引物 5′-ATCTGAGTCCAAAACGAGCATCT-3′;GAPDH(内参基因)上游引物5′-AGGTCGGTGTGAACGGATTTG-3′,GAPDH 下游引物 5′-TGTAGACCATGTAGTTGA GGTCA-3′。qPCR 的反应体系为:cDNA 模板 1.6 μL,上、下引物(浓度为 10 μmol/L)各 0.8 μL,SYBR Premix Ex TaqTMⅡ10 μL,最后使用去离子水将反应体系补充至20 μL。具体反应条件为:95 ℃变性预处理 3 min,随后 95 ℃变性 30 s、60 ℃退火 30 s,循环 40 次。每种基因设置 4 个复孔,使用 2-ΔΔCT法对p38 MAPK 和IL-1β 的相对表达量进行半定量分析。
1.7 统计学分析
2 结果
2.1 交变电磁辐照对db/db 小鼠体质量和血糖的影响
各组小鼠的体质量比较如图1(a)所示,可以看出,db/db 组小鼠的体质量在4 周的实验期内均显著高于 wild-type 组小鼠(P<0.05),同样 db/db+EMF 组小鼠体质量在各时间点也显著高于wild-type 组小鼠(P<0.05),但是 db/db 组与 db/db+EMF 组小鼠的体质量在各时间点无统计学差异(P>0.05)。各组小鼠的血糖值比较如图1(b)所示,可以看出,db/db 组和db/db+EMF 组小鼠的血糖值在各时间点显著高于wild-type 组小鼠(P<0.05),但 db/db 组与 db/db+EMF组之间的血糖值无显著差异(P>0.05)。
2.2 交变电磁辐照对db/db 小鼠足底机械痛阈值和热痛阈值的影响
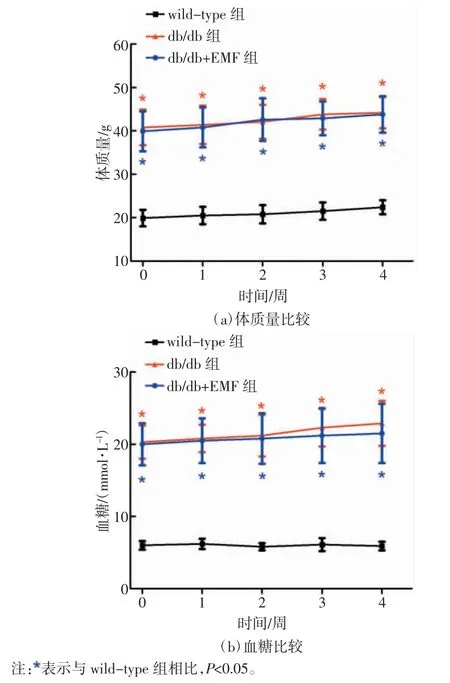
图1 交变电磁辐照对db/db 小鼠体质量和血糖的影响
如图 2(a)所示,与 wild-type 组相比,db/db 组小鼠的足底机械痛阈值在实验的第 0、1、2、3、4 周均显著性降低(P<0.05),db/db+EMF 组小鼠足底机械痛阈值在第0 周与db/db 组无明显差异,但是在第1、2、3、4 周均显著高于 db/db 组小鼠(P<0.05),并且db/db+EMF 组小鼠足底机械痛阈值在第 2、3、4 周与wild-type 组小鼠无统计学差异(P>0.05)。如图 2(b)所示,db/db 组小鼠足底热痛阈值在实验的第0、1、2、3、4 周均显著低于 wild-type 组小鼠(P<0.05),db/db+EMF 组小鼠足底热痛阈值在实验的第 1、2、3、4周均显著高于 db/db 组小鼠(P<0.05),同时 db/db+EMF 组小鼠足底热痛阈值在第3、4 周与wild-type组小鼠无明显差异(P>0.05)。
2.3 交变电磁辐照对db/db 小鼠SNCV 的影响
各组小鼠在实验各时间点SNCV 的比较如图3所示。db/db 组小鼠的 SNCV 在实验的第 0、1、2、3、4周均显著低于 wild-type 组小鼠(P<0.05)。db/db+EMF组小鼠的 SNCV 在第 0 周与 db/db 组无差异(P>0.05),但在第 1、2、3、4 周均显著高于 db/db 组小鼠(P<0.05)。同时,db/db+EMF 组小鼠的 SNCV 在第 1、2、3、4 周均显著低于 wild-type 组小鼠(P<0.05)。
2.4 交变电磁辐照对db/db 小鼠脊髓IL-1β和p38 MAPK 表达的影响
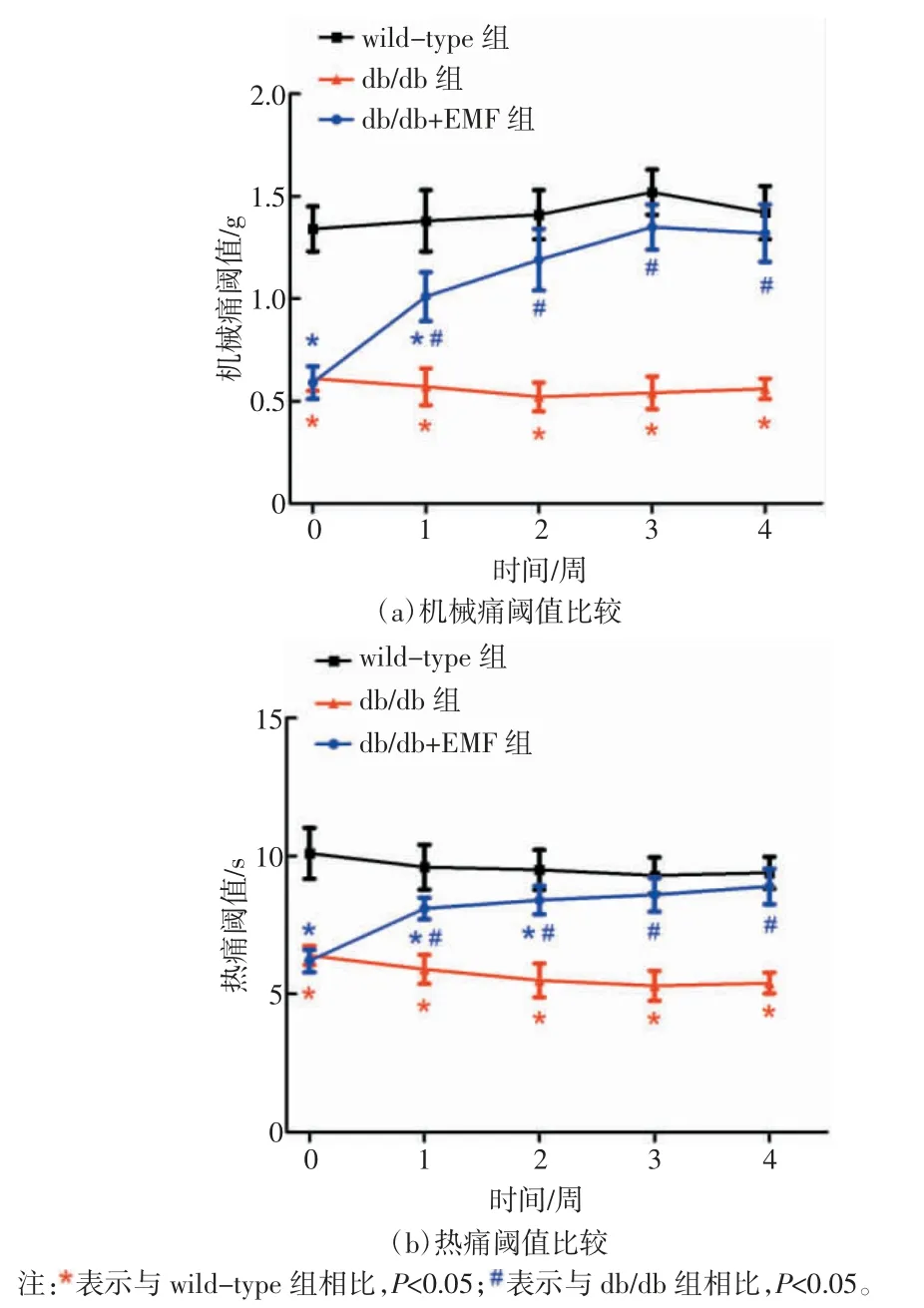
图2 交变电磁辐照对db/db 小鼠足底机械痛阈值和热痛阈值的影响
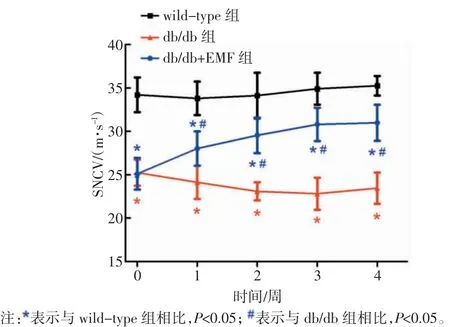
图3 交变电磁辐照对db/db 小鼠SNCV 的影响
如图 4 所示,db/db 组小鼠的脊髓 IL-1β 和 p38 MAPK 的基因表达水平均显著高于wild-type 对照组小鼠(P<0.05),db/db+EMF 组小鼠的脊髓 IL-1β 和p38 MAPK 的mRNA 表达含量显著低于db/db 组小鼠(P<0.05),而 db/db+EMF 组小鼠与 wild-type 组小鼠的脊髓IL-1β 和p38 MAPK 的基因表达水平未见统计学差异(P>0.05)。
3 讨论
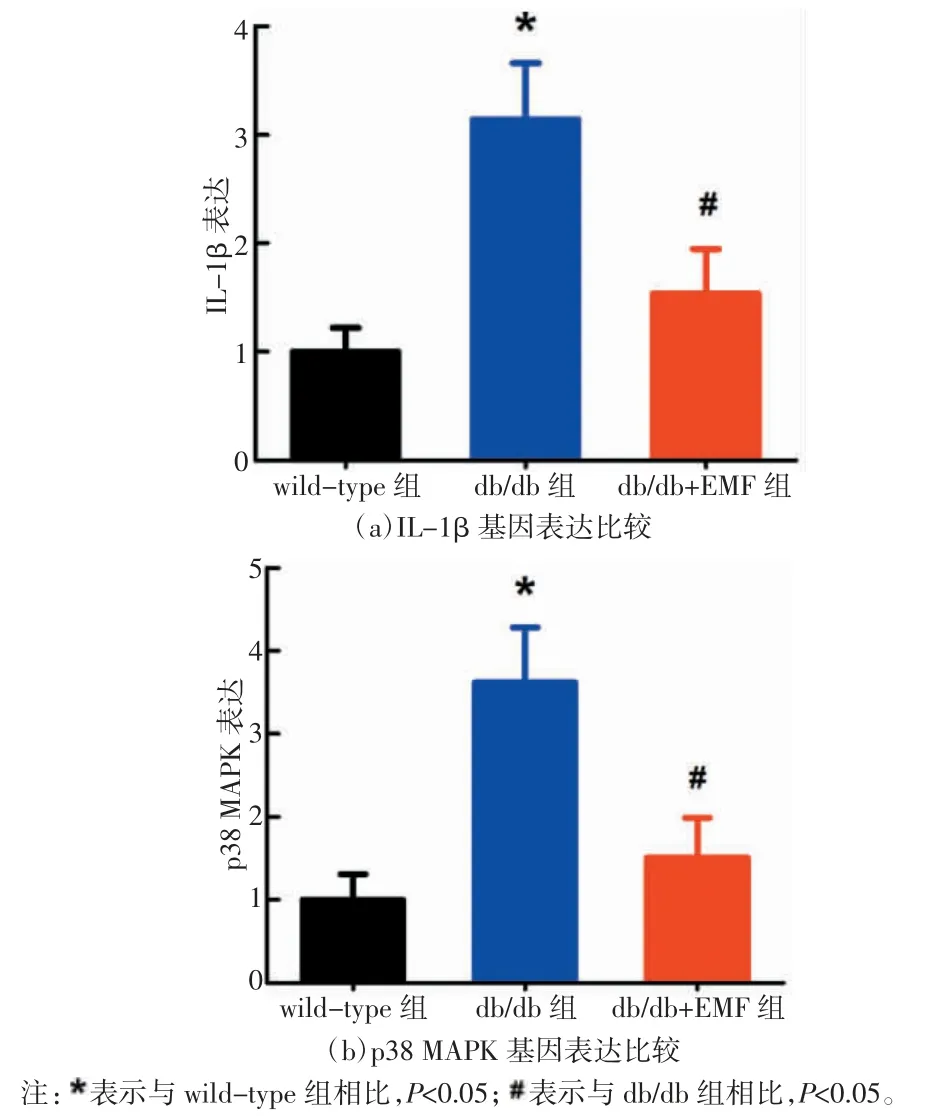
图4 交变电磁辐照对db/db 小鼠脊髓IL-1β 和p38 MAPK 基因表达的影响
电磁辐照是临床理疗科重要的治疗手段,已被证实能够在加速骨折愈合、软组织损伤修复、局部微循环改善、神经系统功能障碍改善等方面发挥积极作用[12]。电磁辐照的治疗波形多种多样,包括稳恒波式、脉冲波式、三角波式、正弦波式等,其中正弦交变电磁辐照凭借其更易获取的优势(可直接从市电进行转换获得)在临床诸多疾病的治疗中发挥重要作用。有研究发现,正弦交变电磁辐照具有消炎、镇痛的功效[10-11]。但是,正弦电磁辐照是否能够改善糖尿病尤其是2 型糖尿病的神经病理性疼痛症状,目前仍是未知。本研究中,使用瘦素受体基因(db)纯合突变的db/db 小鼠作为研究对象模拟临床2 型糖尿病。该小鼠具有肥胖、高血糖、多尿、高尿糖等与人类2 型糖尿病诸多相似的体征,也是迄今研究2 型糖尿病及其并发症最为经典的动物模型[13-14]。
为了检测2 型糖尿病(db/db)小鼠机体对于外界刺激的承受能力,本研究分别进行了足底机械痛阈值和热痛阈值的检测,发现db/db 小鼠的足底机械痛阈值和热痛阈值均显著低于wild-type 组小鼠,提示该小鼠疼痛耐受能力显著降低,这与临床2 型糖尿病患者神经病理性疼痛体征一致[15]。本研究同样发现,全身交变电磁辐照1 周开始对db/db 小鼠的疼痛耐受能力产生显著的改善效应,并且随着治疗进程的推进,改善效应越为明显,在治疗的第3 周基本可接近wild-type 组小鼠水平。本研究中对行为学的研究结果提示,全身交变电磁辐照对2 型糖尿病神经病理性疼痛的症状改善具有显著效果。
SNCV 是用于评定周围神经传导功能的一项神经电生理诊断技术,同时也是评价轴索损害的重要指标[16]。学者们前期的临床研究发现,2 型糖尿病神经病理性疼痛患者的SNCV 显著降低,且SNCV 的改变对于糖尿病神经病理性疼痛的敏感度高于运动神经传导速度(motor nerve conduction velocity,MNCV)的改变[17]。本研究发现,2 型糖尿病(db/db)小鼠在实验各时间点的SNCV 均显著低于wild-type 组,提示db/db 小鼠具有明显的神经传递障碍的特性。而使用交变电磁辐照后,db/db 小鼠SNCV 的降低得到了显著改善,且这一效果在交变电磁辐照的早期表现得十分明显,而上述变化趋势也与足底机械痛阈值和热痛阈值的变化趋势类似。本研究结果也提示SNCV是反映交变电磁辐照改善2 型糖尿病神经病理性疼痛的一项重要指标。
2 型糖尿病神经病理性疼痛的发生、发展与持续性的炎症反应密切相关,而IL-1β 是这其中最重要的促炎性细胞介质,也被认为是2 型糖尿病神经病理性疼痛的重要标志性细胞因子[18-19]。本研究发现,db/db 小鼠脊髓中IL-1β 的基因表达含量显著高于wild-type 组小鼠,这与前人的研究结果一致[20],进一步证实了2 型糖尿病会诱导机体处于高炎性反应状态。本研究结果表明,4 周的全身交变电磁辐照能够显著降低db/db 小鼠脊髓中IL-1β 的表达,降低至接近wild-type 组的水平(与wild-type 组无统计学差异),提示交变电磁辐照对2 型糖尿病神经病理性疼痛相关的炎性反应具有显著的抑制效应。
2 型糖尿病神经病理性疼痛会伴随有诸多分子信号通路的激活,而近年来学者们的研究发现与糖尿病神经病理性疼痛相关的多条信号通路会汇集于p38 MAPK 分子[21-22]。p38 MAPK 在激活神经胶质细胞、痛觉信号转导以及神经元可塑性变化中发挥重要作用,而对于p38 MAPK 高选择性靶向药物也是有前景的糖尿病神经病理性疼痛的潜在治疗方式[23]。本研究同样发现,db/db 小鼠脊髓中p38 MAPK 的基因表达显著高于wild-type 组小鼠,进一步证实了p38 MAPK 参与2 型糖尿病db/db 小鼠的神经病理性疼痛进程。而全身交变电磁辐照能够显著抑制脊髓p38 MAPK 的表达,提示交变电磁辐照对抗2 型糖尿病神经病理性疼痛的潜在机制与其抑制p38 MAPK的表达有关。
本研究探究了4 周的全身交变电磁辐照对2 型糖尿病db/db 小鼠神经病理性疼痛的治疗效果,明确了该方法能够有效抑制2 型糖尿病db/db 小鼠的神经病理性疼痛症状,并初步探索了该作用的潜在机制,有望为临床对抗2 型糖尿病神经病理性疼痛提供新的治疗策略。本研究的不足之处在于只从基因水平对脊髓重要细胞因子表达进行了定量分析,而未从蛋白的水平对脊髓重要细胞因子表达进行定量。在后续研究中,将通过在体基因沉默技术以及转基因小鼠模型进一步阐明电磁辐照对2 型糖尿病神经病理性疼痛治疗的潜在机制。

