应用DNA提取改良和二次聚合酶链反应技术检测乌头及其炮制品
朱高倩, 李双良, 马莉, 周培军, 蒲星宇, 王丽, 符德欢
(1.云南省药物研究所,云南昆明 650111;2.云南白药集团创新研发中心,云南昆明 650111;3.云南省中药和民族药新药创制企业重点实验室,云南昆明 650111)
乌头类药物有较为悠久的传统用药历史,具有祛风除湿、温经止痛等功效,广泛应用于风湿麻痹、关节疼痛等临床治疗中,在各类成药制剂、药材标准中占比较大[1]。该类药材均来自毛茛科(Ranunculaceae)乌头属(Aconitum)植物根茎。乌头属种类繁多,分布广泛,全球约有350种,我国约有167 种[2],仅云南省境内就有约66 种,25 变种,4 变型[3]。《中华人民共和国药典》2000 年版、2005 年版、2010 年版、2015 年版等标准均有记载乌头类药材[4-7]。《中华本草》记载了60多种乌头属植物可入药[8]。目前,《云南省中药材标准》收载的乌头类药材仅有黄草乌一种[9],但当地民间还将乌头属其他种也当作乌头类药材使用。目前,有些非国标或非省标的乌头属植物被盲目栽培,市场上充当国标或省标药材销售,难以通过产地判断乌头属药材的基原,市场上充斥了大量以国标或省标正品名销售的混伪品,加之乌头属种间的化学成分种类、含量可能会存在差异[10-12],炮制前混杂的品种经过统一的炮制方法炮制后,导致有效成分(或有毒成分)含量可能不在预期范围内,进而导致入药后无效、低效或中毒。
目前,对于乌头属药材的鉴别,单纯通过性状、显微、理化等方法已不能满足市场药材种源鉴定的需求,研究发现,ITS、psbA-trnH 对乌头属植物具有一定的鉴别能力[13-14]。2015 年版《中华人民共和国药典》首次收载了“中药材DNA 条形码分子鉴定法指导原则”,植物类中药材选用ITS2/ITS 为主体序列,以叶绿体psbA-trnH 为辅助序列[7]。而DNA 条形码技术的应用成功与否取决于DNA 的成功提取和PCR 的成功扩增。乌头作为重要药材,其入药的关键即经过炮制,需“用水浸泡至内无干心,加水煮至取大个切开内无白心”[7],长时间的水煮会使DNA严重降解[15-16],加之乌头药用部位富含淀粉、多糖等成分也会干扰DNA 提取[17],使得乌头属炮制品PCR 扩增难以有效实现,从而影响DNA 条形码技术在乌头药材鉴定的应用。因此,在DNA 提取方面,本研究从细胞裂解阶段和DNA 沉淀阶段入手,基于十六烷基三甲基溴化铵(CTAB)法[18]和十二烷基硫酸钠(SDS)法[19],并参考前人研究所获得的DNA 提取改良方式[17,20],对乌头属药用部位炮制前后DNA 提取方法进行系统分析,从裂解液类型、水浴时间、沉淀方式等方面进行改良比较。在PCR 扩增方面,将应用于临床上提高基因扩增效率的二次PCR 扩增技术[21-22]在炮制品DNA的PCR扩增中进行尝试,旨在探索对乌头属植物炮制前后样品DNA 提取和PCR 扩增适用性较好的方法,以期为产地、市场乌头类药材生品、炮制品的基原检测提供有效的技术支持,现将研究结果报道如下。
1 材料与方法
1.1药材研究材料包括9 种乌头根茎生品和对应的炮制品,其中炮制品参照2015 年版《中华人民共和国药典》“制川乌”【制法】进行炮制,凭证标本由中国科学院华南植物园杨亲二研究员鉴定,标本保存于云南省药物研究所标本馆中。具体采集信息见表1。
1.2试剂CTAB 缓冲液(含1.4 mol/L NaCl):100 mmol/L Tris-HCl(pH8.0)、1.4 mol/L NaCl、20 mmol/L EDTA(pH8.0)、2%CTAB;CTAB缓冲液(含2.5 mol/L NaCl):100 mmol/L Tris-HCl(pH8.0)、2.5 mol/L NaCl、20 mmol/L EDTA(pH8.0)、2%CTAB;1%SDS:100 mmol/L Tris-HCl(pH8.0)、10 mmol/L EDTA(pH8.0)、0.1 mol/L NaCl、1%SDS;植物基因组DNA 快速抽提试剂盒(上海生工公司,产品编号:B518231);异丙醇、2 mol/L 醋酸 铵(NH4Ac)、无 水 乙 醇、1×TAE 缓 冲 液、BIOWEST G-10琼脂糖、花青素核酸染料均购自上海生工公司;2×Es TaqMasterMix(Dye)购自康为世纪公司。
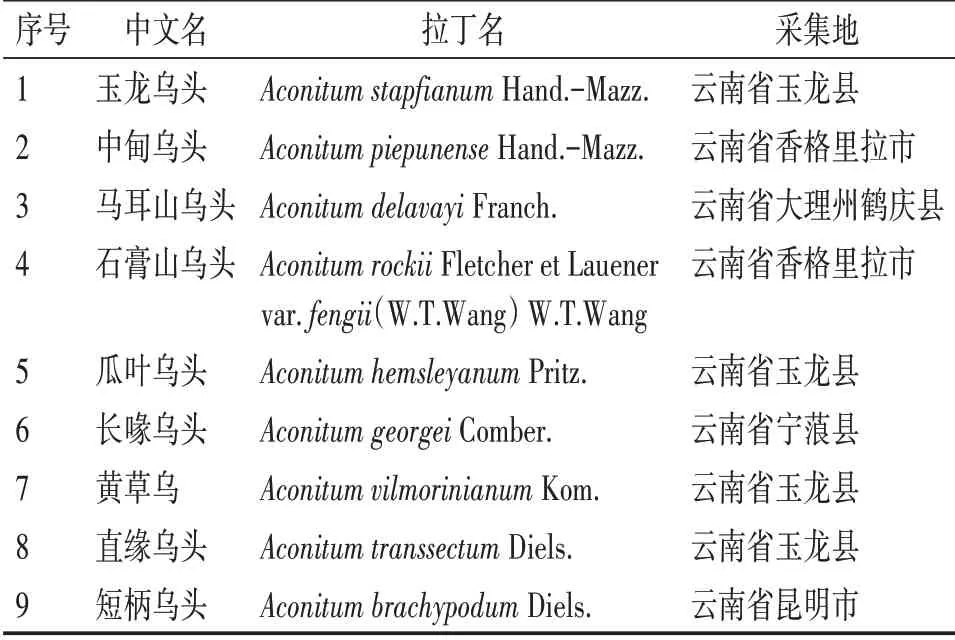
表1 9种乌头属植物采集信息表Table 1 Collection information of 9 kinds of Aconitum plants
1.3仪器EYELA NTT-2000 水浴锅;Eppendorf Mastercycler PCR 扩增仪;北京六一DYY-6C 型电泳仪;Eppendorf Centrifuge 5418 离心机;ZF-258全自动凝胶成像分析系统。
1.4实验方法
1.4.1 实验设计 采用基于CTAB 法[18]和SDS 法[19]的12 种改良方法对9 种乌头生品和炮制品进行DNA提取,方案设计见表2。
1.4.2 DNA 提取 ①将9 种乌头根茎生品或炮制品研磨成细粉,取20 mg 左右样品进行提取。②加入表2 中1 ~12 的提取缓冲液1 mL,添加(+)或不添加(-)聚乙烯吡咯烷酮(PVP40)至终浓度1%,65 ℃水浴1 h 或3 h。③以12 000 × g 离心5 min,取上清液,加入等体积氯仿∶异戊醇(24∶1)重复4 次,以8 000×g 离心10 min。④取上清液,加入等体积异丙醇或5倍体积无水乙醇+1倍体积2 mol/L NH4Ac,颠倒混匀。⑤于4 ℃或-20 ℃过夜沉降反应。⑥以13 000×g 离心15 min。⑦沉淀干燥后加入100 μL ddH2O溶解备用。
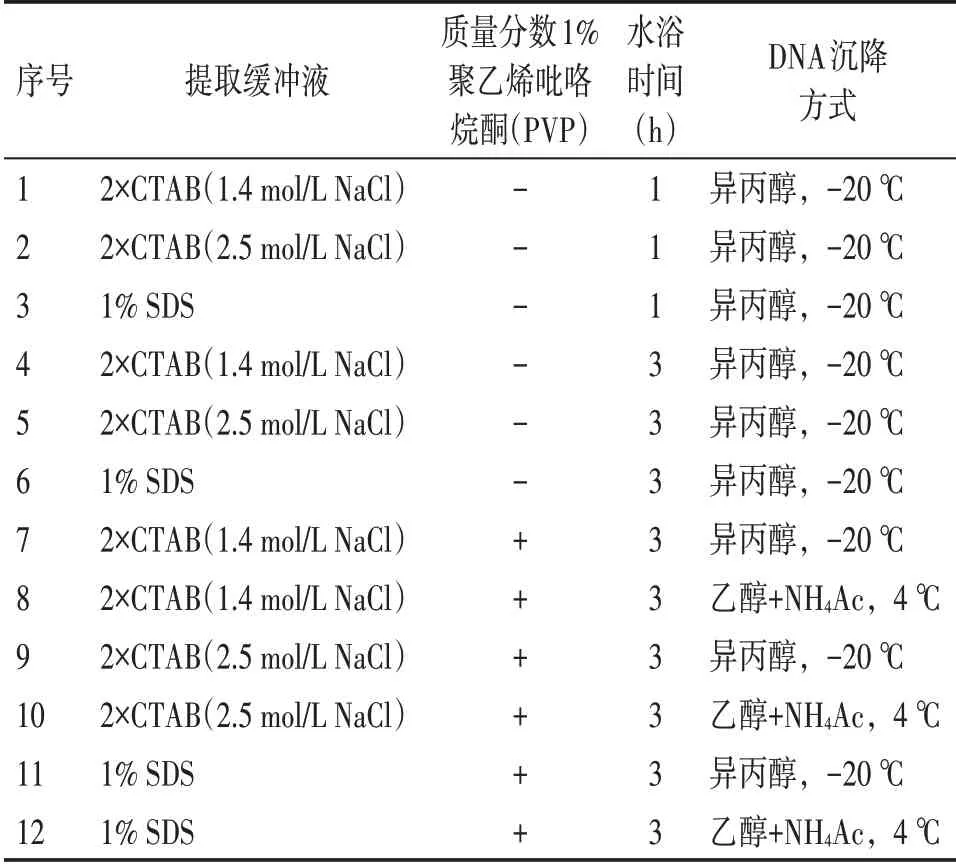
表2 乌头生品和炮制品DNA提取的12种方法方案设计Table 2 Designs for 12 kinds of methods for extracting DNA from crude and preparing products of Aconitum
1.4.3 PCR 扩 增 提 取 的DNA 用ITS2F/ITS2R 进行PCR 扩增检测。正向引物ITS2F: 5’-ATGCGA TACTTGGTGTGAAT-3’;反向引物ITS2R:5’-G ACGCTTCTCCAGACTACAAT-3’。引物由上海生工合成。PCR 反应体系为20 μL,包括ITS2F 0.1 μL、ITS2R 0.1 μL、2×Es TaqMasterMix(Dye)(康为世纪公司)10 μL、ddH2O 8.8 μL、DNA 模板1 μL。在Eppendorf Mastercycler PCR 仪上设定程序:94 ℃预变性5 min,35 个循环(循环条件为94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸40 s),72 ℃终延伸10 min。PCR 完成后,制作1.5%琼脂糖凝胶,取5 μL PCR 产物进行琼脂糖凝胶电泳分离,紫外灯检测。二次PCR 是将上述PCR 反应体系中的DNA 模板更换为第一次PCR 产物以相同的PCR反应条件进行第二次PCR即可。
1.4.4 改良方法的比较 以试剂盒(上海生工公司,产品编号:B518231)提取DNA 的PCR 扩增产物琼脂糖凝胶电泳检测结果作为参照,比较12 种改良方法提取DNA的PCR扩增效果的优劣。
2 结果与分析

图1 不同缓冲液与水浴时间互作提取DNA比较Figure 1 Comparion of DNA extraction using interactions of various extraction buffers with different water-bath time
2.1不同缓冲液与水浴时间互作对DNA提取的影响具体结果见图1。利用2×CTAB(含1.4 mol/L或2.5 mol/L NaCl)、1%SDS、生工试剂盒等4种缓冲液对9 种乌头属植物根茎生品和炮制品DNA 进行提取(异丙醇沉淀DNA),提取的DNA 利用ITS2F/ITS2R 进行PCR 扩增,琼脂糖凝胶检测,以试剂盒的提取效果为对照(见图1-A)。结果表明:不同缓冲液与水浴时间互作效应不同,2×CTAB(含1.4 mol/L 或2.5 mol/L NaCl)水浴1 h 或3 h、1%SDS 水浴1 h提取的生品DNA均可成功扩增ITS2片段,其中2×CTAB(含2.5 mol/L NaCl)水浴3 h 提取的9 种乌头生品DNA 的ITS2 扩增效果最佳,见图1-B~F;1%SDS水浴1 h、2×CTAB(含2.5 mol/L NaCl)水浴1 h、2×CTAB(含1.4 mol/L 或2.5 mol/L NaCl)水浴3 h提取的炮制品DNA均可扩增浓度相对较低的ITS2 片段,其中,2×CTAB(含1.4 mol/L NaCl)水浴3 h 提取的9 种乌头生品DNA 的ITS2 扩增效果最佳,见图1-C~F。
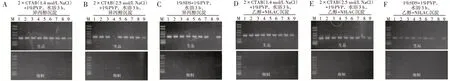
图2 PVP和DNA沉降方式对乌头生品和炮制品DNA提取的影响Figure 2 Effects of PVP and DNA sedimentation modes on DNA extraction from crude and preparing products of Aconitum
2.2 1%PVP对DNA提取的影响在2×CTAB(含1.4 mol/L 或2.5 mol/L NaCl)、1%SDS缓冲液中添加1%PVP,对9 种乌头属植物根茎生品和炮制品DNA进行提取,提取的DNA利用ITS2F/ITS2R进行PCR 扩增,琼脂糖凝胶电泳检测。结果表明,添加PVP 对生品DNA 提取影响不大,但对炮制品有明显的抑制作用。其中,添加PVP后提取的8~9种乌头生品DNA 均能成功扩增ITS2 片段,而乌头炮制品均未检测到明显的ITS2片段。见图2-A~C。
2.3 1%PVP和DNA沉降方式互作对DNA提取的影响在2×CTAB(含1.4 mol/L 或2.5 mol/L NaCl)、1%SDS 缓冲液中添加1%PVP 对9 种乌头属植物根茎生品和炮制品DNA 进行提取,乙醇+NH4Ac 沉降DNA,提取的DNA 利用ITS2F/ITS2R 进行PCR 扩增,琼脂糖凝胶电泳检测。结果表明,添加1%PVP+乙醇+NH4Ac 沉降DNA 对生品DNA 提取影响不大,但对炮制品有明显的抑制作用。其中,添加1%PVP 且进行乙醇+NH4Ac 沉降DNA 后,提取的8 ~9 种乌头生品DNA 均能成功扩增ITS2 片段,而乌头炮制品均未检测到明显的ITS2 片段。见图2-D ~F。
2.4乌头炮制品的ITS2片段二次PCR 对上述12 种方法提取的炮制品DNA 用ITS2F/ITS2R 进行一次PCR 后,以PCR 产物为模板进行ITS2 位点的二次PCR,琼脂糖凝胶电泳检测。结果表明,除了2×CTAB(含1.4 mol/L NaCl)水浴1 h 和1%SDS 水浴3 h+异丙醇沉淀方法,生工试剂盒和其他10 种方法提取的乌头炮制品DNA 均可通过二次PCR 显著提高ITS2扩增产物浓度。见图3。
3 讨论

图3 乌头炮制品的ITS2片段二次PCRFigure 3 Two-time PCR for ITS2 fragments in preparing products of Aconitum
3.1乌头生品和炮制品DNA提取方法改良DNA提取为乌头药材分子鉴定的第一步,其成功与否直接决定了后续的鉴定程序能否正常进行。在乌头药材产地、市场或企业多以经过长时间蒸煮后的乌头炮制品入药,这类材料的DNA 提取难度远大于叶片或干燥生药。本研究采用基于CTAB 和SDS 的改良方法对9 种乌头的生品和炮制品的DNA提取进行了较为系统的研究。结果表明,不同水浴时间与不同缓冲液结合对提取乌头生品和炮制品DNA 有较大影响,筛选出2×CTAB(含2.5 mol/L NaCl)水浴3 h 提取乌头生品DNA 的ITS2 片段扩增效果最好,而2×CTAB(含1.4 mol/L NaCl)水浴3 h提取乌头炮制品DNA 的ITS2 片段扩增效果相对较好。该结果与崔红光等[17]观点一致。本研究中的生品和炮制品也需要CTAB 法结合较长时间水浴来提高DNA 得率,这与乌头药材本身特性有关。作为根茎类药材,富含纤维、淀粉等物质,适当延长水浴时间可使其组织、细胞得到充分裂解,从而释放核酸。而乌头生品和炮制品对CTAB 缓冲液中NaCl 浓度的反应不同,NaCl 浓度为1.4 mol/L 时更适于提取乌头炮制品DNA,而升高至2.5 mol/L 时适合乌头生品。在药材DNA 提取中高盐溶液的应用是为了去除其中的淀粉、多糖等物质[17,23],本研究结果进而间接说明乌头生品经过蒸煮后,除了次生代谢产物(生物碱或非生物碱成分)均有了较大的变化[24-25],其结构物质如淀粉、多糖类等物质也发生了变化。另外,添加1% PVP 或者添加1%PVP 并改变DNA 沉降方式对乌头生品和炮制品DNA 提取有不同程度的抑制作用。前人在DNA 提取过程中添加PVP 浓度各有不同,如在提取富含多酚、多糖等次生物质的药用植物新鲜叶片使用1% PVP 结合0.2% β-巯基乙醇可有效去除杂质和防止DNA 降解[26],而在提取升麻、楤木、木香、乌药、芍药和木通等根茎类药材DNA 时则在2%CTAB中加入PVP至终浓度6%[27]。本研究结果显示1% PVP 产生了抑制作用,说明1% PVP 可能不适合提取乌头生品和炮制品DNA。虽然前人使用乙醇+NH4Ac 可抑制小片段和低浓度的DNA 分子在延长的低温保存中形成盐沉淀物[28],但在本研究中未显现出乙醇沉降的优势,原因可能在于1%PVP 的不当比例影响了乙醇沉降的作用。
3.2二次PCR提高乌头炮制品DNA扩增敏感性本研究中乌头炮制品提取的DNA 扩增结果均不理想,即使是相对较好的方法[2×CTAB(含1.4 mol/L NaCl)水浴3 h]提取的炮制品DNA 扩增的ITS2 片段浓度与生品比较还是较低的。若要进行后续的测序等反应,浓度一定是达不到的。目前,二次PCR 多用于临床检测扩增量少的标本或是极微量DNA 标本供后续SSCP 和DNA 测序分析,或是加工食品中成分的核酸检测,此方法的敏感性明显高于一次PCR[22,29-31];但二次PCR 在药材物种鉴定中还尚未见有报道。本研究中的乌头炮制品是由生品经过长时间蒸煮获得的,其中的DNA 降解程度远超干燥生品,本研究通过二次PCR 可以明显提高乌头炮制品DNA 扩增量,减少DNA 中杂质对PCR 的影响,使其后续的测序等试验得以顺利进行。

