肾气丸对膝骨性关节炎模型大鼠炎症因子和软骨基质的影响
李梓灏, 黄刚, 严伟健, 胡赢, 谢家豪
(1.广州中医药大学第二临床医学院,广东广州 510006;2.南方医科大学中西医结合医院,广东广州 510000)
膝骨性关节炎(knee osteoarthritis,KOA)是一种以膝关节软骨基质降解、软骨退变、滑膜无菌性炎症以及继发骨赘形成为主要特征的慢性退行性病变[1],主要表现为膝关节疼痛、肿胀畸形、活动受限,是中老年人群除心脑血管疾病以外致残的最主要原因[2]。调查显示,我国中老年人群KOA的发病率为12%~15%,女性高于男性[3]。随着我国步入老龄化社会,KOA 的发病率和致残率呈现直线上升的趋势,不仅影响患者的生活质量,也对家庭和社会造成严重的负担。研究发现,肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、白细胞介素9(IL-9)、基质金属蛋白酶3(MMP-3)、基质金属蛋白酶9(MMP-9)、Ⅱ型胶原、雌二醇(E2)在KOA 的发生、发展中起到至关重要的作用[4-7]。中医学认为KOA 的核心病机是肝肾亏虚。肾气丸出自《金匮要略》,具有补益肝肾的功效,本团队临床应用肾气丸治疗KOA 患者,发现其可降低患者血清炎症因子水平,改善膝关节功能,缓解膝关节疼痛,增加膝关节活动度,提高生活质量,但其具体机制尚不明确。因此,本研究建立了KOA 大鼠模型,观察肾气丸对KOA 大鼠膝关节宽度、膝关节被动活动度、滑膜厚度、压痛阈值、热痛阈值和关节软骨中的TNF-α、IL-1β、IL-9、MMP-3、MMP-9、Ⅱ型胶原、E2 的影响,以期阐明肾气丸防治KOA 的作用和机制,现将研究结果报道如下。
1 材料与方法
1.1实验动物清洁级健康SD 大鼠40 只,体质量(210±10)g,由广东省医学实验动物中心提供,动物质量合格证号:SCXK(粤)2018-0002。本实验于广东省中医院中医药科学院动物实验中心进行,饲养环境:温度20 ~25 ℃,湿度40%~60%,光照周期12 h/12 h。
1.2试剂与仪器木瓜蛋白酶(上海源叶生物科技有效公司);TNF-α 酶联免疫吸附分析(ELISA)试剂盒(美国GeneTex 公司);IL-1β、IL-9 ELISA试剂盒(武汉贝茵莱生物科技有限公司);MMP-3、MMP-9 ELISA 试剂盒(美国ScienCell 研究实验室);Ⅱ型胶原ELISA 试剂盒(武汉伊莱瑞特生物科技股份有限公司);E2 ELISA 试剂盒(上海歌凡生物科技有限公司)。爪触觉测试仪(意大利Ugo Basile 公司);YLS-3E 型电子压痛仪(上海软隆科技发展有限公司);BW-Plantar390 足底热测痛仪(上海软隆科技发展有限公司);Multiskan Sky 全波长酶标仪(美国Thermo Fisher Scientific 公司);关节测量尺、游标尺(上海益联医学仪器发展有限公司);ESJ30-5A/B 电子天平(沈阳神宇龙腾天平有限公司)。
1. 3肾气丸组成及制备肾气丸由熟地黄15 g、山药30 g、山茱萸15 g、泽泻10 g、茯苓10 g、牡丹皮10 g、桂枝10 g、熟附子10 g组成。上述中药饮片由广州中医药大学第二附属医院中药房提供,加4 倍量的水分别煎煮2 次,滤渣取液,2 次药液混合后浓缩至含生药0.23 g·mL-1,于4 ℃冰箱保存备用。
1.4动物分组、造模和给药40只大鼠适应性喂养1周后,按照随机数表随机分为正常组(10只)和造模组(30 只)。造模组大鼠参照Panicker 等[8]的方法建立KOA 模型:将大鼠腹腔注射水合氯醛麻醉后,固定于手术台上,双膝关节腔内注射40 g/L木瓜蛋白酶溶液0.2 mL,每2 d 1 次,共注射2 周。正常组大鼠仅对膝关节腔注射生理盐水。造模期间均自由饮食和饮水。2周后,进行膝关节X线片检查,若X 线片可见膝关节胫骨平台骨面欠光滑、不平整,且关节间隙狭窄,则提示造模成功。结果显示造模组36 只大鼠造模成功。随后将造模成功的大鼠随机分为模型组(9 只)、中药组(9只)、西药组(9只)。参照剂量-体表面积换算方法,中药组给予肾气丸11.55 g·kg-1·d-1灌胃,分2 次进行,西药组给予氨基葡萄糖生理盐水溶液157.5 g·kg-1·d-1灌胃,分2 次进行,正常组和模型组给予等体积(3 mL)的生理盐水灌胃,灌胃时间为8周。
1.5观察指标与方法
1.5.1 测量膝关节厚度、被动活动度 末次给药禁食禁饮12 h 后,用游标尺测量大鼠膝关节宽度,用关节测量尺测量膝关节的最大屈曲角度和最大伸直角度,计算被动关节活动度,被动关节活动度=最大屈曲角度-最大伸直角度。
1.5.2 测量膝关节滑膜厚度 麻醉处死大鼠后,打开膝关节腔取关节滑膜组织,用螺旋测微器测量膝关节滑膜厚度。
1.5.3 测定压痛阈值、热痛阈值 将大鼠固定于手术台上,压痛仪的扁形头压大鼠的患侧足背,当大鼠挣扎时即为压痛阈值。将热痛仪置于大鼠的足底中央,打开计时器计时,当大鼠挣扎抬腿时所用的时间即为热痛阈值。
1. 5. 4 检测关节液中TNF-α、IL-1β、IL-9、MMP-3、MMP-9、Ⅱ型胶原、E2水平 常规消毒膝关节后,用5 mL 注射液抽取1.5 mL 生理盐水注射进大鼠的膝关节腔,反复活动膝关节20 次,缓慢抽取膝关节液,离心后取上清液,于-20 ℃保存备用。按照说明书采用ELISA 法检测关节液TNF-α、IL-1β、IL-9、MMP-3、MMP-9、Ⅱ型胶原、E2的含量。
1.6统计方法采用SPSS 21.0统计软件进行数据分析,计量资料以均数±标准差(x±s)表示,多组比较采用单因素方差分析,进一步两两比较采用LSD检验,以P<0.05为差异有统计学意义。
2 结果
2. 1正常组和造模组大鼠膝关节X线检查结果比较图1结果显示:正常组膝关节关节软骨厚度正常,关节间隙无狭窄;模型组膝关节间隙明显变窄,关节软骨变薄,轻度骨刺,关节面硬化。提示造模成功。
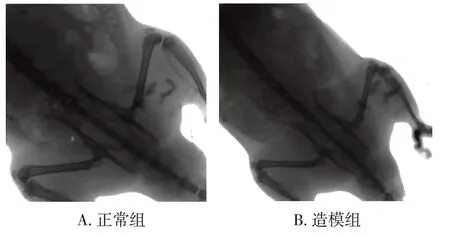
图1 正常组和KOA造模组大鼠膝关节X线检查结果比较Figure 1 Comparison of X-ray examination results in the control group and KOA modeling group
2.2各组大鼠膝关节厚度、关节被动活动度、滑膜厚度的比较表1结果显示:与正常组比较,模型组大鼠的膝关节厚度、滑膜厚度显著增加(P<0.05),关节被动活动度显著减小(P<0.05);与模型组比较,中药组、西药组大鼠的膝关节厚度、滑膜厚度均显著减小(P<0.05),关节被动活动度均显著增加(P< 0.05),且2 个治疗组之间比较,差异无统计学意义(P>0.05)。
表1 各组大鼠膝关节厚度、关节被动活动度、滑膜厚度的比较Table 1 Comparison of the knee joint space width,passive knee joint range of motion,thickness of synovial membrane in various groups (±s)
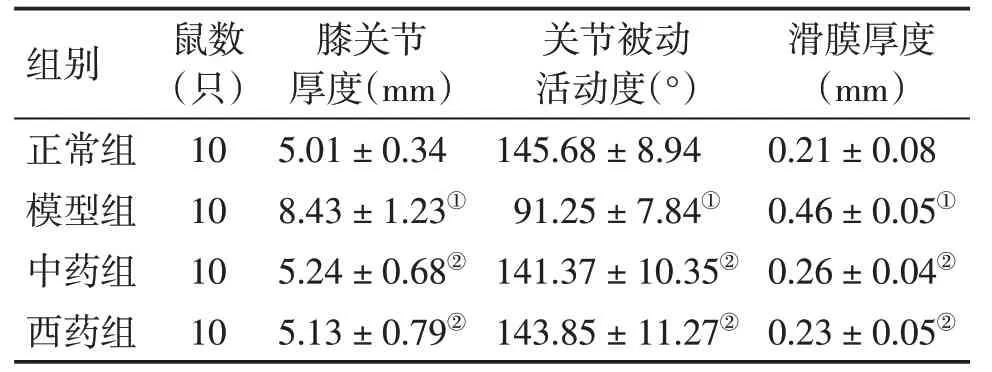
表1 各组大鼠膝关节厚度、关节被动活动度、滑膜厚度的比较Table 1 Comparison of the knee joint space width,passive knee joint range of motion,thickness of synovial membrane in various groups (±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较
?
2.3各组大鼠压痛阈值、热痛阈值的比较表2结果显示:与正常组比较,模型组大鼠的压痛阈值、热痛阈值降低(P<0.05);与模型组比较,中药组、西药组大鼠的压痛阈值、热痛阈值显著升高(P<0.05),且2 个治疗组之间比较,差异无统计学意义(P>0.05)。
2.4各组大鼠关节液TNF-α、IL-1β、IL-9含量的比较表3结果显示:与正常组比较,模型组大鼠的关节液TNF-α、IL-1β、IL-9 含量显著升高(P<0.05);与模型组比较,中药组、西药组大鼠的关节液TNF-α、IL-1β、IL-9含量显著降低(P<0.05),且2 个治疗组之间比较,差异无统计学意义(P>0.05)。
表2 各组大鼠压痛阈值、热痛阈值的比较Table 2 Comparison of the tenderness threshold and thermal pain threshold in various groups (±s)

表2 各组大鼠压痛阈值、热痛阈值的比较Table 2 Comparison of the tenderness threshold and thermal pain threshold in various groups (±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较
?
表3 各组大鼠关节液TNF-α、IL-1β、IL-9含量比较Table 3 Comparison of the contents of TNF-α,IL-1β and IL-9 in synovial fluid of various groups (±s,pg·mL-1)

表3 各组大鼠关节液TNF-α、IL-1β、IL-9含量比较Table 3 Comparison of the contents of TNF-α,IL-1β and IL-9 in synovial fluid of various groups (±s,pg·mL-1)
①P<0.05,与正常组比较;②P<0.05,与模型组比较
?
2.5各组大鼠关节液MMP-3、MMP-9、Ⅱ型胶原、E2含量的比较表4 结果显示:与正常组比较,模型组大鼠的关节液MMP-3、MMP-9含量显著升高(P< 0.05),Ⅱ型胶原、E2 含量显著降低(P<0.05);对模型组比较,中药组、西药组大鼠的关节液MMP-3、MMP-9 含量显著降低(P< 0.05),Ⅱ型胶原、E2 含量显著升高(P<0.05),且2 个治疗组之间比较,差异无统计学意义(P>0.05)。
3 讨论
膝骨性关节炎(KOA)的主要病理机制是膝关节软骨的退行性病变,多种因素均通过破坏关节软骨引起KOA。
炎症反应、软骨基质在KOA 中起到重要的作用。KOA 是一种无菌性炎症,以TNF-α、IL-1β、IL-9 升高为主要表现。TNF-α 可以促进软骨细胞凋亡,促进Ⅱ型胶原和蛋白聚糖的降解,破坏软骨细胞,导致骨赘形成[9]。IL-1β 由软骨细胞、滑膜细胞、巨噬细胞等分泌生成,可以促进滑膜细胞的增殖和分化,促进软骨细胞凋亡,促进Ⅱ型胶原蛋白合成和强度下降,促进滑膜细胞和软骨细胞生成前列腺素E2 和胶原酶,引起滑膜炎症和软骨基质降解。研究[10]发现,KOA患者血清或关节液中IL-1β的表达较正常人群显著升高。IL-9主要由单核细胞分泌,可以引起软骨细胞死亡和软骨细胞外基质的降解。研究[11]发现,KOA患者血清中的TNF-α、IL-1β、IL-9水平较正常健康者显著升高,提示炎症因子是引起KOA 的重要危险因素。Ⅱ型胶原是软骨细胞外基质的主要成分,KOA 患者中Ⅱ型胶原降解增多,而合成减少,导致软骨基质破坏。基质金属蛋白酶(MMPs)可以促进软骨基质降解、抑制蛋白聚糖和Ⅱ型胶原蛋白的合成,导致软骨细胞变性和软骨缺损。MMP-3 和MMP-9 是MMPs 的主要成员,主要在KOA 患者的滑膜细胞中表达,是引起KOA 的重要原因之一。研究发现,MMP-3 和MMP-9 在KOA 患者软骨组织中高度表达,而Ⅱ型胶原表达显著减少[12],提示MMP-3和MMP-9可引起软骨细胞外基质的主要成分Ⅱ型胶原蛋白和蛋白多糖降解,导致关节软骨破坏、退变。E2 可以促进成骨细胞增殖分化,促进Ⅱ型胶原和蛋白聚糖的合成,保护软骨细胞外基质,对膝关节具有重要的保护作用[13]。
KOA属于中医学“痹症”“骨痹”的范畴。中医学认为“肾主骨生髓”“肝主筋,为罢极之本”“肾之和,骨也”“膝为筋之府”。KOA的核心基础为年老体虚、肝肾亏虚[14]。人至中老年,肝肾逐渐亏虚,肾虚不能主骨生髓,骨不得肾阴滋养,引起骨质脆弱而无法生长,肝主筋,肝血亏虚,不能濡养筋脉,不荣则痛。正气亏虚于内,风寒湿邪侵袭,或瘀血内生,痹阻筋脉,是本病发作的重要诱因。寒湿内侵或瘀血内生而痹阻筋脉,引起关节肿胀畸形,这与TNF-α、IL-1β、IL-9 等引起关节软骨膝关节骨赘形成,关节腔间隙狭窄的病理表现不谋而合。“肝主筋脉”“肾主骨”,KOA患者肝肾亏虚,无以濡养筋脉,与膝关节液Ⅱ型胶原蛋白、E2水平降低和MMP-3、MMP-9导致软骨基质破坏、降解不谋而合。因此,TNF-α、IL-1β、IL-9、MMP-3 和MMP-9 在一定程度上代表了KOA的致病因子,Ⅱ型胶原蛋白和E2在一定程度上反映了KOA患者的正气和肝肾功能的强弱。
治病必求于本,因此,KOA 治疗主要在于补益肝肾以强筋骨,正所谓“正气存内,邪不可干”。肾气丸为补益肝肾的经典名方,方中:附子大辛大热,温阳助火,桂枝辛温,补肾阳,主气化,通血脉,附子和桂枝合用,寓阳中求阴之意;熟地黄滋阴补肾生精,山药养脾生精,吴茱萸助阳生精,熟地黄、山药、吴茱萸重用以滋补肝肾阴精;泽泻、茯苓淡渗利湿,牡丹皮活血化瘀,合桂枝可温通血脉。诸药合用,共奏补益肝肾,兼活血化瘀、淡渗利湿之功。本研究结果显示:与正常组比较,模型组大鼠的膝关节宽度和滑膜厚度增加,膝关节被动活动度、压痛阈值、热痛阈值减小,关节液中的TNF-α、IL-1β、IL-9、MMP-3、MMP-9含量升高,Ⅱ型胶原、E2含量降低;与模型组比较,中药组大鼠的膝关节宽度和滑膜厚度减小,膝关节被动活动度、压痛阈值、热痛阈值增加,关节液中的TNF-α、IL-1β、IL-9、MMP-3、MMP-9含量降低,Ⅱ型胶原、E2含量升高。表明肾气丸可以缓解KOA 疼痛,减轻关节内炎症反应,抑制骨质增生,抑制软骨基质的降解。
综上所述,肾气丸可以通过抑制关节内炎症反应,抑制关节软骨基质降解有效减轻KOA 大鼠软骨损伤,改善膝关节功能。
表4 各组大鼠关节液MMP-3、MMP-9、Ⅱ型胶原、E2含量的比较Table 4 Comparison of the contents of MMP-3,MMP-9,typeⅡcollagen,E2 in synovial fluid of various groups(±s)

表4 各组大鼠关节液MMP-3、MMP-9、Ⅱ型胶原、E2含量的比较Table 4 Comparison of the contents of MMP-3,MMP-9,typeⅡcollagen,E2 in synovial fluid of various groups(±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较
?

