联合检测血清β2-MG、CEA、CA125、NSE及CYFRA21-1对肺癌早期诊断的价值研究
刘 霞,王 彦,杨伏猛,杨 林,姚 丽,朱文俊 (.连云港市第二人民医院检验科,江苏 连云港 222023)
肺癌是全球发病率和病死率最高的恶性肿瘤之一,约占所有肿瘤的12.4%,且发病率在逐年上升,目前我国肺癌患者人数在逐年增加,已成为国内常见肿瘤[1]。肺癌多采用手术为主的综合治疗方案,但绝大多数肺癌患者就诊时已错过最佳治疗时间,无法进行手术,只能采用以内科药物治疗为主的综合治疗模式,但当前肺癌的总体治疗效果并不理想,其5年生存率仅为8.9%[2-4]。因此,肺癌的早期诊断显得尤为重要,本研究选择检测β2-微球蛋白、癌胚抗原(CEA)、糖类抗原125(CA125)、神经元特异性烯醇化酶(NSE)、血清细胞角蛋白片段(CYRFA21-1)几种血清标志物在肺癌患者中的水平变化并分析其诊断价值,以便于有效地控制病情及判断患者的预后。
1 资料与方法
1.1一般资料:收集2017年5月~2018年5月82例年龄45~76岁,在我院肿瘤内科、放疗科治疗的肺癌初治患者作为肺癌组,所有患者均经细胞学或组织病理学确诊,男女随机抽取。纳入标准:①符合肺癌的临床诊断标准;②未同时患有其他恶性肿瘤疾病。排除标准:①合并严重的心、肝、肾等器质性病变者;②患有严重的精神疾病。告知患者及其家属本研究的目的与方法。同时收集2017年5月~2018年5月来我院体检中心检查血压及各项体检指标、器官正常,无肝功能、肾功能异常的45~76岁健康体检人员82例为健康对照组。所有入选者均签署知情同意书,在医院伦理委员会同意并监督的情况下进行本实验。
1.2方法
1.2.1血浆标本收集:嘱受检者及患者初治或评估前一晚上清淡饮食,次日早晨空腹采取静脉血5 ml(生化黄管),室温放置半小时后3 000 r/min离心10 min分离血清,置标记样品管中,-80 ℃冰冻保存备检。
1.2.2血清β2-MG以及CEA、CA125、NSE、CYFRA21-1的检测:取-80℃冰冻保存备检样品管放置室温30 min解冻,充分混匀,取500 μl于样品杯中,β2-MG采用贝克曼AU5800全自动生化分析仪检测;CEA、CA125肿瘤指标运用AIA2000全自动免疫发光分析仪检测;采用罗氏E602检测CYFRA21-1、NSE。

2 结果
2.1血清β2-MG及肿瘤标志物水平比较:肺癌患者组血清β2-MG、CEA、CA125、NSE、CYFRA21-1水平明显高于健康对照组,差异有统计学意义(P<0.05)。见表1。
2.2不同病理类型β2-MG与肿瘤标志物水平比较:不同病理类型肺癌患者的血清β2-MG、CEA、CA125、NSE、CYFRA21-1水平,其中小细胞肺癌组NSE水平明显高于鳞癌和腺癌组,差异有统计学意义(P<0.05),鳞癌组CYFRA21-1水平明显高于腺癌组,差异有统计学意义(P<0.05),β2-MG、CEA和CA125水平在不同病理类型肺癌患者中差异无统计学意义(P>0.05)。见表 2。
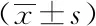
表1 两组血清β2-MG和4种肿瘤标记物水平比较
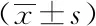
表2 不同病理类型的β2-MG和4种肿瘤标记物水平比较
2.3单一指标及联合检测对肺癌诊断的诊断价值:血清β2-MG、CEA、CA125、NSE及CYFRA21-1指标联合检测的敏感度较CEA、CA125、NSE、CYFRA21-1四种肿瘤指标单独检测均显著升高,差异有统计学意义(P<0.05),特异度高于β2-MG及CEA单独检测,差异有统计学意义(P<0.05)。见表3。
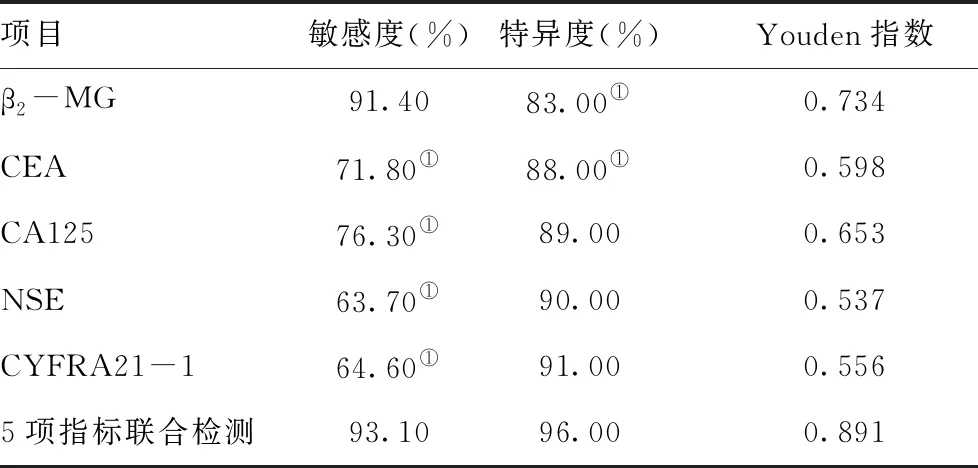
表3 各单一指标及联合检测的敏感度、特异度比较
2.4β2-MG及肿瘤标记物的ROC曲线:β2-MG联合上述几种肿瘤标志物检测的AUC为0.969,CEA的AUC为0.701,CA125的AUC为0.746,β2-MG的AUC为0.947,CYFRA21-1的AUC为0.615,NSE的AUC为0.608,差异均有统计学意义(P<0.05)。见图1。

图1 β2-MG及肿瘤标记物的ROC曲线
3 讨论
肺癌是临床发病率最高的肿瘤之一,具有起病隐匿、病死率高、预后较差等特点,5年生存率为10%左右[5]。2015年,因肺癌死亡的人数占所有死亡人数的5.44%,占所有癌症死亡人数的22.92%,它是所有癌症死亡的主要原因,也是所有疾病中能导致死亡的第三大原因[6]。肺癌具体的发病机制尚不明确,其中已确定的致病因素有吸烟,慢性肺阻塞性疾病和遗传学等[7]。肺癌患者早期无典型临床特征,缺乏有效的早期诊断方法,部分患者确诊后多已处于晚期阶段,并且大多数患者易发生淋巴结或其他器官的转移,手术治疗效果不佳,预后较差。故有效的早期诊断对患者的诊断及预后具有重要意义。
β2-微球蛋白(β2-MG),由管家基因编码的11 KDa非糖基化蛋白,所有的有核细胞均可表达,是细胞表面主要组织相容性复合物(MHC)I类的组分,在宿主对肿瘤的免疫反应中起到重要作用[8-9],健康人体内血清β2-MG水平较低且相对稳定,几乎全部由近曲小管重吸收[10]。β2-MG能够介导肿瘤发生,血管生成,转移和骨模拟[9],有研究发现肿瘤患者合成及分泌β2-MG的速度加快,异常增生的恶性肿瘤会破坏大量细胞导致β2-MG过量释放,肿瘤患者免疫自稳功能下降,激活免疫反应使淋巴细胞活性增加,从而增加β2-MG分泌,另一方面当肿瘤细胞浸润肾小管时,使其对β2-MG滤过减少,这些都表明β2-MG水平升高可提示肿瘤细胞增长过快和疾病的进展[11-14]。有研究表明,可溶性β2-MG的水平在许多肿瘤中都会增加,β2-MG的表达与肿瘤的预后不良成正相关,可以作为某些恶性肿瘤的预后指标[9,15]。 检测血清β2-MG浓度与肺癌患者体内肿瘤细胞克隆数量及其增殖活性密切相关,是早期诊断及判断预后效果的重要指标之一。
肿瘤标志物是由癌细胞合成分泌的一类特异性物质,部分也可见于正常人体内,但含量较低,在肿瘤患者体内明显增高,因此作为临床上常用的肿瘤早期诊断率及预后判断的指标[16-17]。CEA又称癌胚抗原,是一种特异性酸性糖蛋白,其升高可提示多种肿瘤存在,作为一个广谱肿瘤标志物在肺癌的早期诊断中有一定价值[18-19];CA125作为一种卵巢相关抗原,主要在卵巢癌患者中高表达,也见于其他的一些恶性肿瘤——在肺癌患者中也可见明显升高[20-21];NSE是神经元和神经内分泌细胞所特有的一种酸性蛋白酶,主要见于内分泌肿瘤与神经源性肿瘤(小细胞肺癌为神经源性肿瘤),对肺癌的诊断、鉴别诊断及治疗评价具有重要的临床价值[22];CYFRA21-1是细胞角蛋白19片段,由细胞结构中主要成分细胞角蛋白19的两个单克隆抗体组成,在肺癌患者中表达最高,主要存在于肿瘤细胞的胞浆中,当肿瘤细胞发生坏死或分解时会释放入血使血清中的含量增高[21-23]。但上述各指标在临床应用中仍有不足,为了进一步提高肺癌的诊断检出率及预后判断,本研究探讨血清β2-MG及4种肿瘤标记物在肺癌患者体内的表达水平,并分析其联合检测对肺癌的诊断价值。
本研究中肺癌患者血清β2-MG、CEA、CA125、NSE和CYRFA21-1的水平与健康对照组相比明显升高(P<0.05)。其中,不同病理类型患者中各指标比较结果显示:血清β2-MG、CEA及CA125 指标在三种病理类型中表达无明显差异(P>0.05),小细胞肺癌组NSE 水平明显高于鳞癌和腺癌组(P<0.05),鳞癌组的CYRFA21-1 水平显著高于腺癌组(P<0.05)。进一步分析各指标单一诊断及联合诊断的灵敏度和特异度,结果显示:β2-MG在肺癌的早期诊断中具有较高的敏感性(91.4%),但特异性较差(83%);同时多指标联合检测灵敏度较CEA、CA125、NSE和CYRFA21-1单一指标检测显著升高,差异有统计学意义(P<0.05),特异度高于β2-MG及CEA单独检测,差异有统计学意义(P<0.05)。ROC 曲线分析结果显示:β2-MG、CEA、CA125、NSE、CYRFA21-1诊断早期肺癌ROC 曲线下面积分别为0.947、0.701、0.746、0.608、0.615,多指标联合诊断早期肺癌 ROC 曲线下面积为0.969,表明β2-MG与CEA、CA125、NSE、CYRFA21-1联合检测可有效提高对早期肺癌的诊断价值。
肺癌患者血清β2-MG、CEA、CA125、NSE及CYRFA21-1水平均明显升高;血清β2-MG在腺癌,鳞癌,小细胞癌三种病理类型的患者中水平无明显差异;联合检测上述血清指标可提高肺癌患者诊断灵敏度,有效提高患者诊断价值,从而为寻找新的临床诊断及治疗方向提供线索,以便于有效地控制病情及判断患者的预后。

