药食同源新配方液体KH-0004的抗病毒作用和安全性研究
代 岩,景世钰,吴杰军,陈景才*,赵软金*
(1.河南开怀药业有限公司,河南 郑州 450000;2.美国佛罗里达Sarasota中医药中心,河南中医药大学,河南 郑州 450000)
随着社会的发展,越来越多的人意识到不治已病治未病是健康管理之导向。“药食同源”“医食同源”等理念逐渐成为人们信奉的养生信条,并发展成为自成体系的食疗养生文化[1]。植物饮料是指以植物或植物提取物,添加或不添加其他食品原辅料和食品添加剂,经加工或发酵制成的饮料,植物饮料中最具代表性的是凉茶饮料[2]。目前植物功能性饮料还没有统一的定义,这里主要强调的是植物来源的功能性饮料,通常来说,是以含有某种对人体有益的具有特殊功效成分的植物为原料,经过加工、科学配比、专业品评制成的适合大众需要的植物饮料产品[3]。以药食同源为原料制成的产品的一大优势是其既可加工成食品供日常食用,起到食疗的功效,又可以制成药供临床使用。
病毒是一类由核酸(DNA或RNA)与蛋白质构成的非细胞结构微生物。病毒感染是指病毒通过多种途径侵入机体,并在易感的宿主细胞中增殖的过程,其实质是病毒与机体、病毒与易感细胞相互作用的过程。对人体致病病毒能够侵入人体细胞并利用宿主细胞中的酶、细胞器及营养物质结合自身遗传物质达到自我增殖的目的,最终将导致宿主细胞死亡,是一类严重危害人体生命健康的病原体[4]。如传染性极强的艾滋病病毒、埃博拉病毒、SARS病毒[5-6]以及2020年初暴发的病毒性传染病[7-10]等。然而,目前对大多数病毒感染缺乏特效药物治疗。
本研究选用药食同源中药材金银花、菊花、菊苣、蒲公英、代代花、甘草、砂仁、淡竹叶为原料,通过优化的配比及工艺,制备成无菌上清液KH-0004,然后利用体外细胞学实验测试其抗冠状病毒、呼吸道合胞病毒、单纯疱疹病毒、乙型肝炎病毒的活性,并评价其急性经口毒性[11]、遗传毒性[12-14]、28天经口毒性[15]。
1 仪器与试剂
1.1 仪器
电子天平(上海容威仪器有限公司),实验室多功能提取机组(山东精诚医药装备有限公司),超纯水机(四川优普超纯科技有限公司),CO2培养箱(美国Thermo Fisher公司),显微镜(日本Olympus公司),微孔板快速振荡器(江苏省海门市其林贝尔仪器制造有限公司),多标记读板仪(美国Perkin Elmer公司Envision plate reader),荧光定量PCR仪(美国ABI公司),真空泵(美国INTEGRA Biosciences公司),12道移液器,单道移液器(美国Eppendorf公司)。
1.2 试药
雌、雄ICR小鼠:购自浙江省医学科学院实验动物中心。
SPF级SD大鼠:上海杰思捷实验动物有限公司。
组氨酸营养缺陷型鼠伤寒沙门氏菌TA1535,TA97,TA98,TA100和TA102:购自浙江省医学科学院。
HepG2.2.15表达HBV病毒的人肝细胞[16-17]:购自上海复祥生物科技有限公司;Vero细胞,HEp2细胞ATCC CCL-23,人肝癌细胞Huh7细胞:购自美国ATCC。
金银花、菊花、菊苣、蒲公英、代代花、甘草、砂仁、淡竹叶:购自河北省安国市一方药业有限公司。
DMEM/F12,台盼蓝,0.4%(w/v),DMEM:购自美国G i b c o。胎牛血清(F B S):购自法国Biosera。1XDPBS,0.25% Trypsin-EDTA,青霉素-链霉素双抗(100×P/S),非必须氨基酸(NEAA),丙酮酸钠(100mM):购自美国Invitrogen。二甲基亚砜(DMSO),环磷酰胺:购自美国Sigma。CellTiter-Glo Luminescent Cell Viability Assay Kit:购自美国Promega。TB GreenTM Premix Ex TaqTM (TIi RNaseH Plus):购自日本Takara。利巴韦林注射液:购自天津金耀集团湖北天药药业股份有限公司。
2 方法与结果
2.1 KH-0004的制备
称取金银花1~30份、菊花1~30份、蒲公英1~30份、菊苣1~30份、代代花1~30份、甘草1~30份、砂仁1 ~3 0 份、淡竹叶1 ~3 0 份,先将金银花、菊花、蒲公英、菊苣、代代花、甘草、砂仁、淡竹叶混合在一起,加入10~250倍纯净水浸泡30~60 min,然后煮沸25~60 min,待澄清冷却到室温(23±2˚C),过滤、灭菌,即得KH-0004。
2.2 KH-0004抗单纯疱疹病毒(HSV-1, HSV-2)活性检测
2.2.1 细胞毒实验:Vero 细胞用完全培养基DMEM(10% FBS+1% P/S)培养并按1:4维持传代。实验前一天Vero细胞加入96-孔细胞培养板10000细胞/孔。实验当天,弃去细胞培养板里的培养基,加入100 µL/孔配制好的待测样品。加入100 µL/孔含有2% FBS的检测培养基。将细胞培养板放入37˚C,5% CO2,90%湿度的培养箱中培养4天后用CellTiter-Glo Luminescent Cell Viability Assay Kit检测细胞活性[18]。细胞毒实验结果由至半数细胞死亡浓度(CC50)表示,结果见表1。
2.2.2 抗H S V-1 实验:Ve r o 细胞用完全培养基DMEM(10% FBS+1% P/S)培养并按1:4维持传代。实验前一天Vero细胞加入96-孔细胞培养板10000细胞/孔。实验当天,弃去细胞培养板里的培养基,加入100 µL/孔配制好的化合物及待测样品。冰上融化HSV-1病毒储存液,用含有2% FBS的检测培养基配制成大约10000倍的病毒稀释液,充分混匀。细胞检测板每孔加入100 µL病毒稀释液,共200 µL每孔,20000倍的病毒稀释液(MOI=0.004)。HEP(100%作用)加入200 µL每孔检测培养基,不加病毒,ZPE(0%作用)加入20000倍的病毒稀释液200 µL每孔。将细胞培养板放入37˚C,5% CO2,90%湿度的培养箱中培养4天后用CellTiter-Glo Luminescent Cell Viability Assay Kit检测细胞活性。抗病毒实验结果由至半数病毒生长抑制浓度(EC50)表示,结果见表1。结果表明,KH-0004具有较强的抗HSV-1活性,选择指数SI=3.3。
2.2.3 抗HSV-2实验:实验过程同2.2.2抗HSV-1实验步骤,冰上融化HSV-2病毒储存液,用含有2% FBS的检测培养基配制成大约1 0 0 0 倍的病毒稀释液充分混匀,病毒稀释液加入细胞检测板后最终为2 0 0 0 倍稀释(MOI=0.007)。抗病毒实验结果由至半数病毒生长抑制浓度(EC50)表示,结果见表1。结果表明,KH-0004具有很强的抗HSV-2活性,选择指数SI=20。
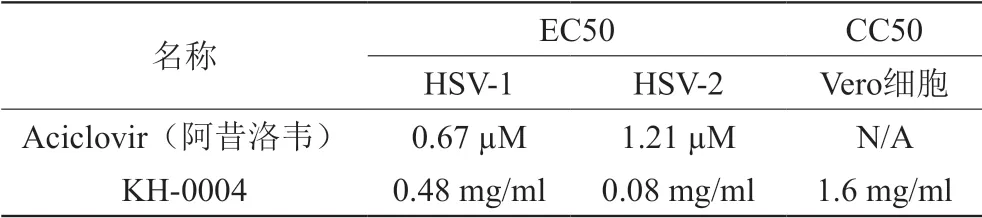
表1 KH-0004抗单纯疱疹病毒实验结果
2.3 KH-0004抗乙型肝炎病毒(HBV)活性检测
2.3.1 细胞毒实验:96孔细胞培养板中铺HepG2.2.15细胞20000个/孔,每孔200 µL细胞培养基。在37℃,5% CO2细胞培养箱中培养3天至细胞长至满孔。在测试第0天,弃去细胞培养板里的培养基加入100 µL/孔配制好的化合物。加入100 µL/孔含有2% FBS的检测培养基,最终200 µL每孔,化合物最高检测浓度2倍稀释。培养基对照孔作为ZPE孔加入200 µL检测培养基。将细胞培养板放入37˚C,5% CO2,90%湿度的培养箱中培养4天后用CellTiter-Glo Luminescent Cell Viability Assay Kit检测细胞活性。细胞毒实验结果由至半数细胞死亡浓度(CC50)表示,结果见表2。
2.3.2 抗乙肝病毒实验:9 6 孔细胞培养板中铺HepG2.2.15细胞20000个/孔,每孔200 µl细胞培养基。在37˚C,5% CO2细胞培养箱中培养3天至细胞长至满孔。在测试第0天,弃去细胞培养板里的培养基加入100 µL/孔配制好的化合物。再加入100 µL每孔含有2% FBS的检测培养基,最终200 µL每孔,化合物最高检测浓度2倍稀释。ZPE(0%作用)孔加入200 µL检测培养基,HPE(100%作用)孔,每孔加入200 µL含有1 µL 0.2 mM的阳性对照化合物的检测培养基。96孔细胞测试板在37˚C CO2培养箱中孵育7天,每隔一天(第2,4,6天)换一次液(2% FBS),并加入新鲜配置的样品。在第7天每孔取150 µL上清作病毒DNA的qPCR检测。结果见表2。结果表明,KH-0004具有较强的抗乙型肝炎病毒活性,选择指数SI=4.95。
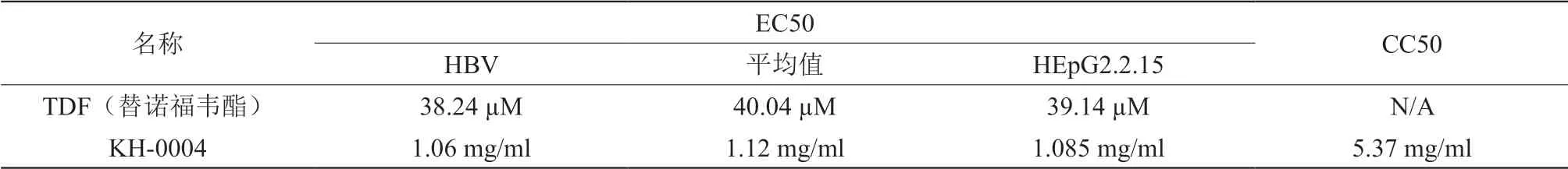
表2 KH-0004抗乙型肝炎病毒实验结果
2.3.3 qPCR方法检测病毒基因组DNA:qPCR引物如表3。按以下成分配制qPCR反应体系:TB Premix Ex TaqTM II(2×)5 µL,HBV-For-202(10 µM)0.4 µL,HBVRev-315(10 µM)0.4 µL,ROX Reference Dye(50×)0.2µL,病毒上清1 µL,加水至10 µL。按以下条件设置ABI ViiA7 qPCR仪:阶段1:Reps:95˚C,30秒,一个循环;阶段2:Reps:95˚C,5秒和60˚C,34秒,40个循环。

表3 HBV引物序列
2.4 KH-0004抗呼吸道合胞病毒(RSV)活性检测
2.4.1 细胞毒实验:HEp2细胞用完全培养基DMEM/F12(10% FBS+1% P/S)培养并按1:4维持传代。实验前一天HEp2细胞加入96-孔细胞培养板5000细胞/孔。实验当天,弃去细胞培养板里的培养基,加入100 µL/孔配制好的化合物。加入100 µL每孔含有2% FBS的检测培养基,最终200µL每孔,化合物最高检测浓度2倍稀释。ZPE孔加入200 µL每孔检测培养基。将细胞培养板放入37˚C,5% CO2,90%湿度的培养箱中培养4天后用Promega CellTiter Cell Viability kit检测细胞活性。细胞毒实验结果由至半数细胞死亡浓度(CC50)表示,结果见表4。
2.4.2 抗呼吸道合胞病毒实验:HEp2细胞用完全培养基DMEM/F12(10% FBS+1% P/S)培养并按1:4维持传代。实验前一天HEp2细胞加入96-孔细胞培养板5000细胞/孔。实验当天,弃去细胞培养板里的培养基,加入100 µL/孔配制好的化合物。冰上融化RSV病毒储存液,用含有2% FBS的检测培养基配制成大约4000倍的病毒稀释液,充分混匀。细胞检测板每孔加入100 µL病毒稀释液,共200 µL每孔,最终病毒稀释8000倍(MOI=0.1)。HEP(100 %作用)加入200µL每孔检测培养基,不加病毒,ZPE(0%作用)加入8000倍的病毒稀释液200 µL每孔。将细胞培养板放入37˚C,5%CO2的培养箱中培养5天后用CellTiter-Glo Luminescent Cell Viability Assay Kit检测细胞活性。抗病毒实验结果由至半数病毒生长抑制浓度(EC50)表示,结果见表4。结果表明,KH-0004具有很强的抗RSV活性,选择指数SI=21.7。

表4 KH-0004抗乙型肝炎病毒实验结果
2.5 KH-0004抗冠状病毒活性检测
实验在传代Huh7细胞中进行,细胞以1.5×104个/孔接种于96孔板中,过夜培养后将100 TCID50 HCoV-229E病毒液感染96孔板内细胞,待测样品用培养液液稀释,于感染同时给药进行测定,待测样品以三倍稀释8个剂量的样品进行实验,每个剂量设2个平行孔,待病毒对照组病变达4+号时观察结果,记录并用Reed-Muench法计算待测样品对病毒的半数抑制浓度及选择指数(SI=EC50/CC50)。结果见表5。结果表明,KH-0004具有一定的抗冠状病毒活性,选择指数SI>1.3。
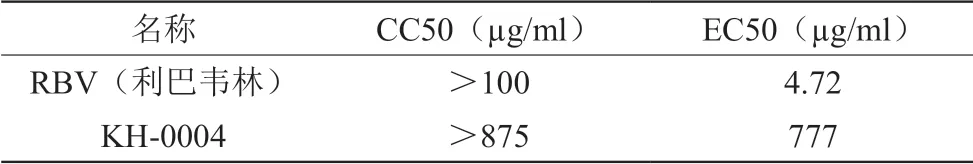
表5 KH-0004抗冠状病毒实验结果
2.6 KH-0004急性经口毒性试验
20只ICR小鼠,雌雄各半,采用最大限量法,灌胃剂量为原液10031.4 mg/kg,试验前禁食4小时,试验开始后,对动物用经口灌胃法一次染毒,染毒后继续禁食1小时,观察并记录染毒存活动物并进行解剖。结果表明,实验动物在染毒14天内未见任何中毒症状和中毒死亡;雌雄动物的平均体重重未见异常。实验观察结束,对受试动物进行大体解剖也未见异常变化。LD50>10031.4 mg/kg。按照《GB15193.3-2014-食品安全国家标准 急性经口毒性试验》标准,该样品对IC小鼠的急性经口LD50>5000 mg/kg。根据急性毒性分级,属于实际无毒级。检测结果来自宁波海关技术中心。
2.7 KH-0004遗传毒性试验
2.7.1 细菌回复突变试验:实验中所用到的菌株为组氨酸营养缺陷型鼠伤寒沙门氏菌TA1535,TA97,TA98,TA100和TA102。实验剂量设置:分别在加和不加S9的情况下选择0.05 mg/皿,0.16 mg/皿,0.50 mg/皿,1.58 mg/皿共5个剂量为正式试验剂量,选择0.01 mg/皿,0.04 mg/皿,0.20 mg/皿,1.00 mg/皿,5.00 mg/皿共5个剂量为验证试验剂量,同时空白对照组,阴性对照组,阳性对照组。菌株增菌后加入受试品、增菌液、S9混合液,涂布均匀,37˚C培养48小时,计算每皿的回变菌落数。结果表明,受试物各剂量组回变菌落数均未超过未处理对照菌落数2倍,不同剂量组间无剂量-反应关系。经验证试验确证受试物结果依然为阴性。检测结果来自宁波海关技术中心。
2.7.2 哺乳动物红细胞微核试验:实验动物为ICR清洁级小鼠,随机分为5组,每组10只,雌雄各半,经口灌胃给药,灌胃体积为20 ml/kg体重。三组受试样品组的浓度分别为2500 mg/kg体重、5000 mg/kg体重、10000 mg/kg体重,阴性对照组为纯水,阳性对照组为40 mg/kg体重的环磷酰胺。实验采用30小时受试物法,两次给受试物间隔24小时,第2次给药6小时后颈脱臼处死小鼠,去股骨,以小牛血清清洗骨腔,制成细胞悬液,涂片、染色、镜检。结果表明,各受试样品组的嗜多染红细胞微核率与阴性对照组比无显著性差异(P>0.05),在剂量≦10000 mg/kg体重的情况下,该样品的微核试验为阴性。检测结果来自宁波海关技术中心。
2.7.3 哺乳动物骨髓细胞染色体畸变试验:实验动物为ICR清洁级小鼠,随机分为3组,每组10只,雌雄各半,经口灌胃给药,灌胃体积为20 ml/kg体重。受试样品组的浓度分别为10000 mg/kg体重,阴性对照组为纯水,阳性对照组为40 mg/kg体重的环磷酰胺。实验采用两次给与受试物,每次间隔24小时,于末次给与受试物后18小时处死动物采样。处死动物前4小时,按4 mg/kg体重腹腔注射秋水仙素,颈脱臼处死小鼠,取骨髓细胞,制成细胞悬液,涂片、染色、镜检。结果表明,受试样品组的染色体结构畸变细胞百分率与阴性对照组比无显著性差异(P>0.05),在剂量≦10000 mg/kg体重的情况下,该样品的哺乳动物骨髓细胞染色体畸变试验为阴性。检测结果来自宁波海关技术中心。
2.8 KH-0004 28天经口毒性试验
根据GB 15193.22-2014食品安全国家标准28天经口毒性试验规范,及KH-0004人体推荐摄入量1000 ml/天,进行KH-0004 SD大鼠28天经口毒性试验,受试样品为10倍浓缩液。试验选择5周龄健康SPF级SD大鼠(雌雄均未交配过),试验初始雄性SD大鼠体重(83.4±3.6)g,雌性SD大鼠体重(85.1±3.5)g。试验设置4个剂量组,分别为5 g/kg·BW、10 g/kg·BW和20 g/kg·BW剂量组,分别相当于人体摄入的30倍、60倍和120倍,同时设立溶媒对照组(给予最大灌胃容量溶媒),每个试验组20只SD大鼠,雌雄各半,灌胃受试样品28天,灌胃容量20 ml/kg·BW;同时设置恢复期,即对照组和20 g/kg·BW剂量组(每组5雌5雄)在染毒28天后进行14天恢复期观察。染毒期限:28天,染毒频率:1次/天,染毒途径:灌胃,灌胃容量:2.0 ml/100g·BW。
结果表明,未见受试样品对SD大鼠存在潜在的毒性效应,未见受试样品对SD大鼠存在明显的靶器官毒性;14天恢复期结束未见各项检测指标变化;受试样品对SD大鼠28天经口毒性试验的未观察到有害作用剂量(NOAEL)为大于20 g/kg·BW。检测结果来自宁波海关技术中心。
3 讨 论
由病毒感染引起的疾病长期以来一直困扰着人类,然而由于其结构的特殊性,对于由病毒引起的疾病至今仍缺乏特异性的有效治疗药物。因此,面对威胁着人类生命健康的病毒,我们迫切地需要研制出疗效确切、安全性较高的药物。相比西药,中药具有许多优势,比如毒性较低,药性温和,材料丰富,价格低廉等[19]。因此,越来越多的人将抗病毒药物的研究投向传统的中草药。
本研究以八种中草药为原料,研制出了一款口感适宜,具有体外抗HSV-1,HSV-2,HBV,RSV,HCoVOC43,HCoV-229E作用的安全的功能性植物饮料,为进一步研究抗病毒药物提供依据,有望成为广谱抗病毒的新产品。组方中金银花、菊花、菊苣、蒲公英、代代花、淡竹叶气味辛凉,甘淡,清热解毒,砂仁和甘草温通阳气,调和诸药,制约了清热药的寒凉,不伤胃气,可以长期服用。既有五味消毒饮[20]的方义,又融入了封髓丹[21]的精神。配方和选药完全符合中医学的药学理论。
中草药是我国的瑰宝,社会的发展促使人们对疾病的认识,从治疗转换为预防,中药治疗病毒感染性疾病也已有了数千年的经验,以药食同源中草药为原料加工制得食品以用于对疾病的预防及治疗,值得我们进一步的深入探索,从而挖掘出更多有效的抗病毒的食品或药物。
感谢为本研究提供研发外包服务的单位:上海辉源生物科技有限公司提供抗单纯疱疹病毒实验、抗乙型肝炎病毒实验、抗呼吸道合胞病毒实验;中国医学科学院医生技所提供抗冠状病毒实验;浙江省宁波海关技术中心提供急性经口毒性试验、三项遗传毒性试验、28天经口毒性实验。

