菠萝果肉纤维素水凝胶的制备及对益生菌的包埋与缓释分析
行云逸,黄惠华
(华南理工大学食品科学与工程学院,广东 广州 510641)
水凝胶是一种由亲水性化合物通过物理和/或化学交联组成的具有三维网络结构的高分子材料,它能够在有机或无机溶剂中吸水溶胀并保持原有的形状和结构,而不会溶解于其中[1-2]。水凝胶具有独特的水亲和性、可降解性、渗透性和高溶胀性,被广泛应用于水处理、食品、组织工程、药物输送系统等领域[3-4]。由于组成水凝胶的高分子对外界环境变化具有不同程度的响应性,因此将水凝胶分为非敏感性水凝胶和智能水凝胶[5]。智能水凝胶较非敏感性水凝胶对外界刺激更为敏感,根据其对不同环境刺激响应的特性,将其分为pH敏感性水凝胶、温度敏感性水凝胶、磁场敏感性水凝胶、电场敏感性水凝胶等[6-8]。
pH敏感性水凝胶是一类溶胀性随外界环境pH值变化而变化的智能水凝胶。其三维网络中通常含有可离子化的基团,它们会根据pH值的变化而产生不同程度的离子化,导致水凝胶溶胀或收缩[9-11]。根据水凝胶中pH敏感性基团的不同,将其分为阳离子型、阴离子型和两性型pH敏感性水凝胶[12]。丙烯酸(acrylic acid,AA)接枝的水凝胶属于阴离子型水凝胶,由于大量—COOH基团的存在,使得其在高pH值环境下的溶胀度远远高于其在低pH值环境下的溶胀度[13]。
智能水凝胶因其环境响应特性在药物输送方面的应用受到学者们的广泛关注。Jeong等[14]以N,N'-亚甲基双丙烯酰胺作为交联剂将丙烯酸-2-羟乙酯(2-hydroxyethyl acrylate,2-HEA)接枝到羧甲基壳聚糖(carboxymethyl chitosan,CmCHT)上制备CmCHT-g-pHEA水凝胶,在体外皮肤渗透实验中,该水凝胶改善了川陈皮素的透皮递送作用,具有作为pH敏感的透皮药物递送系统的潜在应用价值。Jayaramudu等[15]通过N-异丙基丙烯酰胺(N-isopropylacrylamide,NIPAM)与Pluronic F-127的自由基聚合,合成了一种新型温度敏感性半互穿网络银复合水凝胶,该材料显示出对革兰氏阳性大肠杆菌的优异抑制能力,抑制区直径为1.78 cm,且具有比原始聚NIPAM高3 倍的溶胀率,可应用于伤口敷料。Kondaveeti等[16]利用过原位磁性纳米颗粒对由藻酸盐和黄原胶组成的磁性响应水凝胶进行改性,改性后的水凝胶对抗帕金森药物左旋多巴的负载效率高达64%,在静态外部磁场的作用下,可以刺激左旋多巴的释放,该研究为磁性水凝胶用于递送药物提供了合理的设计。
益生菌是指人体肠道内对机体健康具有益处的活微生物[17-18]。益生菌对宿主健康具有多种功能,包括增强肠道免疫功能、促进营养物质的消化吸收和维持肠道菌群平衡等[19-20]。理论上,摄入酸奶或活性乳酸菌饮料可以为机体提供益生菌,促进肠道健康。然而,益生菌要同时保证以活的状态和充足的数量定植在肠道中才能在人体内发挥相应的益生作用[21]。目前市面上的益生菌产品在生产、加工、运输、保存以及消化吸收等过程中,会因为不利环境的影响而使益生菌失活,最终以活的状态定植在肠道内的益生菌数量减少而导致其益生功能降低[22-24]。如何保证益生菌以较高的活性和足够的数量定植在人体肠道内,是近年来益生菌研究的热点之一,也是本实验研究的主要内容。
菠萝在加工过程中会产生大量的废弃物,其中果肉渣占较大比重,如果直接丢弃,不仅会造成资源浪费,而且会污染环境[25-26]。现阶段关于菠萝果肉的利用主要集中在菠萝蛋白酶和能源生产基质,对纤维素及其水凝胶利用方面的研究相对较少,对果蔬加工后废弃物尤其是菠萝果肉渣的利用缺乏更精细、更高值的途径。本研究从菠萝果肉渣中提取纤维素并制备成水凝胶,同时利用AA改性纤维素制备pH敏感性水凝胶,并包埋益生菌,以保护益生菌免受胃内酸性环境的影响,使其在特定部位即肠道内释放,保证益生菌以较高的活性和足够的数量定植在人体肠道内,从而发挥其益生作用。
由于纤维素链中存在丰富的活泼羟基,使得其内部形成大量的分子内和分子间氢键,从而形成高度有序的结晶区[27-28]。这些高度结晶区使得纤维素对水的亲和作用变小,因此纤维素很难溶于水和其他普通溶剂。本实验采用离子液体1-丁基-3-甲基咪唑氯盐(1-butyl-3-methylimidazole chloride,BmimCl)作为溶剂制备水凝胶,在纤维素的溶解过程中,离子液体中的自由无机阴离子与纤维素羟基氢作用形成氢键,而阳离子通过咪唑环上的活泼氢与纤维素羟基上的氧作用形成氢键,二者协同作用破坏了纤维素原有的氢键网络结构,促进其在离子液体中的溶解和交联,从而形成水凝胶。
本实验以菠萝果肉纤维素(pineapple pulp cellulose,PPC)为原料,通过离子液体BmimCl制备水凝胶作为益生菌的递送载体,以包埋益生菌增强其稳定性,为菠萝废弃物的高值化利用和益生菌的递送系统提供合理的途径和理论参考。
1 材料与方法
1.1 材料与试剂
实验所用新鲜菠萝为市售。
离子液体BmimCl(分析纯) 中国科学院兰州化学物理研究所;AA(分析纯) 天津科密欧化学试剂有限公司;过硫酸铵(分析纯) 国药集团化学试剂有限公司;亚氯酸钠(分析纯) 上海阿拉丁生化科技股份有限公司;氢氧化钠(分析纯) 天津福晨化学试剂厂;无水乙醇(分析纯) 南京化学试剂股份有限公司;益生菌 广州怡能生物科技有限公司;磷酸盐缓冲溶液(phosphate buffered saline,PBS)(0.02 mol/L、pH 7.2) 广东环凯生物科技有限公司;考马斯亮蓝、溶菌酶 上海伯奥生物科技有限公司。
1.2 仪器与设备
S-3700N钨灯丝扫描电子显微镜(scanning electron microscope,SEM) 日本Hitachi公司;VERTEX-33傅里叶变换红外光谱(Fourier transform infrared,FTIR)仪、D8 ADVANCE X射线多晶衍射(X-ray diffraction,XRD)仪 德国Bruker公司;JW-3021HR高速冷冻离心机 安徽嘉文仪器装备有限公司;UV-1800紫外-可见分光光度计 日本岛津公司;LGJ-10冷冻干燥机北京松源华兴科技发展有限公司;P H S-2 5 p H 计上海仪电科学仪器股份有限公司;HH-4数显恒温水浴锅 常州普天仪器制造有限公司;BSA12S-CW分析天平 德国赛多利斯仪器有限公司;FW-135中草药高速粉碎机 天津市泰斯特仪器有限公司;DF-101S集热式恒温加热磁力搅拌器 广州星烁仪器有限公司。
1.3 方法
1.3.1 PPC的提取
将菠萝去皮切成小块,水洗后在打浆机中进行打浆,过滤后获得果肉渣,用蒸馏水冲洗至滤水无色,置于50 ℃恒温干燥箱内干燥24 h。将干燥的果肉渣用粉碎机粉碎,并经过80 目筛网筛分得到菠萝果肉渣干粉,用于纤维素的提取。
将菠萝果肉渣干粉与蒸馏水按照质量比1∶5混合,于80 ℃条件下水浴2 h并不停搅拌,以除去果肉渣中的水溶性成分,然后用滤布过滤并用蒸馏水冲洗至滤液无色。将滤渣与质量分数为7.5%的亚氯酸钠溶液(用盐酸溶液调节pH值至3.8~4.0)按照体积比约1∶5混合均匀,于75 ℃水浴锅中漂白2 h,以除去木质素,将滤渣过滤并用蒸馏水冲洗至中性。然后将滤渣与质量分数10% NaOH溶液按照体积比1∶2混合,在室温下搅拌10 h,以除去半纤维素和其他杂质,过滤并用蒸馏水洗涤滤渣至滤液呈中性,并用体积分数95%乙醇溶液洗涤滤渣脱水,置于50 ℃恒温干燥箱中干燥至恒质量。用粉碎机将干燥后的滤渣粉碎,经过100 目筛网筛分得到PPC。
1.3.2 菠萝果肉纤维素水凝胶的制备
称取10 g离子液体BmimCl于试管中,待其在室温下融解成透明液体后,称取0.2 g PPC加入到离子液体中并混合均匀,置于100 ℃油浴锅中搅拌溶解3 h。将所得混合物溶液冷却至室温后,加入蒸馏水将反应体系中的离子液体置换出来,多次用蒸馏水浸泡以除去未反应的离子液体,即得到水凝胶。将水凝胶真空冷冻干燥36 h,得到冻干菠萝果肉纤维素水凝胶(pineapple pulp cellulose hydrogel,PPCH),置于室温下保存备用。
1.3.3 pH敏感性水凝胶的制备
称取1 0 g 离子液体B m i m C l 于试管中,待其在室温下融解成透明液体后,称取0.2 g P P C 加入到离子液体中并混合均匀,置于100 ℃油浴锅中,在N2氛围下搅拌溶解3 h。当混合物溶液冷却至60 ℃后,加入25 mg引发剂过硫酸铵(预先用0.5 mL二甲基亚砜溶解),并搅拌20 min以促进自由基的产生。然后将0.8 g的AA(预先在冰浴下质量分数40% NaOH溶液调节中和度至85%)加入到上述混合物溶液中,在N2氛围下70 ℃搅拌反应3 h。将混合物溶液冷却至室温后,即形成凝胶,用蒸馏水浸泡并洗涤3 d,以除去未反应的离子液体和杂质。将水凝胶真空冷冻干燥36 h,得到冻干pH敏感性水凝胶(记作PPCH-AA),置于室温下保存备用。
1.3.4 结构表征
1.3.4.1 FTIR分析
称取2 mg干燥样品,与100 mg KBr粉末均匀混合,压片制样,在FTIR仪上进行分析测定。测试条件为:分辨率4 cm-1、扫描范围4 000~500 cm-1。
1.3.4.2 XRD分析
将2 mg干燥样品,置于XRD仪测试,测试条件为:Ni滤波、Cu靶、衍射角2θ=4°~40°、扫描速率2(°)/min,测试管压和管流分别为40 kV和40 mA。
1.3.4.3 微观结构观察
取适量的干燥样品,用导电胶固定在铜盘上,对其表面进行喷金处理,用扫描电子显微镜在10 kV加速电压下观察样品的表面形貌。
1.3.5 水凝胶的溶胀性能测定
分别称取25 mg冻干水凝胶置于烧杯中,分别加入适量蒸馏水、模拟胃pH值环境的溶液(simulated gastric fluid,SGF)(pH 1.2,通过将2 g NaCl和7 mL浓HCl溶于1 000 mL蒸馏水中制备)、模拟肠道pH环境的溶液(simulated intestinal fluid,SIF)(pH 6.8,通过将250 mL 0.1 mol/L KH2PO4和118 mL 0.2 mol/L NaOH混合制备),使水凝胶浸没,每间隔一段时间取出水凝胶,用滤纸吸干表面水分后立即称质量,在37 ℃下溶胀至其质量不再增加即达到溶胀平衡。溶胀率按公式(1)计算。
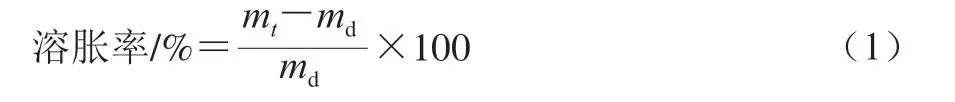
式中:md是冻干水凝胶的初始质量/g;mt是水凝胶中溶胀t时间后的质量/g。
1.3.6 水凝胶的pH敏感性测定
称量2 5 m g 冻干水凝胶,放置在不同p H 值(pH 1.0~8.0)的溶液中,使其充分溶胀至平衡,采用1.3.5节的方法测定其溶胀率,以不同pH值溶液中的溶胀性表征水凝胶的pH敏感性。
1.3.7 水凝胶吸附益生菌及其在模拟胃肠道pH值环境下的缓释性能比较
称取一定量的益生菌粉加入到0.02 mol/L pH 7.2的PBS中,配制成质量浓度为5 mg/mL的菌悬液。称取300 mg冻干水凝胶浸没于上述溶液中,在室温下静态吸附24 h,达到溶胀平衡(24 h)后将水凝胶取出,真空冷冻干燥36 h,得到冻干的载药水凝胶,置于室温下保存备用。
取1 5 0 m g 负载益生菌的冻干水凝胶分别置于20 mL SGF和SIF中,在37 ℃振荡水浴锅中缓释7 h。每隔1 h收集3 mL释放介质,并用相同体积的溶液(SGF或SIF)补充。以水溶性蛋白质量浓度变化作为指标,通过紫外-可见分光光度计测定蛋白质量浓度来间接测定缓释的益生菌的质量。载药水凝胶的益生菌累积释放量和累积释放率分别按公式(2)、(3)计算。
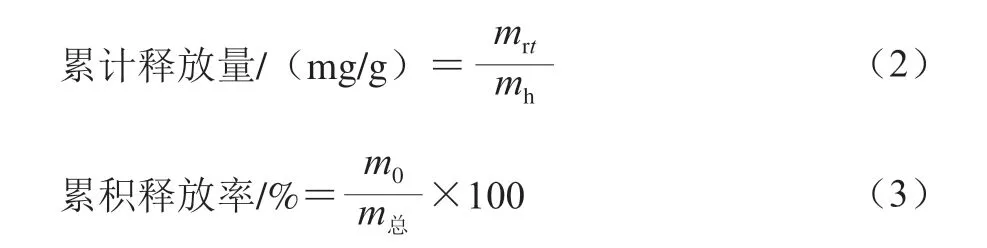
式中:mrt是载药水凝胶缓释t时刻累计释放的益生菌所含蛋白质量/mg;mh是用于缓释的载药水凝胶的质量/g;m0是载药水凝胶在缓释7 h时累计释放益生菌所含蛋白质量/mg;m总是载药水凝胶吸附益生菌所含蛋白总质量/mg。
1.3.8 益生菌中蛋白质量浓度的测定
由于SGF的pH值较低,在益生菌缓释过程中对益生菌的活性和结构可能有一定的影响,因此无法用一般的细胞计数法测定益生菌的含量,故采用溶菌酶溶解益生菌细胞壁,并配合超声破碎细胞[29],使蛋白质溶出,从而通过测定蛋白质量浓度间接得到所缓释益生菌的含量,具体方法如下。
标准曲线绘制:取13 支试管,1 支作为空白,其余试管分为两组平行,空白组和实验组分别加入0.1 mg/mL的标准蛋白质(牛血清白蛋白)溶液0、0.1、0.2、0.4、0.6、0.8、1.0 mL,并用蒸馏水补充到1 mL,在每个试管中加入5 mL考马斯亮蓝G-250试剂,充分混合均匀,于2 min后用紫外-可见分光光度计于595 nm波长处测定吸光度。以测得的吸光度为纵坐标(Y),蛋白质量浓度为横坐标(X/(mg/mL)),绘制标准曲线,回归方程为Y=38.681 85X-5.653 83×10-4,R2=0.998 9。
将收集的缓释介质用高速离心机8 000 r/min离心20 min,倒去上清液,得到菌泥。再加入5 mL的蒸馏水洗涤菌泥,并重复上述操作得到洗涤后的菌泥,以除去残留的缓冲液。准确量取10 mL PBS(pH 7.2)于菌泥中,并加入50 mg溶菌酶,40 ℃酶解60 min,使益生菌细胞壁破碎,然后再经过500 W冰浴超声30 min,使蛋白质溶出,得到酶解液。准确量取酶解液1 mL于试管中,加入5 mL考马斯亮蓝G-250试剂,混匀后静置2 min,用紫外-可见分光光度计于595 nm波长处测定吸光度,根据蛋白质标准曲线的回归方程计算得到所测定益生菌的蛋白质量浓度。
1.4 数据统计与处理
实验中的定量分析进行3 次重复,采用SPSS 24.0软件进行数据处理与分析,通过单因素方差分析中的最小显著差异法进行差异显著性分析,采用Origin 9软件作图。
2 结果与分析
2.1 水凝胶的结构表征结果
2.1.1 FTIR分析结果
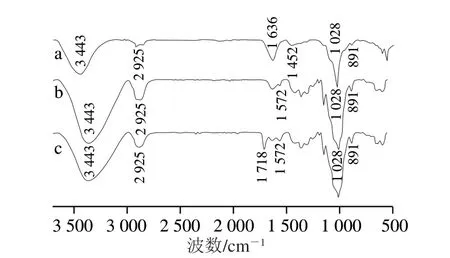
图1 PPC、PPCH和PPCH-AA的FTIR图Fig.1 Fourier transform infrared spectra of PPC, PPCH and PPCH-AA
从 图1 可 以 看 出,P P C、P P C H 和P P C H-A A 在3 443 cm-1处均有较宽的吸收峰,这属于纤维素链中O—H的伸缩振动峰,说明—OH基团、分子内和分子间氢键是水凝胶的主要结合键;2 925 cm-1处的吸收峰归因于纤维素的烷基和脂肪族烃中C—H的伸缩振动;1 636 cm-1处的尖锐吸收峰主要与纤维素链葡萄糖共轭苯环上的C—O伸缩振动有关;1 452 cm-1处为C—H的弯曲振动吸收峰;1 028 cm-1处为C—O—C的不对称振动吸收峰;891 cm-1处的吸收峰由纤维素链上的β-糖苷键引发[30-31]。
对比P P C 和水凝胶的F T I R 图,发现水凝胶在1 572 cm-1处有一个弱吸收峰,这可能是水凝胶中残留的少量离子液体造成的。与PPC和PPCH相比,水凝胶PPCH-AA在1 718 cm-1处出现新的吸收峰,这主要是归因于羰基C=O的伸缩振动,说明AA已经成功接枝到纤维素链上[32]。除此之外,PPC和PPCH、PPCH-AA的红外吸收峰位置基本一致,表明在利用离子液体BmimCl制备纤维素水凝胶的过程中未产生新的官能团。
2.1.2 XRD分析结果
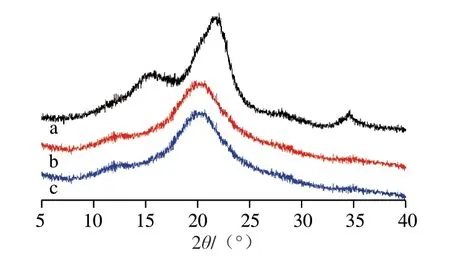
图2 PPC、PPCH和PPCH-AA的XRD图Fig.2 X-ray diffraction patterns of PPC, PPCH and PPCH-AA
由图2可知,PPC在2θ为21.7°处出现强衍射吸收峰,在2θ为15.4°和34.6°处出现两个相对较弱的衍射峰,说明P P C 在溶解前属于典型的纤维素I 型晶体[33]。而PPC制备得到的水凝胶PPCH和PPCH-AA在2θ分别为15.4°和34.6°处的衍射峰消失,只在2θ为19°~21°处有一个强度减弱的宽衍射峰,符合纤维素II型的XRD特征衍射吸收峰[34],说明PPC在溶解的过程中发生了由纤维素I型晶体结构向II型的转变。此外,对比PPC,水凝胶的衍射吸收峰的强度均有所下降,说明PPC在离子液体中溶解制备水凝胶的过程中,其晶体结构遭到破坏,结晶度有所降低。
2.1.3 微观结构观察结果

图3 PPC(a)、水凝胶PPCH(b)和PPCH-AA(c)的SEM图Fig.3 Scanning electron microscope micrographs of PPC (a), PPCH (b)and PPCH-AA (c)
如图3a所示,PPC呈现明显的束状结构,且表面粗糙、布满褶皱。图3b、c显示,水凝胶PPCH和PPCH-AA表面光滑,内部呈现致密的多孔结构,形貌结构发生了明显的变化,这可能是由于纤维素在制备水凝胶的过程中被溶解和改性,从而导致其晶体结构被破坏,束状结构消失[35]。
2.2 水凝胶的溶胀性能
图4a、b、c分别是37 ℃下水凝胶PPCH和PPCH-AA在蒸馏水、SGF、SIF中的溶胀动力学曲线。在溶胀初期,水凝胶迅速吸水膨胀,溶胀率增长速率较快。总的趋势是水凝胶在最初的30 min内溶胀率增长速率最快,之后逐渐减缓,约在60 min处溶胀率达到最高并处于溶胀平衡。PPCH在蒸馏水、SGF、SIF中的平衡溶胀率分别是3 580%、2 180%和2 604%,即吸水能力分别为35.80、21.80、26.04 g/g;PPCH-AA在蒸馏水、SGF、SIF中的平衡溶胀率稍有下降,分别是3 150%、1 664%和2 656%,即吸水能力分别为31.50、16.64 g/g和26.56 g/g。这可能是由于AA的接枝作用强化了水凝胶的交联,形成的水凝胶物理刚性提高,使得其对水的吸附能力有所下降。PPCH和PPCH-AA在SIF中的平衡溶胀率基本相同,而在SGF中,PPCH-AA平衡溶胀率明显低于PPCH,且明显低于在SIF中的平衡溶胀率,这是因为AA成功接枝到水凝胶中赋予了纤维素链大量的—COOH,—COOH在中性或碱性条件下会电离成—COO—,不影响水凝胶亲水基团的吸水膨胀;但在酸性条件下,—COOH基团不易解离,而是趋向于和纤维素链上的羟基形成氢键,从而阻止水分子进入凝胶网络,使得水凝胶的平衡溶胀率大大下降。
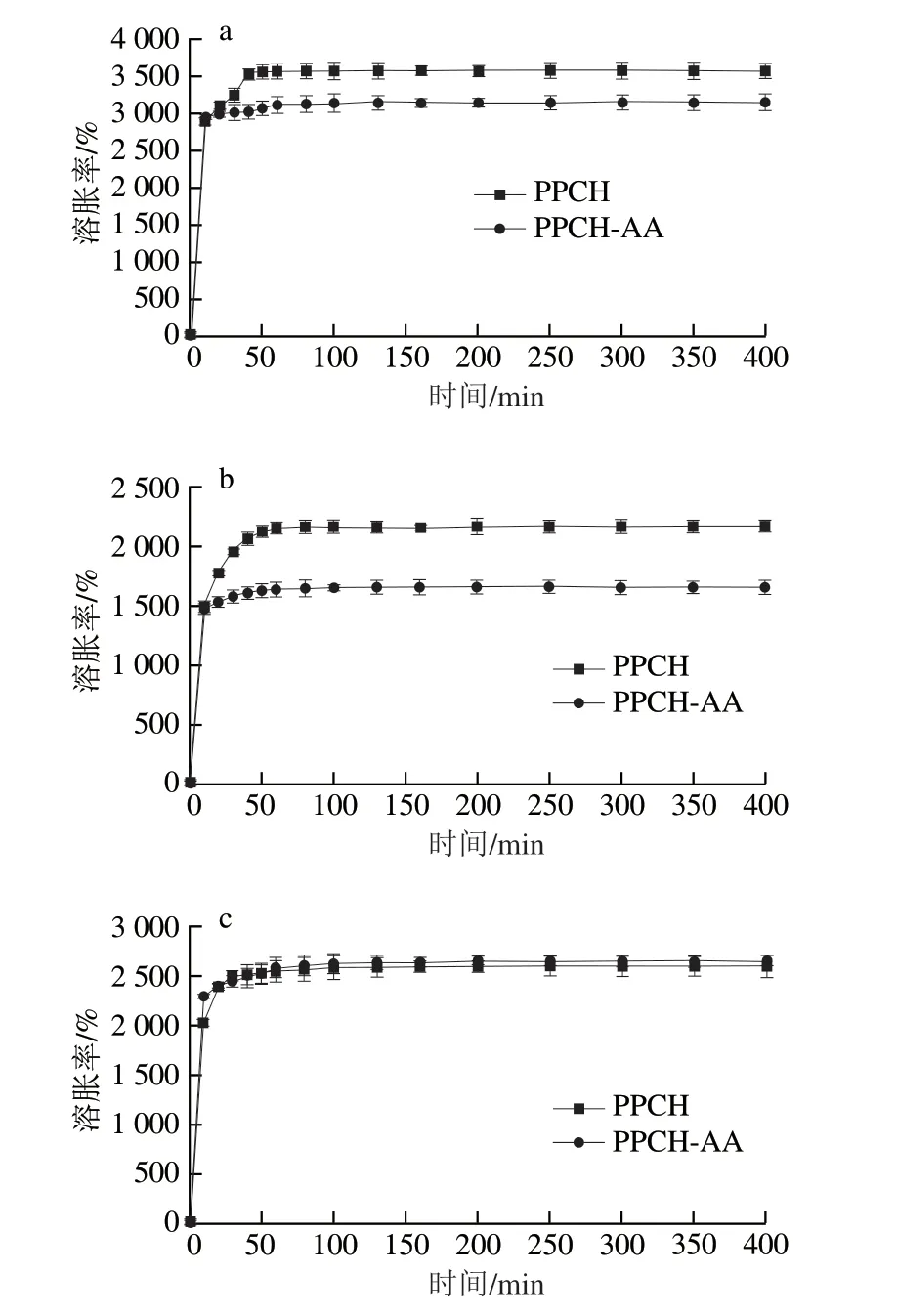
图4 PPCH和PPCH-AA在蒸馏水(a)、SGF(b)、SIF(c)中的溶胀动力学曲线Fig.4 Swelling kinetic curves of PPCH and PPCH-AA in distilled water (a), simulated gastric fluid (b), and simulated intestinal fluid (c)
2.3 水凝胶的pH敏感性
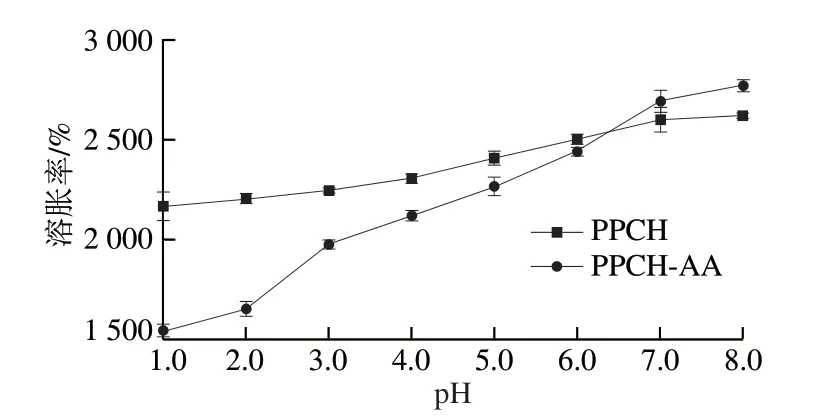
图5 水凝胶PPCH和PPCH-AA的pH敏感性Fig.5 pH sensitivity of PPCH and PPCH-AA
由图5可知,在同一温度(37 ℃)下,两种水凝胶的平衡溶胀率都随着溶液pH值增大而增加,两种水凝胶的溶胀率差异主要表现在酸性环境中。在低pH值溶液中,PPCH-AA的平衡溶胀率较低。其中PPCH-AA具有更明显的pH敏感性,平衡溶胀率由pH 1.0的1 500%提高到pH 7.0的2 700%;而在同一pH值变化范围内,PPCH的平衡溶胀率变化范围是2 200%~2 550%。这是由于在酸性条件下,PPCH-AA的—COOH基团不易解离成—COO—基团与H+,增加了—COOH基团之间的氢键作用,交联作用得到强化,水亲和性减弱,从而限制了水分子进入水凝胶内部,导致其在较低pH值时溶胀率低的现象。随着介质pH值的增加,溶液中的H+浓度降低,—COOH解离成—COO—,增加了水凝胶的亲水性,从而使水凝胶的溶胀率增加。
2.4 水凝胶的缓释性能

图6 负载益生菌的水凝胶PPCH(a)和PPCH-AA(b)在SGF和SIF中的缓释Fig.6 Sustained release of probiotics-loaded PPCH (a) and PPCH-AA (b) in SGF and SIF
水凝胶的缓释实验结果如图6所示,其中负载益生菌的PPCH和PPCH-AA在SGF中420 min内的累计释放量分别为44.11 mg/g和16.7 mg/g,释放率分别为66.17%和25.05%;在SIF中420 min内的累计释放量分别为59.25 mg/g和58.01 mg/g,释放率分别为88.87%和87.02%。由此可知,两种水凝胶在SIF的累积缓释量均大于其在SGF中的累积缓释量,其中,PPCH-AA在两种缓冲溶液中的缓释差异更为明显。负载益生菌的PPCH在SGF和SIF中的累积释放在240 min内基本达到平衡,释放过程相似。但是在同一时间段内,PPCH-AA在SGF和SIF的累积释放表现出较大差异。在SGF中,PPCH-AA的累积释放在60 min即达到平衡,而在SIF中,PPCH-AA的累积释放在120 min后仍具有增加的趋势。这是因为PPCH-AA具有pH敏感性,当它处于SGF中时,由于pH值较低,水凝胶的水亲和性降低,溶胀度低,结构紧密,网络孔径较小,水分子进出水凝胶难度加大,不利于益生菌的释放;当水凝胶在SIF中缓释时,水凝胶的溶胀率大大增加,吸水膨胀,使三维网络结构的孔径增大,水分子进出水凝胶的难度降低,在渗透压的作用下,促进了益生菌的释放,累积释放量大大增加。
3 讨 论
以PPC为原料,利用离子液体BmimCl制备PPCH和接枝AA的pH敏感性水凝胶PPCH-AA。FTIR分析结果表明水凝胶PPCH-AA出现了属于羰基的特征吸收峰,说明PPC在离子液体中与AA接枝成功;XRD分析结果表明纤维素在制备水凝胶的过程中,由纤维素I型晶体结构转变为II型,结晶度有所降低;SEM图显示纤维素制备成水凝胶后,原来的束状结构消失,表面光滑平整,内部呈现致密的多孔结构。
水凝胶溶胀实验结果显示,与PPCH相比,PPCH-AA在SIF中的溶胀率远高于其在SGF中的溶胀率,表现出明显的pH敏感性,可以用于益生菌的控释。水凝胶的缓释实验结果显示,与负载益生菌的PPCH相比,负载益生菌的PPCH-AA在SIF中420 min的累计释放量远高于其在SGF的累计释放量,累计释放量为58.01 mg/g,释放率可达87.02%,表明PPCH-AA可以作为益生菌的运送载体,减少其在胃内的释放,增加其在肠道内的定植数量。
为了保护益生菌的活性,国内外有很多关于其运送载体的研究。de Silva等[36]通过复合凝聚和转谷氨酰胺酶交联对嗜酸乳杆菌进行封装,暴露于模拟胃肠道时,可存活细胞数高达9.07(lg(CFU/g)),葡萄糖转氨酶的加入增加了微胶囊的热、贮藏稳定性,能够更好地保护益生菌。该实验与本研究的目的相同,说明包埋可以有效保护益生菌,但是该研究制备的微胶囊不具有环境响应性,在胃和肠道内的释放无差异性,而本研究所采用的包埋材料具有pH敏感性,可以减少其在胃内的释放,从而降低胃酸对益生菌的影响。但本实验缺少对益生菌活性的研究,之后可以进一步研究水凝胶制备方法对益生菌在肠道内的活细胞数量的影响。

