血清NOx、ADM、ADPN联合检测对急性缺血性脑卒中病人脑血管事件再发的预测价值
宋春梅,席绪明,颜玉苹,仰 炯
急性缺血性脑卒中约占脑卒中的80%,是发达国家第4大常见死因,也是导致病人残疾的主要原因[1]。有缺血性中风病史的病人中风复发和其他心血管事件风险也增加。因此,准确识别脑血管事件再发是实施二级预防的必要条件。近年来多项研究显示,一些生物标志物对脑卒中病人脑血管事件再发具有预测价值。一氧化氮(NO)在生理系统中具有多种功能,尤其在血管系统和中枢神经系统。脑组织过量产生NO,通过氧自由基参与神经毒性,导致细胞死亡和血脑屏障破坏[2]。肾上腺髓质素(ADM)作为血管紧张素Ⅱ的功能性拮抗剂,具有抑制醛固酮分泌,补偿肾素-血管紧张素-醛固酮系统作用,维持血管完整性,近年来用于心脑血管疾病的检测[3]。脂联素(ADPN)参与众多与动脉粥样硬化发展相关的途径,如糖脂代谢、炎症、内皮功能、血栓形成等,是心血管疾病的独立危险因素[4]。本研究检测急性缺血性脑卒中病人血清NO代谢物(NOx)、ADM和ADPN水平,观察其在急性缺血性脑卒中病人的变化及预测脑血管事件再发的临床价值。
1 资料与方法
1.1 临床资料 选取2015年1月—2017年12月在我院住院的急性缺血性脑卒中病人107例。入选标准:急性缺血性脑卒中经MRI/CT检查确诊,符合全国第四届脑血管病学术会议制定的急性缺血性脑卒中诊断标准;发病时间<24 h;病人及家属对本研究内容知情同意,自愿入组。排除标准:既往有脑血管意外病史;既往有严重肺部、心血管系统疾病病史;慢性肾病病史;应用免疫抑制或糖皮质激素等。其中男57例,女52例,年龄(68.2±9.8)岁;颞叶梗死26例,颞叶+额叶梗死19例,基底节区梗死27例,颞叶+顶叶梗死10例,额叶梗死7例,额叶+顶叶梗死12例,枕叶梗死6例,所有病人均伴有不同程度的神经功能缺损。选择同期健康体检者107名作为正常对照组,其中男57名,女50名,年龄(67.1±9.1)岁。两组性别、年龄比较,差异无统计学意义(P>0.05)。本研究经医院医学伦理委员会批准,符合医学伦理学要求。
1.2 神经功能缺损程度评估 采用美国国立卫生研究院卒中量表(NIHSS)评分评估神经功能缺损情况,包括意识水平、指令配合度、眼球活动、视野缺损、面部表情瘫痪程度、肢体运动障碍程度、共济失调、语言表达情况等11项,各项累加得分,总分42分,其中0~3分为轻型脑卒中。
1.3 血清NOx、ADM、ADPN检测 病人入组后第1天、第3天及第7天采集空腹静脉血,低温分离血清,检测NOx、ADM和ADNP,其中NOx检测采用比色法,检测仪器为721型分光光度计,检测波长为450 nm,试剂盒购自上海钰博生物科技有限公司;ADM和ADNP检测采用酶联免疫吸附法,检测仪器为Multiskan FC型酶标仪,试剂盒购自上海泽叶生物科技有限公司。检测过程严格按照试剂和仪器使用说明书进行。
1.4 随访 病人均规律随访,方式为电话或门诊,无失访,随访时间6~18个月。
1.5 再次脑血管意外事件 再次脑血管意外事件指与本次脑血管意外事件类似或相关的缺血性脑卒中,不包括与脑梗死无关的脑出血、脑外伤或肿瘤等。
2 结 果
2.1 血清NOx水平检测 与正常对照组比较,脑卒中病人第1天、第3天血清NOx水平降低(t值分别为6.698,4.562,P<0.05);而第7天血清NOx水平无明显变化(P>0.05)。NIHSS评分≥3分脑卒中病人第1天、第3天血清NOx低于NIHSS评分<3分病人(t值分别为3.914,3.476,P<0.05)。详见图1。

A为所有病人;B为NIHSS评分≥3分病人;C为NIHSS评分<3分病人。与正常对照组比较,*P<0.05;与B比较,#P<0.05。
2.2 血清ADM水平检测 与正常对照组比较,脑卒中病人第1天血清ADM水平升高(t=-4.021,P<0.05);而第3天、 第7天血清ADM水平无明显变化(P≥0.05)。NIHSS评分≥3分脑卒中病人第1天血清ADM明显高于NIHSS评分<3分病人(t=-3.525,P<0.05)。详见图2。

A为所有病人;B为NIHSS评分≥3分病人;C为NIHSS评分<3分病人。与正常对照组比较,*P<0.05;与B比较,#P<0.05。
2.3 血清ADPN水平检测 与正常对照组比较,脑卒中病人第1天、第3天血清ADPN水平降低(t值分别为8.654,6.547,P<0.05);而第7天血清ADPN水平无明显变化(P>0.05)。NIHSS评分≥3分脑卒中病人第1天、第3天血清ADPN明显低于NIHSS评分<3分病人(t值分别4.658,4.012,P<0.05)。详见图3。
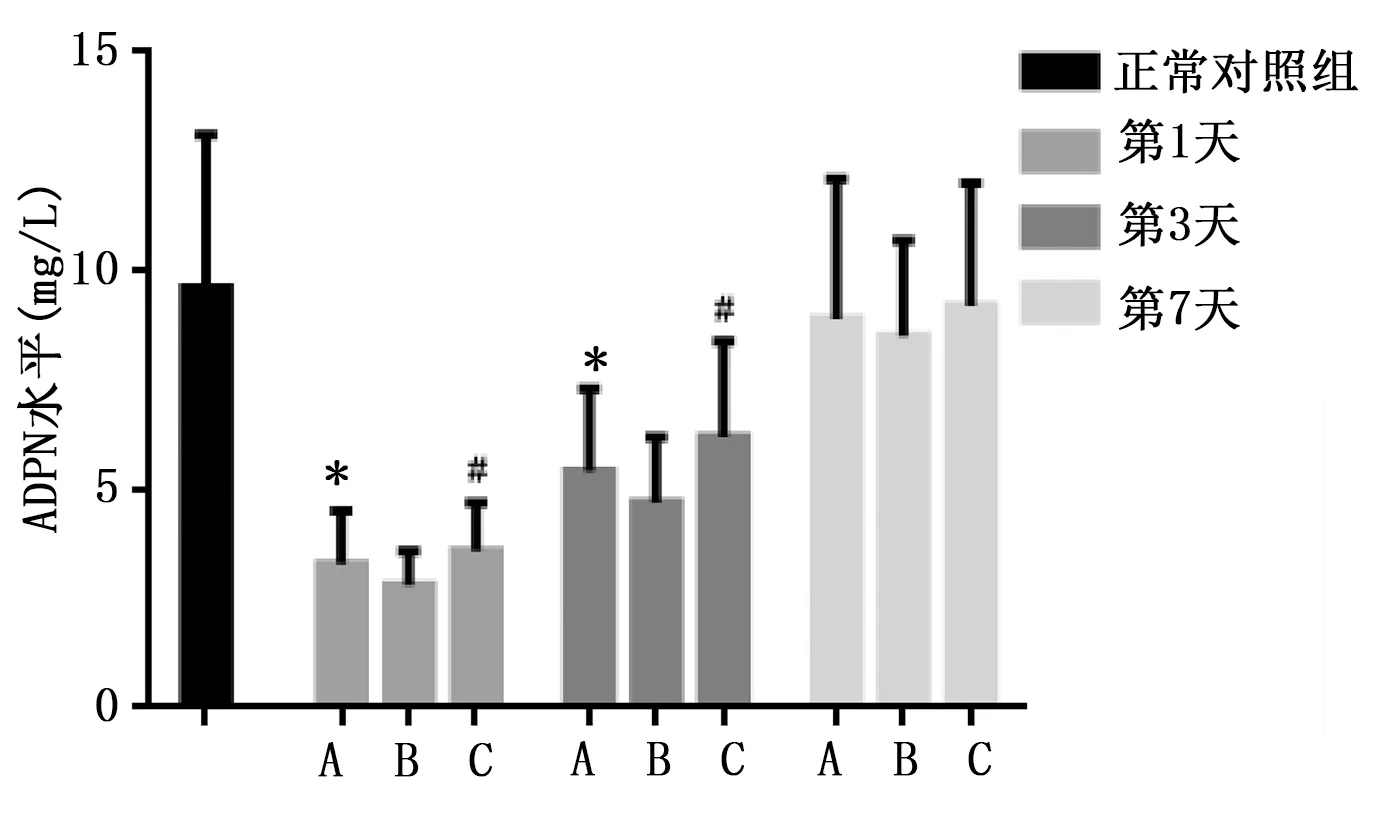
A为所有病人;B为NIHSS评分≥3分病人;C为NIHSS评分<3分病人。与正常对照组比较,*P<0.05;与B比较,#P<0.05。
2.4 急性缺血性脑卒中病人脑血管事件再发相关影响因素分析 对107例急性缺血性脑卒中病人进行随访,48例病人发生脑血管事件,发生率为44.9%。急性缺血性脑卒中病人脑血管事件再发相关因素结果显示:高血压、糖尿病、高脂血症、NIHSS评分、服用抗高血压药物、服用他汀类药物和服用抗凝药物是影响脑血管事件再发的危险因素。详见表1。

表1 急性缺血性脑卒中病人脑血管事件再发相关因素分析 单位:例
2.5 急性缺血性脑卒中病人脑血管事件再发的Logistic危险因素分析 将高血压、糖尿病、高脂血症、NIHSS评分、服用抗高血压药物、服用他汀类药物、服用抗凝药物、第1天 NOx、第2天 NOx、第1天 ADM、第1天 ADPN、第2天 ADPN纳入Logistic回归模型,结果显示:NIHSS评分、第1天 NOx、第1天 ADM、第1天 ADPN是急性缺血性脑卒中病人脑血管事件再发的独立危险因素。将NIHSS评分、第1天 NOx、第1天 ADM、第1天 ADPN拟合成联合指标,即Logit(P)=0.212+0.632×NIHSS评分-0.212×第1天 NOx+0.062×第1天 ADM-0.314×第1天 ADPN。以未再发脑血管事件病人作为阴性组,再发脑血管事件病人作为阳性组,3项指标联合诊断脑血管事件再发的灵敏度为88.23%,特异度为94.12%,ROC曲线下面积(AUC)明显高于第1天 NOx、第1天 ADM、第1天 ADPN各指标单独检测(Z值分别为6.219,8.267,5.216,P<0.05)。详见表2。

表2 各指标联合预测脑血管事件再发的诊断价值
3 讨 论
缺血性脑卒中是致残率较高的脑血管疾病,病人恢复期存在再次脑卒中风险,导致病人神经功能缺损加重及生活质量降低。再次脑卒中的发生除与危险因素控制有关,本研究结果显示,高血压、糖尿病、高脂血症等基础疾病、NIHSS评分及服用抗高血压药物、服用他汀类药物和服用抗凝药物为病人是否发生再次脑卒中相关因素,提示脑卒中发生后需针对危险因素给予充分干预,也应规律降脂、抗血小板等治疗。再次脑卒中的发病过程中,脑血管功能相关的细胞因子参与此过程,并发挥重要作用。对病人发生再脑卒中风险进行有效评估及干预,是改善预后、降低再脑卒中风险的有效措施。
NO、ADM及ADPN是与血管功能密切相关的细胞因子,NO作为一种活性氧,过量NO通过抑制过氧化氢酶和细胞色素P-450,导致微摩尔浓度氧化应激,而过氧化氢酶和细胞色素P-450均参与细胞对氧化损伤的保护[5]。过表达NO抑制核糖核酸肽还原酶,此酶为DNA合成的限速酶,从而增加DNA损伤。因此,腺苷59-二磷酸核糖合成酶被激活,引起三磷酸腺苷(ATP)生产二磷酸腺苷核糖过程中耗尽,导致神经毒性细胞死亡[6]。过表达NO可逆性抑制线粒体呼吸复合物,尤其是细胞色素C氧化酶,致使短暂性呼吸电子传输紊乱和电子传输链中超氧化物泄漏增加[7]。超氧化物是有氧代谢产生的,在低浓度条件下由超氧化物歧化酶保持[8]。超氧化物不断从线粒体中泄漏,或未超过线粒体超氧化物歧化酶水平,超氧化物在一定程度与NO发生反应,由此形成毒性化合物过氧亚硝酸盐,后者对细胞色素氧化酶和ATP酶具有较强的抑制作用,导致线粒体呼吸不可逆抑制、ATP耗竭及细胞死亡[9]。NO是由内皮型一氧化氮合酶(eNOS)、神经元型一氧化氮合酶(nNOS)和诱导型一氧化氮合酶3种一氧化氮合酶异构体在不同细胞中产生。因此,NO不仅在内皮细胞和神经元中合成,还在吞噬细胞、中性粒细胞和活化的星形胶质细胞产生。NO可调节血管功能中的多种作用[10],不仅引起血管舒张,还能抑制血小板黏附、聚集和白细胞与内皮细胞黏附,还可抑制血管平滑肌细胞增殖和低密度脂蛋白(LDL)氧化[11]。NO有助于保持血管结构完整性。本研究通过NOx检测反映NO水平,与健康对照组比较,脑卒中病人第1天、第3天血清NOx水平明显降低,在7 d后恢复; NIHSS评分≥3分脑卒中病人第1天、第3天血清NOx明显低于NIHSS评分<3分病人,可一定程度反映病情严重程度。
ADM是Xie等[12]于1993年发现的一种肽类激素,是由52个氨基酸组成,含有环状结构和C-端酰胺,两者均与ADM受体结合。ADM基因位于第11号染色体,由4个外显子组成。ADM生物学活性的关键决定因素之一是受体活性修饰蛋白组(RAMP)。RAMP 2或3与降钙素受体样受体(CRLR)结合赋予ADM受体的特异性,因此,RAMP和CRLR是ADM表达的关键。ADM最初是在嗜铬细胞瘤中发现,进一步研究表明,它由许多其他组织/细胞合成,特别是内皮和血管平滑肌细胞,且由于ADM分子量较小,可在血液和间质之间自由扩散[13]。通过前激素(pro-ADM)的蛋白水解碎裂,形成甘氨酸延伸的非活性ADM,之后被酶从ADM-甘氨酸转化为具有生物活性的ADM-酰胺。ADM受体和结合位点在体内广泛分布,但在心脏血管和肺组织结合位点密度最高[14]。除了血管舒张作用外,ADM可维持内皮细胞完整性。各种刺激均可诱导ADM表达,其中之一为体积过载,血浆ADM增加反映液体体积过大。这可能是一种抵消反应的结果,由于ADM诱导的内皮屏障功能稳定限制组织液超载,而ADM系统破坏导致血管渗漏、全身和肺水肿[15]。本研究结果显示,脑卒中发生第1天血清NOx水平明显升高,且随着NIHSS评分升高而不断增高。
ADPN是由ADIPOQ基因编码的247-氨基酸多肽,位于3q27染色体上,含有3个外显子。ADPN是由脂肪细胞产生,通过其相应的受体AdipoR1和AdipoR2发挥作用,它们在骨骼肌、肝脏和脂肪组织中表达[16]。3种形式ADPN在血液中循环,即低分子量三聚体、平均分子量六聚体和高分子量聚合物。虽然高分子量聚合物具有较强的血管保护功能,但这3种异构体的确切作用尚不明确。一般人群血清ADPN水平存在较大差异,长期禁食和减肥后增加。相关研究表明,ADPN对葡萄糖稳态、脂质代谢和心血管系统具有有益作用[17]。ADPN通过激活过氧化物酶体增殖激活受体-a和-g及AMP激活的蛋白激酶通路增强胰岛素敏感性[18]。ADPN促进骨骼肌游离脂肪酸氧化,并与胰岛素协同作用,抑制肝脏葡萄糖生成。ADPN通过上调抗炎细胞因子,如白细胞介素(IL)-10、IL-1受体拮抗剂和抑制促炎细胞因子(如肿瘤坏死因子-α、干扰素-γ)抑制全身炎症。临床研究显示,低水平ADPN与超敏C反应蛋白水平有关[19]。ADPN通过抑制黏附分子(如细胞间黏附分子-1、血管细胞间黏附分子-1、E-选择素)阻止单核细胞黏附于血管壁,具有抗动脉粥样硬化的作用,可抑制巨噬细胞对氧化低密度脂蛋白摄取,进而转化为泡沫细胞,同时抑制血管平滑肌细胞增殖。ADPN通过刺激一氧化氮产生改善内皮功能,同时防止内皮细胞凋亡,降低氧化应激[20]。本研究结果显示,脑卒中病人发生第1天、第3天血清ADPN水平明显降低,7 d后恢复正常,NIHSS评分≥3分脑卒中病人第1天、第3天血清NOx明显低于NIHSS评分<3分病人。
本研究将NOx、ADM、ADPN与其他影响急性缺血性脑卒中病人脑血管事件再发的相关因素纳入模型,建立脑血管事件预测模型,发现基于第1天 NOx、第1天 ADM、第1天 ADPN模型具有较高的灵敏度和特异度,预测再次脑卒中风险ROC曲线发现,术后第1天三者联合检测预测再次脑卒中AUC为0.851,高于各指标的单一检测AUC,具有较高的预测价值。血管功能调节过程中,NOx、ADM、ADPN存在相互调控的关系,ADM激活血管一氧化氮/一氧化氮合酶通路,调节eNOS和代谢酶系活动[21]。ADPN可抑制脂肪细胞和巨噬细胞的炎症通路,发挥抗炎作用;通过结合血管内皮细胞表面的AdipoR2受体,诱导NO和合成,并降低血小板聚集、白细胞黏附和血管平滑肌细胞增生[22],与NO及ADM构成复杂的信号网络,共同调控血管。
综上所述,急性缺血性脑卒中病人发生再次脑卒中等风险因素较多,危险因素的干预及规律的治疗可降低再次脑卒中风险,NOx、ADM、ADPN等细胞因子组成调控网络,共同参与再次脑卒中发生过程,检测NOx、ADM、ADPN可评估再次脑卒中风险,为干预策略的制定提供依据。

