伏立康唑滴眼液的含量测定及其开启稳定性
[中山大学中山眼科中心(眼科学国家重点实验室)药学部,广州 510080]
真菌性角膜炎(fungal keratitis,FK)是一种发病迅速、治疗棘手、破坏性极大的眼病,如得不到及时有效的治疗,可发展至角膜溃疡穿孔、眼内感染、眼球萎缩,甚至致盲[1-2]。目前其治疗方法以局部应用抗真菌药物为主,再结合全身用药治疗[3]。在临床常用的局部抗真菌药物中,那他霉素高效广谱,但其穿透力较差,仅用于浅表感染的治疗,且价格极其昂贵[4];两性霉素B虽然毒性强,但对我国FK常见的致病菌镰孢菌属无效[5-6],且使用时对眼部刺激大;氟康唑眼内通透性好刺激小,抗菌普广,但抗菌效力较弱,疗效差[7]。
随着新三唑类抗真菌药伏立康唑的批准上市,其强大的抗菌活性和优良的通透性为眼科真菌感染性疾病的治疗带来了新的曙光[8]。研究[9-12]表明:局部使用伏立康唑溶液点眼治疗FK,能起到很好的治疗效果;该溶液用于健康马眼后,1.0%溶液的房水浓度明显高于0.5%,而与3.0%的溶液房水浓度大致相同[13]。目前,还没有商品化的伏立康唑眼用制剂上市。在获得患者知情同意的情况下,中山大学中山眼科中心制剂室临时配制浓度为1.0%的伏立康唑滴眼液用于临床严重FK患者的紧急治疗。为确保滴眼液含量的准确可控,确保其含量在开启使用的4周内不发生大的变化,提高用药的安全有效性,需建立一种准确可靠的方法用于测定伏立康唑滴眼液含量,此外还需考察该滴眼液的开启稳定性。
1 材料与方法
1.1 仪器及试剂
实验采用Waters e2695高效液相色谱仪,包括Waters2489紫外检测器及Waters Empower化学工作站(美国Waters公司),BT-125D型电子天平(德国Sartorius公司)。试剂包括:伏立康唑对照品(批号:100862-201903,含量:99.8%,中国食品药品检定研究院),注射用伏立康唑(批号:19110105,珠海亿邦制药股份有限公司),伏立康唑滴眼液(规格:10 mL:100 mg,批号:20052601,20060201,20060202,中山大学中山眼科中心制剂室),乙腈为色谱纯,乙酸铵、醋酸为分析纯,水为注射用水。
1.2 含量测定方法
1.2.1 色谱条件
以十八烷基硅烷键合硅胶为填充剂;以0.02 mol/L 醋酸铵缓冲液(用醋酸调节pH 值至4.0±0.3)-乙腈(55:45,V/V)为流动相,检测波长为256 nm,流速为1.0 mL/min,柱温为30 ℃,进样量为10 μL。
1.2.2 试液的配制
对照品溶液的制备:精密称取伏立康唑对照品,用流动相溶解并稀释,制成每1 mL中约含伏立康唑0.1 mg的对照品溶液。
供试品溶液的制备:精密量取伏立康唑滴眼液1 mL置于100 mL容量瓶中,加流动相稀释至刻度,作为供试品溶液。
阴性样品溶液的制备:取不含伏立康唑的阴性样品,按供试品溶液配制法制得阴性样品溶液。
1.2.3 专属性试验
按“1.2.1”的色谱条件,分别记录对照品溶液、供试品溶液及阴性样品溶液的HPLC色谱图。
1.2.4 稳定性试验
分别取对照品溶液(0.107 mg/mL)和供试品溶液(约0.1 mg/mL),置室温环境下放置,在0,2,4,6,8,12 h进样,测定峰面积。
1.2.5 精密度
取同一对照品溶液,连续重复进样6次;另取同一批号(批号:20052601)的伏立康唑滴眼液样品6份,按供试品溶液制备方法处理后,测定伏立康唑的含量。
1.2.6 线性关系
精密称取伏立康唑对照品适量,用流动相溶解,得到浓度为1.0621 mg/mL的伏立康唑对照品储备液。分别精密量取储备液0.4,0.6,0.8,1.0,1.2,1.4 mL置10 mL量瓶中,加入流动相稀释至刻度,得到浓度分别为0.0425,0.0637,0.0850,0.1062,0.1274,0.1487 mg/mL的对照品溶液,分别精密量取10 μL注入液相色谱仪,按“1.2.1”项下的色谱条件,测定峰面积并记录色谱图。
1.2.7 加样回收率试验
精密吸取不含伏立康唑的阴性样品1 mL置100 mL 容量瓶中,分别精密加入浓度为1.0621 mg/mL的伏立康唑对照品储备液8,10,12 mL,用流动相稀释至刻度,每个浓度配制3份,得到含伏立康唑为规定量80%,100%,120%的回收率测定溶液各3份,共9份。按“1.2.1”方法测定,计算回收率。
1.2.8 耐用性试验
在试验中对柱温、流速进行适当的调整,分别测定伏立康唑滴眼液(批号:20052601)的含量,以考察方法的耐用性。分别在柱温为30 ℃,35 ℃,40 ℃及流速为0.8,1.0,1.2 mL/min条件下进行实验,其他色谱参数不变。
1.2.9 样品含量测定
取本品,按照供试品溶液配制方法制备,测定其主药含量,按外标法以峰面积以计算,含量应为标示量的90.0%~110.0%。
1.3 开启稳定性
为进一步确保伏立康唑滴眼液的质量,笔者对该滴眼液开启后,按每天4次的频率模拟临床患者使用,每次用完后拧紧瓶盖,再将剩余的滴眼液分别在2~8 ℃,25 ℃,40 ℃环境中贮存。连续4周对该滴眼液的开启使用的稳定性进行考察。
2 结果
2.1 专属性试验
供试品溶液与对照品溶液在相同的保留时间下出现伏立康唑的峰,峰形对称,无相邻杂质峰,阴性样品溶液在此保留时间处无色谱峰出现,表明处方中其他成分对伏立康唑的测定无干扰(图1)。
2.2 稳定性试验
稳定性试验中,6个时间点下对照品溶液峰面积的相对标准偏差(relative standard deviatio,RSD)为0.14%,供试品溶液峰面积的RSD 为0.17%。表明在室温条件下对照品溶液和供试品溶液在12 h内较稳定。
2.3 精密度
对照品溶液,连续重复进样6次,测定峰面积RSD为0.08%(n=6),低于可接受标准(RSD <2%),表明仪器精密度良好;6份供试品溶液的平均含量为97.8%,RSD为0.18%,低于可接受标准(RSD<2%),表明本方法重复性良好。
2.4 线性关系及回收率
以浓度(X,mg/mL)为横坐标,峰面积(Y)为纵坐标绘制标准曲线,线性回归方程为:Y=12006824.3400X+8666.5238 (r=0.9999)。结果表明:伏立康唑在0.0425~0.1487 mg/mL范围内线性关系良好。
9 份溶液的平均回收率为99.97%,RSD 为0.12%,结果显示:3个浓度下伏立康唑的平均回收率均为98.0%~102.0%,9个回收率数据的RSD均小于2.0%,表明含量测定方法可靠(表1)。

表1 加样回收率试验结果Table 1 Results of adding sample recovery
2.5 耐用性试验
耐用性试验结果显示柱温及流速对伏立康唑含量测定结果影响较小(表2)。
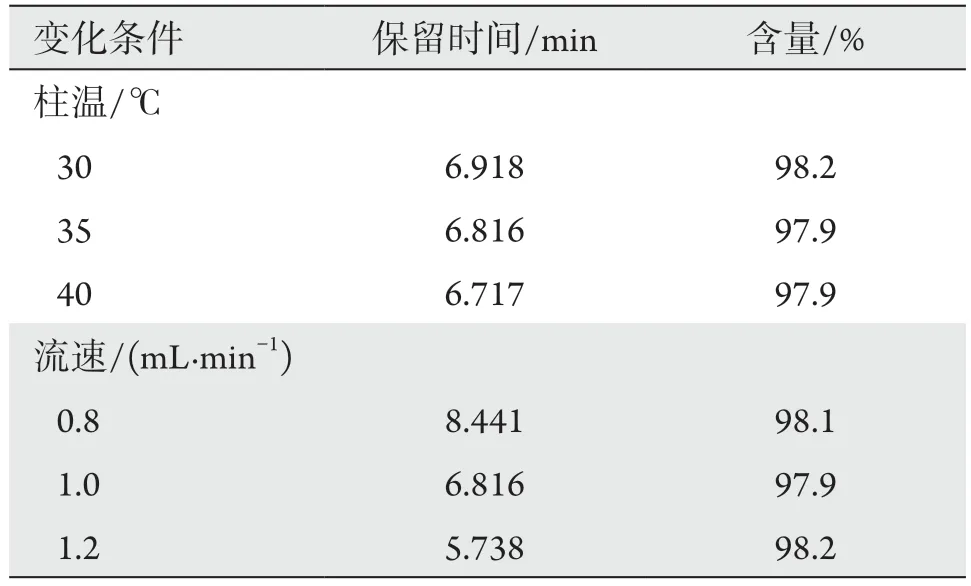
表2 耐用性试验结果Table 2 Results of durability test
2.6 样品含量测定
3 批制剂测试结果见表3,含量均在标示量90.0%~110.0%的范围内,符合规定。
2.7 开启稳定性考察
4周内3种环境下贮存的滴眼液均为无色的澄明液体,无可见异物。pH值稳定在6.1~6.2,渗透压稳定在545 mOsmol/kg左右,25 ℃条件下含量基本不变,2~8 ℃和40 ℃含量略微出现下降,也能保持在98%以上(表4)。此外,在第0周和第4周对开启使用的滴眼液进行了无菌检验,结果符合规定。以上实验结果表明该滴眼液开启使用4周,稳定性良好。

表3 三批伏立康唑滴眼液的含量测定结果Table 3 Three batches analysis results of voriconazole eye drops
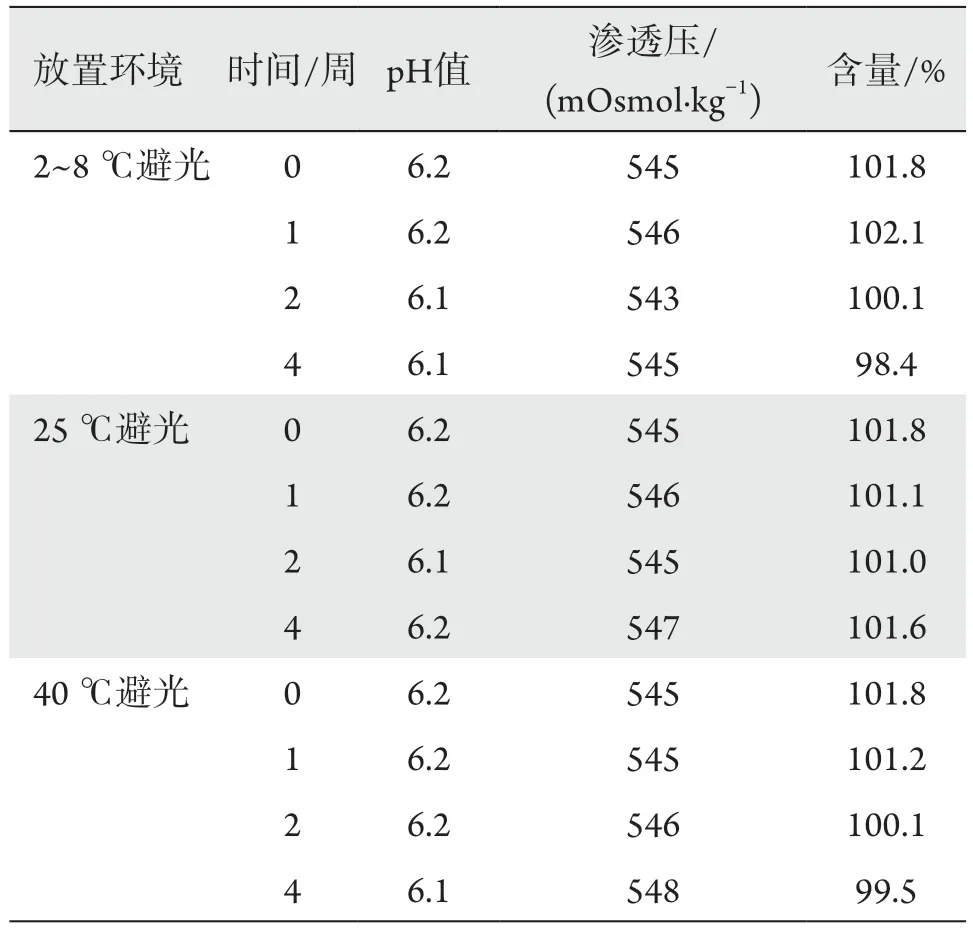
表4 伏立康唑滴眼液的开启稳定性Table 4 Stability of voriconazole eye drops after opening
3 讨论
参考研究[14-16],笔者对流动相的组分比例进行了优化和筛选,改良了伏立康唑滴眼液的高效液相色谱检测方法。经方法学试验验证,该测定方法稳定好,准确度高,回收率好,可以有效控制其滴眼液的质量。开启稳定性研究结果表明:中山大学中山眼科中心临时配制的伏立康唑滴眼液打开后按4次/d的使用频次,每次用完盖好,放置在不用的环境保存4周,稳定性良好,能满足其在临床严重真菌感染患者中紧急使用的要求。
相比其他伏立康唑的测定方法,如紫外吸收光谱、酶联免疫分析等,HPLC法的特异性更好,精密度更高,测试结果更精准,在药物分析检测领域发挥不可替代的作用。本研究存在的不足之处是在稳定性试验设计时,针对该临配滴眼液只考察了其开启稳定性,考虑到本品渗透压偏高,还需继续优化滴眼液的处方工艺后,配制出可批量生产、质量更优的院内制剂,再进一步对伏立康唑滴眼液的稳定性进行全面考察。

