早产儿视网膜病变的综合管理
王旌 综述 童晓维 审校
(1.上海市眼病防治中心/上海市眼科医院眼科,上海 200040;2.国家眼部疾病临床医学研究中心,上海 200040;3.上海市眼底病重点实验室,上海 200080;4.上海市第一人民医院眼科,上海 200080)
早产儿视网膜病变(retinopathy of prematurity,ROP)是全世界儿童失明的主要原因。ROP为一种低出生体重早产儿视网膜血管发育障碍,与早产儿中未能完成妊娠期间由视乳头发育至周边的视网膜血管化有关,部分患者并发视网膜新生血管(retinal neovascularization,RNV)甚至继发视网膜牵引。病理生理学上,ROP的发生发展包括3个阶段:第一阶段,生理性血管发育不足,形成周边视网膜无血管区。第二阶段,无血管的周边视网膜过度释放血管内皮生长因子(vascular endothelial growth factor,VEGF),产生RNV。第三阶段,RNV进一步纤维血管化,造成牵引性视网膜脱离。
目前的ROP综合管理以RNV为核心。在第一阶段,合理的血氧饱和度(oxygen saturation,SpO2)目标能够预防生理性血管损伤,促进视网膜血管发育。在第二阶段,规范有效的ROP筛查和随访能够密切观察和评估RNV生成情况。激光等视网膜消融治疗或玻璃体内抗VEGF药物注射能够抑制RNV生成。在第三阶段,玻璃体视网膜手术治疗能够解除视网膜牵引,实现视网膜解剖复位。
近年来,大量随机临床试验(randomized controlled trial,RCT)为ROP的处理提供了循证医学理论。通过科学规范的综合管理,能够有效降低ROP患者失明的比例。
1 SpO2 目标与RNV 预防
氧疗是ROP可操控的重要危险因素,合理的SpO2是RNV预防的重要手段。视网膜及视网膜血管的不成熟程度主要取决于出生时的早产程度[1]。出生时高氧应激与重度ROP相关。高氧应激能够阻断视网膜生理性血管化,合理的SpO2对ROP的预防起重要作用。
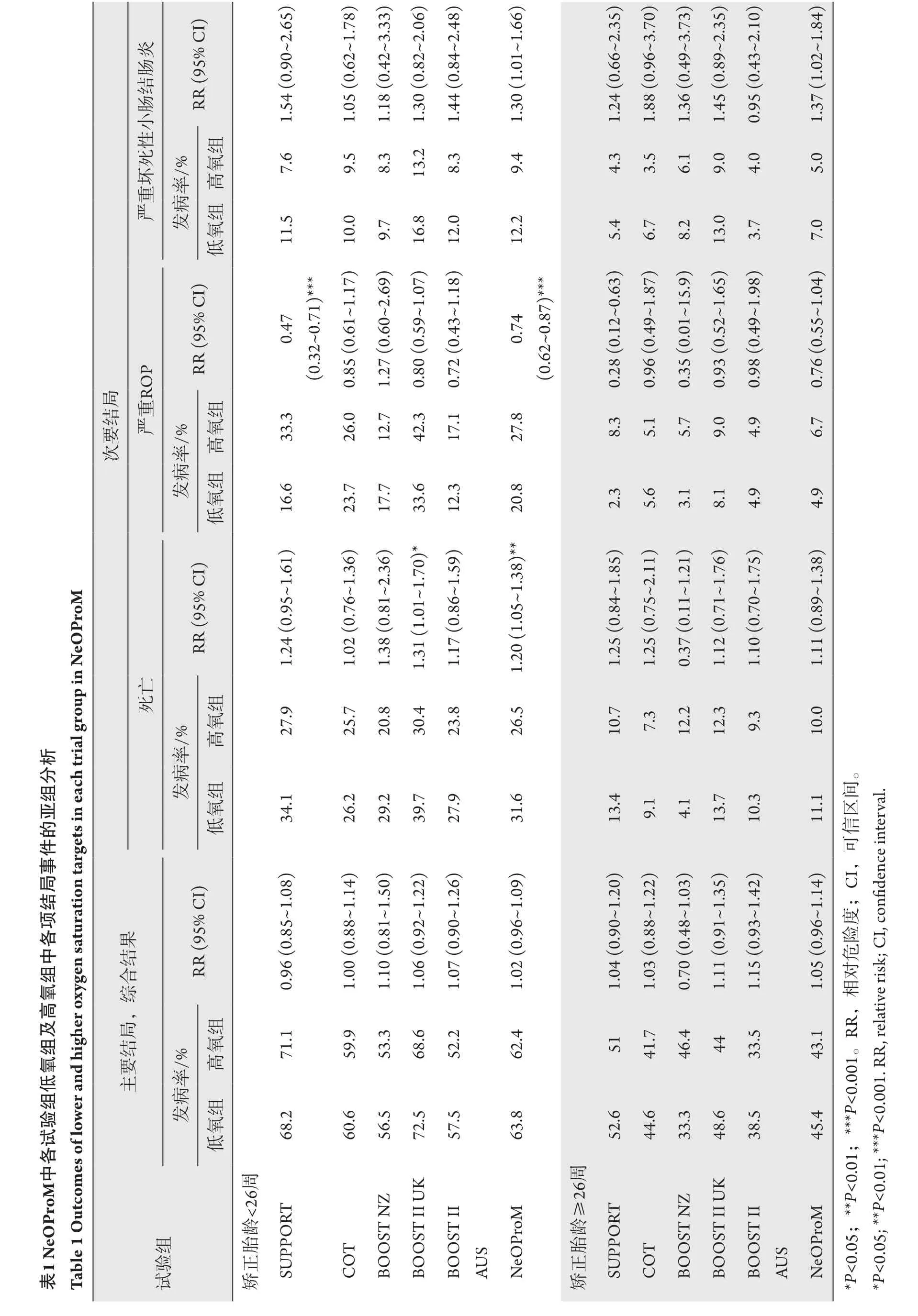
为了确定早产儿合适的SpO2,新生儿氧合前瞻性荟萃分析(Neonatal Oxygenation Prospective Meta-analysis,NeOProM)协作小组对5项独立的RCT 进行前瞻性设计的、独立参与者数据的荟萃分析[2]。这5 个随机、双盲、多中心R C T包括美国的表面活性剂,正压和脉搏血氧仪随机试验(Surfactant,Positive Pressure,and Pulse Oximetry Randomized Trial,SUPPORT)[3-5],加拿大氧试验(Canadian Oxygen Trial,COT)[6],针对新西兰的氧饱和受益试验(Benefits of Oxygen Saturation Targeting II-New Zealand,BOOSTNZ)[7],针对英国的氧饱和受益试验II(Benefits of Oxygen Saturation Targeting II-United Kingdom,BOOST-II UK)[7-8],针对澳大利亚的氧饱和受益试验II(Benefits of Oxygen Saturation Targeting IIAustralia,BOOST-II AUS)[8],共纳入4965名婴儿个体,同质性高。因此,其结果对临床设定目标SpO2以降低ROP治疗比例有很大的指导意义。
试验结果表明:偏低的SpO2目标(85%~89%)能够比偏高的SpO2目标(91%~95%)降低更多的需要治疗的ROP比例(10.9% vs 14.9%),但是会增加18~24个月校正年龄的病死率(19.9% vs 17.1%)和严重坏死性小肠结肠炎的发生率(9.2% vs 6.9%;表1)。
偏低的S p O2目标虽然能够降低R O P,却可能增加神经发育受损或死亡的风险,因此,NeOProM将18~24个月校正年龄的死亡或严重残疾(包括双侧失明、耳聋、脑瘫或认知语言障碍)的综合结果设为主要结局变量。两组中主要综合结果差异没有统计学意义[2]。许多新生儿学家担心降低SpO2作为控制ROP的一种策略会危及婴儿的生存。因此,合适的SpO2仍然存在争议。有学者[9]认为:在出生时胎龄(gestational age,GA)<28周的早产儿中,仍应将SpO2保持在90%~94%,以减少病死率。
2 ROP 筛查与随访规范
有风险的婴儿接受定时精准的视网膜检查,是监测RNV发展和退化的重要手段。目前的ROP筛查指南主要基于出生体重(birth weight,BW)和GA。美国、英国、加拿大和我国的ROP筛查标准分别修订于2018年,2008年,2016年和2013年,GA分别是30,32,30+6/7周和34周,BW的标准分别是1500,1501,1250和2000 g[10-12]。均建议在扩瞳条件下筛查ROP。
R O P 的检出率在不同国家、不同I C U 报道中存在差异,估计在21.8%~36.5%[13]。且在极低出生体重或合并其他疾病的早产儿中RO P 发病率增加[14]。为了增加ROP筛查的特异性,欧美国家推出了一系列筛查辅助工具,如Screening Tool for Early Postnatal Prediction of Retinopathy of Prematurity(STEP-ROP)[15],ROP评分(ROPScore)[16],weight,insulinlike growth factor (IGF),neonatal-ROP (WIN-ROP)[17]和Children’s Hospital Of Philadelphia (CHOP) ROP模型[18]等。
印度的筛查标准和我国类似[19]。与发达国家相比,我国和印度ROP患儿均存在出生体重相对重,孕周相对高的特点。美国和英国使用的筛查标准暂时不适合发展中国家[19-20]。并且,我国的ROP筛查开展率低,尤其在基层医院问题严重[21]。基层医院ROP筛查开展率可能仅25%左右[22]。ROP的及时筛查仍然是我国公共卫生领域的重要话题。
我国2013年由卫生部发布的《早产儿治疗用氧和视网膜病变防治指南(修订版)》和美国儿科协会(American Academy of Pediatrics,AAP)2018年修订的《早产儿视网膜病变筛查指南》均规定初次筛查时间为矫正胎龄31周(GA ≤27)或出生后4周(GA >27)[11-12]。两者均遵循2005年修订的国际ROP分类(International Classification of Retinopathy of Prematurity,ICROP)的标准来分类、绘制和记录病变的分区和分期。
ICROP标准中的4期ROP(部分视网膜脱离)和5期ROP(全视网膜脱离)属于“不良结局”,会造成严重的视力损伤。ROP冷冻治疗的多中心试验(CRYO-ROP)提出了阈值病变概念。如果不予以治疗,43%的阈值病变,也就是伴有附加病变的I区3期或II区3期ROP患者会进展为不良结局。经过光凝或冷冻治疗后,该比例会下降为21.8%[23]。
ROP早期治疗试验(early treatment for ROP,ETROP)进一步将CRYO-ROP的“阈值前ROP”进行分型,发现伴有附加病变,I区1/2期,II区2期ROP患者进展为阈值病变的比例依次为87.5%和66.4%。假如不伴有Plus病变,I区3期,I区1/2期和II区3期ROP患者进展为阈值病变的比例依次为68.8%,49.5%和25%。因此,ETROP将伴有附加病变的所有I区ROP和II区2/3期ROP以及不伴有附加病变的I区3期ROP归类为阈值前病变I型ROP,也称为“高危阈值前ROP”),认为需要进行光凝或冷冻治疗。治疗后,不良结局的发生率能够从15.6%下降到9.1%(P<0.001)。而将不伴有Plus病变的I区1/2期和II区3期ROP归类为阈值前病变II型,因为其相对安静,进展较慢,可以随访观察[24]。
因为对阈值病变和阈值前I型ROP及时进行治疗可以显著降低视力丧失的风险,因此我国和美国的筛查指南均强调了对阈值病变和阈值前I型ROP的及时治疗。我国的筛查指南特别强调了对急进性后极部ROP(aggressive posterior retinopathy of prematurity,A P-R O P)的密切随访(3 天1 次)。美国指南的随访周期相对宽松,该指南根据RO P 病变的分区进行了更加详细的规划和筛查终止标准,且推荐了未成熟视网膜和ROP退化的随访频率(表2)。尽管与美国相比,我国的新生儿医学仍然存在一定差距,也绝不可生搬硬套美国的筛查指南。但是,了解AAP 2018版的筛查指南,仍然对临床医生预判ROP患者病情发展提供了一定的指导意义。
近年来,利用数字化的广角视网膜图像联合远程判读技术不断发展,但是仍然不能完全取代双目间接检眼镜。目前,仍然缺乏与双目间接检眼镜的结果进行比较的大规模研究[25]。远程医疗应该注意图像采集者与眼科医生的协作,并制定详细的转诊预案。远程医疗中,对于出现附加病变、I区ROP或3期ROP,建议进行积极转诊[26]。在实施治疗或终止筛查之前,最好由合格的眼科医生进行至少1次间接检眼镜检查[25]。
3 周边视网膜消融治疗
视网膜周边无血管区过度释放VEGF是RNV发生发展的核心理论。进行周边视网膜消融是降低玻璃体腔内VEGF负荷,控制RNV的传统手段。视网膜周边消融主要包括冷冻治疗和激光光凝治疗。目前,光凝已经取代冷冻,成为首选的周边视网膜消融方法。和早年的冷冻治疗相比,光凝治疗可以减少眼内炎症、视野缺损和近视发生等并发症。
我国2013年由卫生部发布的《早产儿治疗用氧和视网膜病变防治指南(修订版)》和AAP 2018年修订的《早产儿视网膜病变筛查指南》均建议阈值病变和阈值前I型ROP接受激光光凝。
在接受抗VEGF治疗后,进行激光光凝的指征目前尚无统一共识。一般认为,如果RO P 持续或R NV重新活动,可以考虑进一步进行激光光凝[27]。
尽管利用数字化的广角视网膜图像在筛查中广泛应用,目前仍然建议新生儿在接受激光光凝前进行至少1次双目间接检眼镜以明确激光范围。
对于确定需要治疗的阈值病变和阈值前I型ROP,治疗应该在72 h内完成,以降低视网膜脱离的风险,并在3~7天内进行随访,以确定是否需要进一步补充激光治疗。

表2 我国(2013年)与美国(2018年)早产儿视网膜病变筛查指南对照Table 2 Comparison of screening guidelines for retinopathy of prematurity in China (2013) and the United States (2018)
4 玻璃体腔内注射抗VEGF 药物
玻璃体腔内注射抗VEGF药物在RNV的治疗中有很大的应用前景,但最佳的安全剂量和RNV复发的处理规范尚未确定。
贝伐单抗消除R O P 的血管生成威胁试验(Bevacizumab Eliminates the Angiogenic Threat of Retinopathy of Prematurity,BEAT-ROP)证实:与常规激光治疗相比,玻璃体腔注射贝伐单抗(intravitreal injections of bevacizumab,IVB)0.625 mg对I区ROP有显著疗效,而对II区ROP无效。IVB治疗后,周边视网膜血管继续发育,但常规激光治疗导致周边视网膜永久性破坏。荟萃分析[28]提示:虽然IVB可以降低I区ROP患儿ROP复发的风险,但也可能导致II区ROP患儿复发风险更高,需要重新治疗。
目前,美国食品和药物管理局(Food and Drug Administration,FDA)还没有批准贝伐单抗或其他抗VEGF物质用于治疗ROP,IVB主要用于激光治疗后仍然进展的病例,或者I区ROP。2018年的美国ROP筛查指南指出,如果考虑使用抗VEGF药物,对于包括安全性和系统性不良反应等尚未解决的问题,需要征得父母的知情同意[12]。
值得注意的是,因为IVB治疗改变了ROP的自然进程,可能无法观察到IVB治疗的婴儿视网膜完全血管化这一可靠终点,晚期仍可能出现复发的增殖性病变[29-30]。BEAT-ROP队列的长期随访显示:复发风险最高的时期为矫正胎龄45~55周,1例AP-ROP患者在矫正胎龄64周复发。其他研究[29,31-33]中,部分患者甚至在矫正胎龄65~70周复发。部分患者甚至可能在1年后并发牵引性视网膜脱离[34]。所以,安全终止监测前应该进行谨慎的临床判断。
除了IVB,研究者也开展了其他抗VEGF药物的临床试验。雷珠单抗与激光治疗极低出生体重ROP的比较研究[27](ranibizumab versus laser therapy for the treatment of very low birthweight infants with retinopathy of prematurity,RAINBOW)提示:玻璃体腔内注射雷珠单抗(intravitreal injections of ranibizumab,IVR)0.2 mg治疗ROP疗效优于激光治疗,其不良眼预后低于激光治疗,24周安全性良好,并且IVR造成视网膜脱离或黄斑牵引等手术并发症的风险比激光光凝组少[35]。RAINBOW招募了所有阈值前I型ROP,而BEAT-ROP仅招募了I区ROP。1.5岁时,IVB和IVR治疗都比激光光凝有更好的屈光结果[36]。然而,和IVB一样,IVR治疗后都在III区发生血管化延迟和周边血管异常的情况[37-38],出现ROP复发[39],或者可能出现进行性、非典型性牵引性视网膜脱离[34]。
理想情况下,适当剂量的玻璃体内抗VEGF剂量可以中和过量的VEGF,安全地延长视网膜内血管生成,抑制视网膜前血管生成,而不会对发育中的器官或大脑产生不利影响[40]。但ROP婴儿眼球容积、血容量和玻璃体腔内VEGF的浓度存在个体差异,所以理想剂量尚不确定。有学者[41]提议降低IVR或IVB的剂量以增加安全性。儿童眼病研究小组[42](Pediatric Eye Disease Investigator Group,PEDIG)证实0.04 mg是治疗ROP的最低有效IVB剂量,但可能需要接受额外的治疗。
小规模的队列研究[43-44]提示:单剂量的玻璃体腔内注射阿柏西普[43]或康柏西普[44]也对1型ROP有治疗效果。
抗VEGF治疗的有效性已经得到充分确认,但其长期安全性仍然需要更多临床数据支撑。
5 玻璃体视网膜手术治疗
玻璃体切除术是4期和5期的首选治疗方法。如果可能的话,在4b期发生之前,需要对进行性4a期ROP进行手术。以下情况可能提示进行性4期ROP:3期ROP出现玻璃体浓缩、混浊或出血,2个以上钟点的Plus病变,或6个以上钟点的嵴隆[45]。
4期ROP常见的手术方式包括保留晶状体的玻璃体切除术(lens-sparing vitrectomy,LSV)和巩膜扣带术。多项研究[46]表明:对于激光治疗后的II区4期ROP,LSV的疗效优于巩膜扣带术。保持婴儿自然晶状体可以促进视力的发展,降低青光眼的风险,较少引起明显的屈光参差[47]。利用吸顶灯的四通道双手技术有助于剥除AP-ROP后级部的紧密粘连。带有BIOM的广角观察系统广泛应用,但接触镜或者三维可视化系统可以对复杂的后级部病变提供更好的立体视觉。
巩膜扣带术理论上可降低白内障或眼内炎的风险,可与IVB及激光治疗联合[48],推荐用于周边视网膜牵引或皱襞,治疗视网膜牵引造成的周边裂孔,或激光斑附近的萎缩孔,但不能解除黄斑牵引。巩膜扣带会导致屈光参差,增加弱视风险。在3~6个月可能需要二次手术切断扣带,以减少屈光参差和诱发近视的风险。
5期ROP患者如果出现角膜轻度混浊或者屈光介质混浊可进行晶状体切除术,也可以使用内窥镜检查虹膜后和晶状体后的结构。术前B超有助于了解伴有晶状体后膜的漏斗关闭情况。联合IVB减少血管活动可以增加手术成功率。角膜极度混浊时,需要进行临时性人工角膜辅助的玻璃体切除术。
药物辅助的玻璃体手术是ROP治疗的热点之一。IVB治疗可以增加血管稳定性,但治疗后1周或1年内RNV均可能发生进展。密切监测预示视网膜脱离的早期纤维血管活动,对确定手术时机和最佳平衡的风险和益处非常重要[49]。纤溶酶可释放层粘连蛋白,辅助4期和5期ROP的玻璃体手术[50]。手术中也可以使用曲安奈德染色去除玻璃体皮质。
在儿童玻璃体视网膜手术中,即时序贯双侧手术可降低脆弱婴儿重复麻醉的风险,并为晚期疾病提供及时干预。因此,对进行性、双侧、对称性4或5期ROP的早产儿,可考虑同时进行双侧手术。但第二只手术眼应该作为1个新病例进行治疗,使用单独的手术器械和辅料。
激光治疗或IVB治疗、血管活动程度、黄斑脱离、视网膜牵引及漏斗闭合情况、视网膜牵引劈裂等结构异常、手术类型、手术技巧、胎龄、出生体重、氧饱和度情况和围产期护理均会对预后造成影响。手术后解剖复位的成功率大约为4a期89%,4b期63%,5期42%[46]。LSV之后,可能有17%的患者并发白内障。术后并发青光眼等比例大约为4A期6.9%,4B期12.0%,5期33.3%[51],切除晶状体比LSV更容易诱发青光眼。眼球生长可能导致后期复发性视网膜脱离。
6 长期随访
ETROP研究者[52]报道了在ROP治疗后,有必要进行白内障、近视、ROP、眼球震颤、脑视力损害、青光眼和斜视等相关方面的随访。CRYOROP试验的长期随访结果[53]证实:严重的ROP患者,在10年后仍然会存在视敏度下降,与是否进行了视网膜消融手术无关。激光治疗比冷冻治疗产生的近视度数更小(-4.48 DVS,-7.65 D)[53],与激光消融治疗相比,抗VEGF治疗后近视进展可能更小,但目前缺乏长期的比较[54-55]。即使积极检查和治疗,少数患有ROP的高危婴儿仍会发展为失明。
7 结语
随着围产期护理水平的提高,ROP筛查和随访规则的标准化,影像技术的发展,远程医疗的辅助,激光治疗的普及,抗VEGF治疗的应用和玻璃体视网膜手术技术的不断发展,ROP造成的儿童失明比例在不断降低。但是,识别和管理有血管活性的ROP仍然存在挑战。在未来,我们仍然需要更安全的药物治疗方案和手术技术发展来提高ROP的预后情况。
志谢
感谢上海交通大学医学院附属新华医院眼科赵培泉教授和复旦大学附属眼耳鼻喉科医院眼科黄欣教授在文章撰写和修改中提供的宝贵意见。在此予以诚挚的感谢。

