基于网络药理学和多中心临床数据的清肺承气汤治疗腹腔感染所致急性呼吸窘迫综合征的作用机制研究
王馨培,王子玉,傅 强, 3*,杜 超,巩传勇,王 兵
基于网络药理学和多中心临床数据的清肺承气汤治疗腹腔感染所致急性呼吸窘迫综合征的作用机制研究
王馨培1,王子玉2,傅 强1, 3*,杜 超4,巩传勇5,王 兵6
1. 天津医科大学研究生院,天津 300070 2. 湖北省中西医结合医院 重症医学科,湖北 武汉 430015 3. 天津市第四中心医院 重症医学科,天津 300140 4. 天津中医药大学第一附属医院 急症部,天津 300193 5. 天津市南开医院 重症医学科,天津 300102 6. 天津市第一中心医院 重症医学科,天津 300190
采用网络药理学和多中心临床数据探讨清肺承气汤治疗腹腔感染所致急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的作用机制。通过中药系统药理学分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)数据库检索清肺承气汤的化学成分和靶点。采用Cytoscape 3.7.1软件建立“化合物-靶点”网络、靶点间的蛋白相互作用(protein protein interaction,PPI)网络,并对预测靶点进行京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析。从3所医院选取27例腹腔感染所致ARDS患者,随机分为13例对照组和14例清肺承气汤组,分别于治疗前后3 d取肺泡灌洗液,微球检测法检测患者肺泡灌洗液中白细胞介素-4(interleukin 4,IL-4)、白细胞介素-6(interleukin 6,IL-6)、白细胞介素-10(interleukin 10,IL-10)水平;流式细胞术检测患者肺泡巨噬细胞的凋亡情况。筛选得到清肺承气汤中78种活性成分,对应63个潜在靶点;“化合物-靶点”网络和PPI网络度值靠前的靶点为过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptor γ,PPARγ)、B细胞淋巴瘤/白血病-2(B-cell lymphoma-2,Bcl-2)、IL-6、IL-10、γ干扰素(interferon-gamma,INFG),化合物为槲皮素和木犀草素;潜在靶点的KEGG通路排序靠前的炎症相关通路为核因子-κB(nuclear factor-κB,NF-κB)通路、肿瘤坏死因子(tumor necrosis factor,TNF)信号通路、白细胞介素-17(interleukin 17,IL-17)通路、T细胞受体通路等信号通路。与对照组比较,清肺承气汤组患者肺泡灌洗液中IL-6水平显著升高(<0.05),IL-10水平显著降低(<0.05),肺泡巨噬细胞的凋亡面积显著降低(<0.001)。清肺承气汤中的有效成分可以通过IL-6、Bcl-2、IL-10、趋化因子配体2(CXC chemokine ligand 2,CXCL2)等靶点参与调控多条信号通路来影响IL-4、IL-6、IL-10分泌和细胞凋亡,从而治疗ARDS。
清肺承气汤;腹腔感染;急性呼吸窘迫综合征;网络药理学;槲皮素;木犀草素;白细胞介素;凋亡
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)为重症监护室的常见病种,死亡率达到20%~50%[1]。创伤、感染、药物等均可诱发ARDS,而对于外科重症监护病房中的ARDS患者,严重腹腔感染是最常见的诱因[2-3]。研究表明,ARDS的发病机制为肺部促炎反应与抗炎反应失衡,造成肺部炎症紊乱。目前ARDS以基础治疗和支持治疗为主,对肺部炎症进展治疗欠佳,因此寻找有效的药物对治疗ARDS有重要意义。
清肺承气汤由小承气汤与小陷胸汤组成,首见于张仲景所著的《伤寒杂病论》。小承气汤由大黄、枳实、厚朴组成,3味同煎,枳实、厚朴减少用量,泻热攻下之力较轻,适用于阳明热盛、燥屎初结、痞满而实、燥坚不甚之腑实证[4]。小陷胸汤主治痰热互结之结胸证,方中黄连清热泻火,半夏化痰开结,2药合用,辛开苦降、善治痰热内阻;以栝楼实荡热涤痰、宽胸散结,3药共奏清热化痰、宽胸散结之功[5]。两方合用可轻下热结、清热化痰,在中医理论上吻合腹腔感染、阳明热结所致肺损伤痰多喘息之证。课题组前期研究发现,清肺承气汤对于ARDS患者有明确的治疗效果,但其具体药效物质基础和作用机制尚不明确[6-7]。本研究基于网络药理学方法对清肺承气汤治疗ARDS的潜在靶点和作用机制进行预测,并通过对临床患者的数据分析,探讨清肺承气汤对细胞因子和肺巨噬细胞凋亡的影响。
1 材料
1.1 网络药理学材料
中药系统药理学分析平台(TCMSP,http://lsp. nwu.edu.cn/tcmsp.php),GeneCards知识库(https:// www.genecards.org/),Cytoscape 3.7.1软件(https:// cytoscape.org/),OMIM数据库(https://omim.org/),STRING数据库(https://string-db.org/)、DAVID 6.8数据库(https://david.ncifcrf.gov/)。
1.2 临床研究的一般资料
选自2016年6月—2018年3月于天津市南开医院、天津市第一中心医院、天津市第四中心医院重症加强治疗病房(ICU)收治的严重腹腔感染所致ARDS患者为研究对象,所有患者均签署知情同意书,并通过天津市第四中心医院伦理委员会审查(伦理批件号SZXLL-2015-030)。
纳入标准:1周内起病、新发或恶化的呼吸症状;双肺模糊影不能完全由渗出、肺塌陷或结节来解释;不能完全由心力衰竭或容量过负荷解释的呼吸衰竭;没有发现危险因素时可行超声心动图等检查排除血流源性肺水肿,呼气末正压通气(positive end-expiratory pressure,PEEP)≥5 cm H2O时,100 mm Hg<(O2)/FiO2≤200 mm Hg或(O2)/FiO2≤100 mm Hg;腹腔感染符合脓毒症诊断标准[8];气管插管机械通气治疗;年龄>18岁且<80岁;患者及其家属知情同意。
排除标准:发病24 h内死亡者,或临终状态;合并外伤、免疫缺陷性疾患、严重心血管疾病、终末期肝肾疾病、恶性肿瘤;近期内使用免疫抑制剂(如激素等);艾滋病或慢性炎症性疾病(如类风湿性关节炎);各种原因中途退出者。
1.3 仪器
纤维支气管镜购自Olympus公司、液相芯片悬浮系统购自Flexmap 3D公司;免疫分析试剂盒、手持式磁力洗板机、涡流搅拌机、微量滴定摇版机、流式细胞仪均购自Thermo Fisher Scientific公司。
2 方法
2.1 清肺承气汤活性成分的筛选
在TCMSP数据库中输入关键词“大黄、枳实、厚朴、黄连、半夏、栝楼”得出化合物信息。计算机模拟吸收、分布、代谢和排泄系统评估模型用于评估清肺承气汤的潜在活性成分。口服生物利用度(oral bioavailability,OB)用于评估体内药物的药动学和药物形成特性,药物相似性(drug-likeness,DL)用于评估分子在生物利用度等方面的“药物样”程度,根据DL≥0.18、OB≥30%对化合物进行筛选。
2.2 药物活性成分对应靶点和ARDS相关靶点的搜集
利用TCMSP对78种活性成分的对应靶点进行统计,在GeneCards数据库和OMIM数据库中查找ARDS疾病的相关靶点。
2.3 “化合物-疾病-靶点”和蛋白相互作用(protein protein interaction,PPI)网络的构建
利用R语言得到化合物、疾病和靶点的共同作用靶点,基于STRING构建PPI网络模型,相互作用置信度>0.4,采用Cytocape 3.7.1软件构建“化合物-疾病-靶点”网络。
2.4 京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析
通过DAVID数据库对疾病和化合物的关键靶点进行KEGG富集分析。
2.5 临床研究的分组与治疗方法
共纳入ARDS患者27例,随机分为对照组(13例)和治疗组(14例)。对照组参照2012年脓毒症指南[8],进行抗感染、改善循环、血液净化、机械通气支持等治疗;治疗组在对照组基础上给予清肺承气汤治疗。清肺承气汤由大黄、枳实、厚朴、黄连、半夏、瓜蒌组成,制成的中药颗粒规格:3 g/袋;2袋中药颗粒溶于200 mL温水口服或胃管注入,4袋中药颗粒溶于400 mL温水,保留灌肠,2次/d。
2.6 患者一般情况的统计
根据患者入院后的血常规、血气分析值和生命体征计算24 h内的APACHE Ⅱ评分,统计患者年龄、性别等基本信息和ICU住院时间、总住院费用以及治疗3 d后死亡状况。
2.7 肺泡灌洗液的采集
操作前了解患者病情、主要病征和生理状态,备好呼吸、血压、心电、氧饱和度检测和急救的器材及药物。术前iv 5 mg咪唑安定,2%利多卡因经气道雾化,行气道局部黏膜麻醉;纤维支气管镜经气管插管插入气管,嵌入右肺中叶或左肺舌叶段支气管管口,注入2~3 mL 2%利多卡因局麻后,用50 mL注射器将37 ℃生理盐水分次注入,每次25~50 mL,总量100~300 mL;注入后立即通过负压吸引装置吸引、回收至硅质灌洗液收集瓶内;回收液用双层无菌纱布滤过,除去黏液,记录总回收液量,装入硅质容器中;灌洗液1500 r/min离心15 min,弃去上清液,PBS洗涤,调整细胞密度为1×106/mL,接种于96孔板,于37℃、5% CO2培养箱中培养。
2.8 观察指标
2.8.1细胞因子分泌 将肺泡灌洗液以涡流法搅拌均匀,10 000×离心5~10 min去除颗粒。将珠瓶涡旋30 s,加入5 mL珠溶液,涡流30 s。使用多通道移液管将50 μL珠状混合物加入96孔板中,加入样品类型特异性缓冲液、样品各25 μL,孵育后清洗磁珠并加入抗体混合物,封闭磁珠,摇床室温孵育30 min;加入50 μL Streptavidin-PE,封闭磁珠,摇床室温孵育30 min;重悬磁珠,加入120 μL读数缓冲液,封闭磁珠,摇床室温孵育30 min。在Luminex 100/200上将标准的期望浓度与每个标准生成的MFI作图,计算细胞因子质量浓度。
2.8.2肺巨噬细胞凋亡 肺泡灌洗液采集后的细胞经0.25%胰蛋白酶消化,调整至细胞密度为5×104/mL,1000×离心5 min,弃上清,加入195 μL Annexin V-FITC结合液重悬细胞,加入5 μL Annexin V-FITC混匀;加入10 μL碘化丙啶(PI)染色液,混匀,室温避光孵育10~20 min,采用流式细胞仪上机检测。
2.9 统计学分析

3 结果
3.1 清肺承气汤活性成分的筛选结果
通过检索TCMSP,得到78个活性成分,其中与大黄相关的化学成分16个,与枳实相关的化学成分22个,与厚朴相关的化学成分2个,与黄连相关的化学成分14个,与半夏相关的化学成分13种,与瓜蒌相关的化学成分11个,见表1。

表1 清肺承气汤活性成分信息
续表1
3.2 清肺承气汤治疗ARDS的潜在靶点筛选
从GeneCards数据库和OMIM数据库共获得ARDS相关靶点476个,从TCMSP数据库筛选清肺承气汤活性成分对应靶点225个,将疾病和活性成分靶点进行交叉筛选获得共同潜在靶点63个,如图1和表2所示。
3.3 清肺承气汤“化合物-疾病-靶点”网络的构建
如图2所示,“化合物-疾病-靶点”网络由110个节点(44个化合物、63个靶点)和324个边缘组成。红色四边形代表ARDS,蓝色六边形代表清肺承气汤,紫色四边形代表化合物,绿色圆圈代表靶点,每条边代表靶点和化合物之间的相互关系,网络图表明清肺承气汤通过多种成分靶向发挥各种治疗作用,体现了中药方剂的特性。网络图中每个节点的度值代表与节点连接的线路的数量,度值越大代表节点越重要。度值越高的化合物和靶点在清肺承气汤治疗ARDS过程中起到的作用越高,见表3。檞皮素与52个靶点相连,通过调节B细胞淋巴瘤/白血病-2(B-cell lymphoma-2,Bcl-2)参与细胞凋亡,通过调控白细胞介素发挥抗炎作用。多个靶点与多个化合物相结合,如Bcl-2、雌激素受体1(estrogen receptor 1,ESR1)、雄激素受体(androgen receptor,AR)分别与7、16、19个化合物结合,在细胞增殖、炎症、细胞凋亡等方面起到关键作用。

图1 清肺承气汤治疗ARDS潜在靶点的韦恩图
3.4 清肺承气汤治疗ARDS潜在靶点的PPI网络构建
将63个潜在靶点通过STRING数据库构建PPI网络图,见图3,PPI图有68个节点和1078条边,其中节点代表蛋白,连线代表蛋白与蛋白之间的相互作用。根据相关靶点间的数量即度值排序,度值越高,其起到的作用越关键,度值前30位的潜在靶点见图4,存在较多与炎症密切相关的靶点,如排名第1位的白细胞介素-6(interleukin 6,IL-6)与巨噬细胞的分泌、肺组织细胞的修复密切相关,MacLaren等[9]发现IL-6可通过激活中性粒细胞,从而介导肝脏分泌大量急性期蛋白,最终促进炎症反应的爆发。

表2 清肺承气汤治疗ARDS潜在靶点相关信息
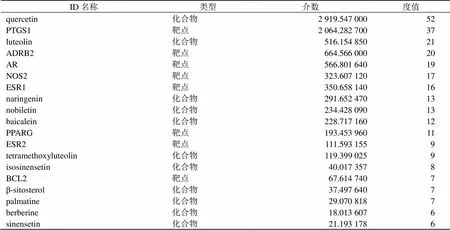
表3 “化合物-疾病-靶点”网络关键点的拓扑学参数
3.5 潜在靶点的KEGG通路分析
通过DAVID平台对63个靶点进行KEGG通路统计,63个潜在靶点映射到78条KEGG通路,与炎症相关的通路27条,包括核因子-κB(nuclear factor-κB,NF-κB)通路、白细胞介素家族通路等;与细胞凋亡作用相关通路11条,包括p53通路、肿瘤坏死因子(tumor necrosis factor,TNF)信号通路等。图5列出了20条最重要的通路。TNF通路、NF-κB通路、T细胞受体通路等与炎症的发生发展和细胞凋亡密切相关。TNF通路属于细胞炎症和细胞凋亡的交互通路[10],既能通过活化NF-κB通路调节白细胞介素家族的分泌,又可通过TNF-α来调控细胞凋亡信号的活化。

图3 潜在靶点的PPI网络图
3.6 清肺承气汤治疗腹腔感染所致ARDS的临床结果
3.6.1 患者一般资料比较 纳入严重腹腔感染所致ARDS患者27例,其中男性19例,女性8例;年龄32~73岁,平均(54.19±14.30)岁;原发病:重症急性胰腺炎20例(74.07%),急性梗阻性化脓性胆管炎5例(18.52%),肠梗阻2例(7.41%);APACHE Ⅱ 12~26分,平均(19.52±7.07)分;3 d后死亡11例,存活16例,存活率59.26%。治疗组患者年龄(55.14±12.89)岁,对照组(53.15±16.15)岁,差异无统计学意义;治疗组男性9例、女性5例,对照组男性10例、女性3例,性别比例无统计学意义;治疗组APACHE Ⅱ(17.36±5.58)分,对照组APACHE Ⅱ(21.84±7.96)分,差异无统计学意义。
3.6.2 2组患者肺泡巨噬细胞凋亡比较 如图6、表4所示,治疗前对照组和治疗组患者肺泡巨噬细胞凋亡无显著差异。与对照组治疗后比较,治疗组患者肺泡巨噬细胞凋亡显著降低(<0.001)。
3.6.3 2组患者肺泡细胞因子水平比较 如表5所示,治疗前2组患者肺泡白细胞介素-4(interleukin 4,IL-4)、IL-6、白细胞介素-10(interleukin 10,IL-10)水平无明显差异,与对照组治疗后比较,治疗组患者肺泡IL-6水平显著升高(<0.05),IL-10水平显著降低(<0.05)。
4 讨论
中药复方具有多成分、多靶点、多功能的特点,如清肺承气汤有6味中药、78个活性成分。网络药理学将多向药理学和生物学结合,对大数据统计分析,在整体上考虑药物与疾病的相关性、系统性和整体性,从活性成分与疾病相互作用靶点出发,反映中药多成分-多靶点的作用关系,为阐明中药的复杂性提供了新的研究思路。本研究采用网络药理学建立“化合物-靶点”网络,分析清肺承气汤中活性成分治疗ARDS的作用机制。
与同组治疗前比较:**<0.01;与对照组治疗后比较:###<0.001
**0.01the same group before treatment;###0.001control group after treatment
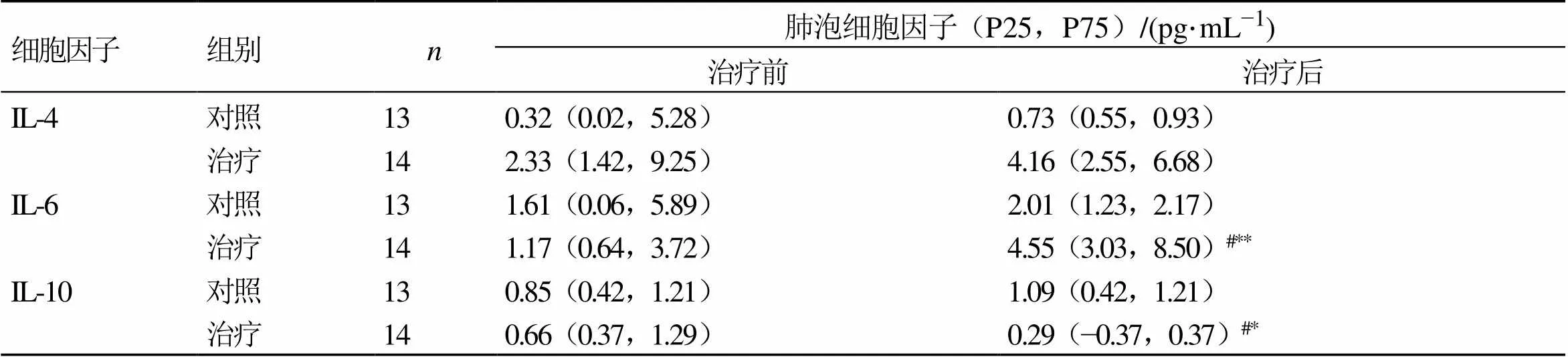
表5 对照组和治疗组患者肺泡细胞因子水平的比较
与同组治疗前比较:*<0.05**<0.01;与对照组治疗后比较:#<0.05
*0.05**0.01the same group before treatment;#0.05control group after treatment
肺泡上皮细胞和毛细血管内皮细胞损伤后,引起过度炎症反应和大量炎症细胞因子分泌,从而引发ARDS。炎症细胞因子是在炎症过程中细胞分泌的小分子蛋白,参与炎症的发生、发展。IL-6主要由T淋巴细胞分泌,部分由单核巨噬细胞合成释放。研究发现,地塞米松可以通过抑制内毒素介导的ARDS小鼠模型IL-6的分泌,从而减轻肺部炎症反应,缓解ARDS的病情发展[11]。TNF超家族由19个家族成员组成。研究发现,ARDS发生过程中,TNF-α表达明显增加。TNF-α与肿瘤坏死因子受体1结合,进而活化NF-κB,上调细胞因子IL-1、IL-8、IL-6的表达,从而导致肺水肿的发生[12-13];转化生长因子β(transforming growth factor β,TGFβ)属于致病性细胞因子,参与急性肺损伤早期发展,可以通过减少肺上皮细胞钠离子的转运,导致肺泡水肿,影响ARDS[14-15];炎症早期,M1巨噬细胞产生IL-1β、IL-6、IL-12等促炎因子,M2巨噬细胞产生抗炎细胞因子IL-10[16];急性肺损伤患者肺泡灌洗液中IL-1β有较高生物活性,可以通过p38 MAPK通路,抑制上皮钠通道,促进炎症发展[17];过氧化物酶体增殖剂激活受体γ(proliferator-activated receptor γ,PPARγ)是核激素受体超家族的成员,其特定的PPARγ受体激动剂罗格列酮可以抑制ARDS的炎症反应,防止细胞损伤[18];趋化因子配体2(CXC chemokine ligand 2,CXCL2)与趋化因子受体4(CXC chemokine receptor 4,CXCR4)结合,加重炎症反应,与肺纤维化后急性炎症的病理发展相关[19-20];鲁斯可皂苷元可通过抑制Toll样受体4(toll-like receptor 4,TLR4)/髓样分化因子88(myeloid differentiation factor 88,MYD88)/NF-κB信号通路保护肺泡上皮细胞,减少ARDS发病过程中的细胞凋亡[10]。
IL-10是肺内重要的内源性调节剂,在ARDS早期属于促炎性细胞因子,可诱导炎症级联反应和一氧化氮合酶的产生,一氧化氮的积累进一步加重ARDS的病情[21-22]。IL-10可通过抑制骨髓干细胞向Ⅱ型肺泡表皮细胞的转化来促进ARDS发展[23]。在ARDS后期,IL-10可通过促进M2型巨噬细胞并抑制M1型巨噬细胞的转化起到炎症修复作用。D'Alessio等[24]发现IL-4可增强ARDS小鼠M2型巨噬细胞分化,促进肺组织修复。本研究临床数据显示清肺承气汤通过调节IL-4、IL-6、IL-10的分泌并抑制肺泡巨噬细胞的凋亡,影响ARDS不同阶段M1和M2型巨噬细胞的分化,促进肺组织修复,从而影响ARDS病情进展。
基于网络药理学分析得出,Bcl-2为“化合物-靶点”网络中度值排前10位的靶点,可以通过其映射的p53通路和凋亡通路下调半胱氨酸蛋白酶3,从而抑制细胞凋亡;TNF信号通路作为KEGG通路排序靠前的通路,为凋亡作用的核心通路。IL-6、IL-10、AR、CXCL8、PPARγ等靶点属于PPI网络及“化合物-靶点”网络度值靠前的靶点,NF-κB、T细胞受体通路、白细胞介素信号通路在KEGG分析中为排序靠前的通路,表明清肺承气汤中的化合物可能调控IL-6、IL-10、AR、CXCL8、PPARγ等多个靶点,以及上述多条炎症通路,调节患者白细胞介素的分泌。
本研究采用了网络药理学,对清肺承气汤治疗腹腔感染所致ARDS患者的临床数据进行了初步的潜在分子机制分析,结果显示,清肺承气汤通过多成分、多靶点、多通路作用于细胞因子和细胞凋亡,从而延缓疾病进展。本研究为ARDS的中西医结合治疗提供了新的思路和治疗靶点,课题组后续将通过动物实验和分子生物学实验对清肺承气汤的具体作用进行深入探究。
利益冲突 所有作者均声明不存在利益冲突
[1] Yadav H, Thompson B T, Gajic O. Fifty years of research in ARDS: Is acute respiratory distress syndrome a preventable disease [J]., 2017, 195(6): 725-736.
[2] 闫丽娜, 傅强, 杜超, 等. 阳明腑实证合并急性肺损伤/急性呼吸窘迫综合征患者预后因素分析: 附206例多中心报告 [J]. 中华危重病急救医学, 2015, 27(7): 548.
[3] 杜超, 傅强, 巩传勇, 等. 肺泡巨噬细胞吞噬功能对腹腔感染致ARDS患者预后的影响: 一项多中心研究 [J]. 中华危重病急救医学, 2019, 31(4): 444-448.
[4] 刘淼, 庞立健, 吕晓东, 等. 急下存阴救阳明, 结者散之疗腑实—白长川教授运用大承气汤治疗热结旁流证经验 [J]. 中国中医急症, 2019, 28(8): 1485-1487.
[5] 徐振东, 付英凯, 张成博, 等. 《中医方剂大辞典》含小陷胸汤类方组方特点与配伍规律分析 [J]. 世界中医药, 2019, 14(7): 1898-1902.
[6] 李静, 傅强, 余杨梓. 清肺承气颗粒对重症急性胰腺炎患者感染期免疫反应的影响 [J]. 山东医药, 2014, 54(8): 9-11.
[7] 张艳敏, 崔乃强, 张淑坤. 清肺承气汤对重症腹腔感染大鼠急性肺损伤的影响 [J]. 中医杂志, 2014, 55(21): 1856-1859.
[8] 高戈, 冯喆, 常志刚, 等. 2012国际严重脓毒症及脓毒性休克诊疗指南 [J]. 中华危重病急救医学, 2013, 25(8): 26-27.
[9] MacLaren R, Stringer K A. Emerging role of anticoagulants and fibrinolytics in the treatment of acute respiratory distress syndrome [J]., 2007, 27(6): 860-73.
[10] Wu Y, Wang Y, Gong S,. Ruscogenin alleviates LPS-induced pulmonary endothelial cell apoptosis by suppressing TLR4 signaling [J]., 2020, 125: 109868.
[11] Qin M, Qiu Z. Changes in TNF-α, IL-6, IL-10 and VEGF in rats with ARDS and the effects of dexamethasone [J]., 2019, 17(1): 383-387.
[12] Yamagata T, Yamagata Y, Nishimoto T,. The regulation of amiloride-sensitive epithelial sodium channels by tumor necrosis factor-alpha in injured lungs and alveolar type II cells [J]., 2009, 166(1): 16-23.
[13] Hamacher J, Lucas R, Lijnen H R,. Tumor necrosis factor-alpha and angiostatin are mediators of endothelial cytotoxicity in bronchoalveolar lavages of patients with acute respiratory distress syndrome [J]., 2002, 166(5): 651-656.
[14] Lucas R, Yue Q, Alli A,. The lectin-like domain of TNF increases ENaC open probability through a novel site at the interface between the second transmembrane and C-terminal domains of the α-subunit [J]., 2016, 291(45): 23440-23451.
[15] Peters Dorothea M, István V, Lukasz W,. TGF-β directs trafficking of the epithelial sodium channel ENaC which has implications for ion and fluid transport in acute lung injury [J]., 2013, 111(3): 374-383.
[16] Wang N, Liang H, Zen K. Molecular mechanisms that influence the macrophage m1-m2 polarization balance [J]., 2014, 5: 614.
[17] Galam L, Soundararajan R, Breitzig M,. SOCS-1 rescues IL-1β-mediated suppression of epithelial sodium channel in mouse lung epithelial cells via ASK-1 [J]., 2016, 7(20): 29081-29091.
[18] Lee S, Kim W, Kang KP,. Agonist of peroxisome proliferator-activated receptor-gamma, rosiglitazone, reduces renal injury and dysfunction in a murine sepsis model [J]., 2005, 20(6): 1057-1065.
[19] Dotan I, Werner L, Vigodman S,. CXCL12 is a constitutive and inflammatory chemokine in the intestinal immune system [J]., 2010, 16(4): 583-92.
[20] Shu H K, Yoon Y, Hong S,. Inhibition of the CXCL12/CXCR4-axis as preventive therapy for radiation-induced pulmonary fibrosis [J]., 2013, 8(11): e79768.
[21] Aisiku I P, Yamal J M, Doshi P,. Plasma cytokines IL-6, IL-8, and IL-10 are associated with the development of acute respiratory distress syndrome in patients with severe traumatic brain injury [J]., 2016, 20(1): 288.
[22] Liu C H, Kuo S W, Ko W J,. Early measurement of IL-10 predicts the outcomes of patients with acute respiratory distress syndrome receiving extracorporeal membrane oxygenation [J]., 2017, 7(1): 1021.
[23] Chen Z, Hu Y, Xiong T,. IL-10 promotes development of acute respiratory distress syndrome via inhibiting differentiation of bone marrow stem cells to alveolar type 2 epithelial cells [J]., 2018, 22(18): 6085-6092.
[24] D'Alessio F R, Craig J M, Singer B D,. Enhanced resolution of experimental ARDS through IL-4-mediated lung macrophage reprogramming [J]., 2016, 310(8): 733-746.
Mechanism of Qingfei Chengqi Decoction on acute respiratory distress syndrome caused by abdominal infection based on network pharmacology and multi-center clinical data
WANG Xin-pei1, WANG Zi-yu2, FU Qiang1,3, DU Chao4, GONG Chuan-yong5, WANG Bing6
1. Graduate School, Tianjin Medical University, Tianjin 300070, China 2. Department of Critical Medicine, Hubei Provincial Hospital of Integrated Traditional Chinese and Western Medicine, Wuhan 430015, China 3. Department of Critical Medicine, Tianjin Fourth Central Hospital, Tianjin 300140, China 4. Emergency Department, The First Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China 5. Department of Critical Medicine, Tianjin Nankai Hospital, Tianjin 300102, China 6. Department of Critical Medicine, Tianjin First Central Hospital, Tianjin 300190, China
To elucidate the underlying molecular mechanism of Qingfei Chengqi Decoction (清肺承气汤) in treatment of patients with acute respiratory distress syndrome (ARDS) caused by abdominal infection using network pharmacology and multi-center clinical data.Through the database of Chinese Medicine System Pharmacology Analysis Platform (TCMSP), the chemical constituents and targets of Qingfei Chengqi Decoction was retrieved. Cytoscape 3.7.1 software was used to establish a “compound-target” network, a predicted protein-protein interaction (PPI) network between predicted targets, and a KEGG enrichment analysis of predicted targets. A total of 27 patients with ARDS due to celiac infection were selected from three hospitals and were randomly divided into Qingfei Chengqi Decoction group (14 cases) and control group (13 cases). Alveolar lavage fluid was taken 3 d before and after treatment; Levels of IL-4, IL-6, IL-10 were detected by microsphere detection; Alveolar macrophage apoptosis was analyzed by flow cytometry.A total of 78 active compounds and 63 potential targets of Qingfei Chengqi Decoction were screened. From “compound-target” network and PPI network, targets ranked the top were PPARγ, Bcl-2, IL-6, IL-10 and INFG; Compounds were quercetin and luteolin. Inflammatory pathways ranked higher in KEGG pathway analysis were NF-κB, TNF signaling pathway, IL-17 pathway and T cell receptor pathway. Compared with control group, level of IL-6 was significantly increased (< 0.05), level of IL-10 was significantly decreased (< 0.05), and apoptotic area of alveolar macrophages was significantly decreased (< 0.001) in Qingfei Chengqi Decoction group.Compounds in Qingfei Chengqi Decoction could regulate multiple signal pathways through targets such as IL-6, Bcl-2, IL-10, and CXCL2 to regulate the secretion of IL-4,IL-6,IL-10 and cell apoptosis to treat ARDS.
Qingfei Chengqi Decoction; abdominal infection; acute respiratory distress syndrome; network pharmacology; quercetin; luteolin; interleukin; apoptosis
R285.6
A
0253 - 2670(2021)02 - 0437 - 10
10.7501/j.issn.0253-2670.2021.02.017
2020-06-06
天津市卫生行业重点攻关项目(15KG121)
王馨培,硕士研究生,研究方向为外科危重症的中西医结合治疗。E-mail: qq563531789@163.com
傅 强 E-mail: 13920864938@163.com
[责任编辑 李亚楠]

