金樱根中1个新的乌苏烷型三萜皂苷
李 斌,彭彩云#,陈钰妍,段淑莉,彭伊玲,Muhammad Danial,王 炜,李顺祥
金樱根中1个新的乌苏烷型三萜皂苷
李 斌1,彭彩云1#,陈钰妍2,段淑莉1,彭伊玲1,Muhammad Danial1,王 炜1*,李顺祥2*
1. 湖南中医药大学药学院 中药民族药物创新发展国际实验室,湖南 长沙 410208 2. 湖南中医药大学药学院 中药活性物质筛选工程中心,湖南 长沙 410208
研究蔷薇科植物金樱子根的化学成分。采用硅胶、Sephadex LH-20、ODS柱色谱、重结晶及半制备液相分离和纯化,根据理化性质和波谱数据鉴定化合物的结构,并运用MTT法对所分离化合物对人宫颈癌HeLa、人胃腺癌BGC823、人结肠癌HCT-116及人肝癌HepG-2细胞的细胞毒活性进行检测。从金樱根乙醇提取物中分离得到了9个化合物,分别鉴定为2α,3β,11α,19α-四羟基乌苏-12-烯-28-羧酸-β吡喃葡萄糖基酯(1)、野鸦椿酸(2)、2α,3β,19α-三羟基乌苏-23-醛-12-烯-28-羧酸-β吡喃葡萄糖基酯(3)、野蔷薇苷(4)、苦莓苷F1(5)、2α,3β,19α-三羟基齐墩果-12-烯-28-羧酸-β吡喃葡萄糖基酯(6)、桦木酸(7)、β-谷甾醇(8)和儿茶素(9);其中化合物7对BGC823及HeLa细胞的半数抑制浓度(IC50)分别为19.0和19.6 μmol/L,化合物8对BGC823及HeLa细胞的IC50分别为16.2和15.8 μmol/L。化合物1为新化合物,命名为金樱子皂苷,化合物3为首次从该植物中分离到,化合物7和8对BGC823及HeLa细胞显示出中等强度的细胞毒活性。
金樱根;蔷薇科;乌苏烷型三萜;金樱子皂苷;桦木酸;细胞毒活性
金樱根为蔷薇科蔷薇属植物金樱子Michx. 的根或根皮,性味酸、涩、平,主要分布于江苏、安徽、湖南等地,有固精、涩肠、止带等功效,主治遗精、久泻、带下等症[1-2]。现代药理学研究表明,其具有抑菌、抗炎、耐缺氧作用[3]。金樱根的化学成分主要为皂苷、黄酮和鞣质类成分[4]。为了更好的开展对金樱根的研究开发和利用,本实验对金樱根化学成分进行深入研究,从其乙醇提取物中分离得到了9个化合物(图1),分别鉴定为2α,3β,11α,19α-四羟基乌苏-12-烯-28-羧酸-β吡喃葡萄糖基酯(2α,3β,11α,19α- tetrahydroxyurs-12-en-28-oic acid-β--glucopyranosyl ester,1)、野鸦椿酸(euscaphic acid,2)、2α,3β-,19α-三羟基乌苏-23-醛-12-烯-28-羧酸-β吡喃葡萄糖基酯(pinfaensin,3)、野蔷薇苷(rosamultin,4)、苦莓苷F1(nigaichigoside F1,5)、2α,3β,19α-三羟基齐墩果-12-烯-28-羧酸-β吡喃葡萄糖基酯(arjunetin,6)、桦木酸(betulic acid,7)、β-谷甾醇(β-sitosterol,8)和儿茶素(catechin,9)。其中,化合物1为新的乌苏烷型三萜皂苷,命名为金樱子皂苷,化合物3为首次从该植物中分离得到。化合物7和8对人宫颈癌HeLa及人胃腺癌BGC823细胞显示出中等强度的细胞毒活性。
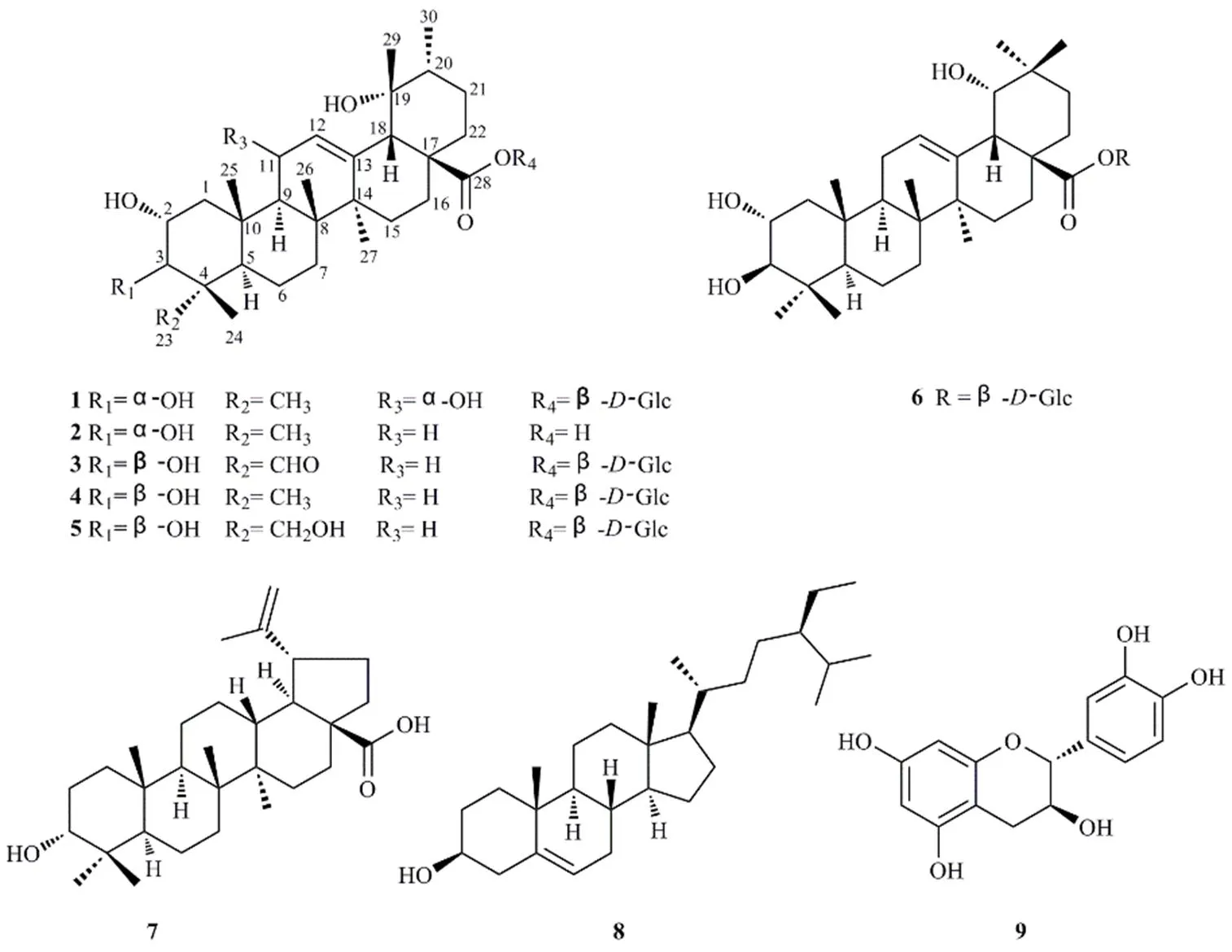
图1 化合物1~9的结构
1 仪器与材料
RE-52AA旋转蒸发仪(上海亚荣生化仪器厂);Agilent Series 1100 SL质谱仪(美国安捷伦科技公司);BRUKER-500超导核磁共振仪(美国Bruker公司);Agilent 1260高效液相色谱仪;Nicolet-iS5红外光谱仪(美国赛默飞科技公司);G1314F型紫外可见光检测仪(美国安捷伦科技公司);ZORBAX SB-C18半制备柱(150 mm×9.4 mm,5 µm,安捷伦科技);薄层色谱硅胶G、GF254(青岛海洋化工厂);柱色谱硅胶(100~200、200~300目,青岛海洋化工厂);SephadexTMLH-20(瑞典GE Healthcare Bio-Sciences AB公司);石油醚、二氯甲烷、氯仿、醋酸乙酯、乙醇、甲醇(分析纯,天津恒兴试剂厂);甲醇、乙腈(色谱纯,Tedia)。
人宫颈癌HeLa、人胃腺癌BGC823、人结肠癌HCT-116、及人肝癌HepG2细胞株购自中南大学湘雅中心实验室细胞库。改良型的DMEM高葡萄糖培养基(Hyclone公司),胎牛血清、胰蛋白酶(Gibco公司),四甲基偶氮唑盐(MTT)和其他化学物质购自中国SolarBio公司。
药材于2012年2月采自湖南岳阳,经湖南中医药大学中药资源教研室王智讲师鉴定为蔷薇科蔷薇属植物金樱子Michx. 的根。
2 提取与分离
金樱根17 kg,粉碎成粗粉,以95%乙醇冷浸提取3次,醇提液减压回收溶剂得浓缩液,浓缩液用少量水分散后,分别用二氯甲烷、醋酸乙酯、正丁醇进行萃取。二氯甲烷萃取部位(75 g)经过胶柱色谱,以石油醚-醋酸乙酯(1∶0~1∶1~0∶1)梯度洗脱,得到7个流分(Fr. 1~7),Fr. 3经氯仿反复重结晶,得白色针状结晶,为化合物8(20 mg)。Fr. 5经反复硅胶柱色谱,石油醚-醋酸乙酯(20∶1~5∶1)梯度洗脱得到化合物7(13 mg)。Fr. 7经硅胶柱色谱,氯仿-甲醇(60∶1~10∶1)梯度洗脱,再经Sephadex LH-20柱色谱,氯仿-甲醇(1∶1)洗脱及制备薄层色谱,得到化合物2(8 mg)。醋酸乙酯浸膏(200 g),经硅胶柱色谱,石油醚-醋酸乙酯(10∶1~0∶1)~醋酸乙酯-甲醇(1∶0~0∶1)梯度洗脱,得到10个流分(Fr. 8~17)。Fr. 13经Sephadex LH-20柱色谱,甲醇-水(8∶2)洗脱和甲醇反复重结晶后,得化合物9(42 mg)。Fr. 14经ODS柱色谱,甲醇-水(4∶6~1∶0)梯度洗脱,再经Sephadex LH-20柱色谱,甲醇-水(1∶1)洗脱,半制备高效液相色谱以37%乙腈洗脱,得到化合物1(1 mg)、3(1 mg)、6(3 mg)和4(2 mg)。Fr. 16经反相硅胶柱色谱,甲醇-水(1∶1~1∶0)梯度洗脱,再经Sephadex LH-20柱色谱,以甲醇-水(1∶1)洗脱,半制备高效液相色谱以70%甲醇洗脱,得到化合物5(5 mg)。
3 结构鉴定

表1 化合物1的核磁共振氢谱和碳谱数据
化合物1的平面结构进一步通过1H-1H COSY和HMBC谱的解析得到确认:1H-1H COSY谱中观察到H-1/H-2/H-3、H-5/H-6/H-7、H-9/H-11/ H-12、H-15/H-16、H-20/H-21/H-22之间的相关(图2)。HMBC谱中观察到H5.32 (H-1′) 与C-28 (C178.4)相关,表明β-吡喃葡萄糖基与28-羧基成酯苷,HMBC谱中还观察到CH3-23、CH3-24与C-3、C-4、C-5分别相关;CH3-25与C-1、C-5、C-9、C-10相关;CH3-26与C-7、C-8、C-9、C-14相关;CH3-27与C-8、C-13、C-14、C-15相关;CH3-29与C-18、C-19、C-20相关;CH3-30与C-19、C-20、C-21相关,这些相关峰证实了各甲基的连接位置;HMBC谱中H-1、H-3与C-2,H-3与C-2、C-4、C-23、C-24,H-11与C-9、C-12、C-13,H-18、H-29、H-30与C-19的相关分别证实了有4个羟基分别连在C-2、C-3、C-11及C-19上(图2);此外,H-12与C-13、C-14、C-18之间的HMBC相关证实了双键位于C-12、C-13之间。

图2 化合物1的关键1H-1H COSY、HMBC相关(a) 及ROESY相关(b)
化合物1的立体构型由ROESY谱确定,ROESY谱中H-2与CH3-24 (H0.81)、CH3-25 (H1.11) 相关,H-11与CH3-25 (H1.11)、CH3-26 (H0.80) 相关,H-18与CH3-29 (H1.34)(图2)相关证实了H-2、H-11和CH3-29为β-取向;H-3、H-5与CH3-23 (H1.01) 相关证实H-3为α-取向。因此鉴定化合物1的结构为2α,3β,11α,19α-四羟基乌苏- 12烯-28-羧酸-β吡喃葡萄糖基酯,为1个新化合物,命名为金樱子皂苷。
化合物2:白色无定形粉末(甲醇)。1H-NMR (500 MHz, CD3OD): 1.34 (3H, s, CH3-27), 1.19 (3H, s, CH3-29), 0.98 (6H, s, CH3-23, 25), 0.87 (3H, s, CH3-24), 0.78 (3H, s, CH3-26), 0.92 (3H, d,= 6.7 Hz, CH3-30), 5.29 (1H, t,= 3.6 Hz, H-12), 3.93 (1H, m, H-2), 3.32 (1H, m, H-3);13C-NMR (125 MHz, CD3OD): 42.5 (C-1), 67.2 (C-2), 80.1 (C-3), 41.2 (C-4), 49.3 (C-5), 24.9 (C-6), 34.0 (C-7), 39.4 (C-8), 48.2 (C-9), 39.4 (C-10), 27.3 (C-11), 129.3 (C-12), 140.0 (C-13), 42.7 (C-14), 29.6 (C-15), 26.6 (C-16), 49.0 (C-17), 55.1 (C-18), 73.6 (C-19), 43.1 (C-20), 19.3 (C-21), 39.0 (C-22), 29.2 (C-23), 22.4 (C-24), 17.5 (C-25), 16.6 (C-26), 27.1 (C-27), 182.4 (C-28), 24.7 (C-29), 16.9 (C-30)。以上数据与文献对照基本一致[5],故鉴定化合物2为野鸦椿酸。
化合物3:白色无定形粉末(甲醇),1H-NMR (500 MHz, CD3OD): 1.35 (3H, s, CH3-27), 0.93 (3H, d,= 6.7 Hz, CH3-30), 1.20 (3H, s, CH3-29), 1.04 (3H, s, CH3-24), 1.06 (3H, s, CH3-25), 0.77 (3H, s, CH3-26), 9.29 (1H, s, CHO-23), 5.31 (1H, m, overlapped, H-12), 5.32 (1H, d,= 8.1 Hz, H-1′);13C-NMR (125 MHz, CD3OD): 48.0 (C-1), 68.9 (C-2), 77.6 (C-3), 57.1 (C-4), 49.3 (C-5), 21.4 (C-6), 33.4 (C-7), 41.3 (C-8), 48.5 (C-9), 39.1 (C-10), 24.7 (C-11), 129.2 (C-12), 139.8 (C-13), 42.8 (C-14), 29.6 (C-15), 27.0 (C-16), 49.6 (C-17), 55.0 (C-18), 73.6 (C-19), 42.9 (C-20), 27.2 (C-21), 38.3 (C-22), 207.4 (C-23), 10.4 (C-24), 17.4 (C-25), 17.6 (C-26), 24.8 (C-27), 178.5 (C-28), 26.5 (C-29), 16.6 (C-30), 95.8 (C-1′), 73.6 (C-2′), 78.3 (C-3′), 71.2 (C-4′), 78.6 (C-5′), 62.4 (C-6′)。以上数据与文献对照基本一致[6],故鉴定化合物3为2α,3β,19α-三羟基乌苏-23-醛-12-烯-28-羧酸-β吡喃葡萄糖基酯。
化合物4:白色无定形粉末(甲醇),1H-NMR (500 MHz, CD3OD): 1.33 (3H, s, CH3-27), 1.20 (3H, s, CH3-29), 1.00 (3H, s, CH3-25), 0.93 (3H, d,= 6.7 Hz, CH3-30), 0.80 (3H, s, CH3-24), 0.77 (3H, s, CH3-26), 5.30 (1H, m, overlapped, H-12), 5.31 (1H, d,= 8.1 Hz, H-1′);13C-NMR (125 MHz, CD3OD): 48.2 (C-1), 69.5 (C-2), 84.5 (C-3), 39.2 (C-4), 56.7 (C-5), 19.7 (C-6), 34.1 (C-7), 41.3 (C-8), 49.4 (C-9), 40.5 (C-10), 24.7 (C-11), 129.5 (C-12), 139.7 (C-13), 42.9 (C-14), 29.6 (C-15), 26.5 (C-16), 48.6 (C-17), 54.9 (C-18), 73.6 (C-19), 42.7 (C-20), 27.2 (C-21), 38.3 (C-22), 29.3 (C-23), 17.5 (C-24), 17.1 (C-25), 17.1 (C-26), 24.8 (C-27), 178.5 (C-28), 27.1 (C-29), 16.6 (C-30), 95.8 (C-1′), 73.8 (C-2′), 78.3 (C-3′), 71.1 (C-4′), 78.5 (C-5′), 62.4 (C-6′)。以上波谱数据与文献报道基本一致[5],故鉴定化合物4为野蔷薇苷。
化合物5:白色无定形粉末(甲醇)。1H-NMR (500 MHz, CD3OD): 1.34 (3H, s, CH3-27), 1.20 (3H, s, CH3-29), 1.03 (3H, s, CH3-25), 0.93 (3H, d,= 6.7 Hz, CH3-30), 0.78 (3H, s, CH3-26), 0.70 (3H, s, CH3-24), 5.31 (1H, overlapped, H-12), 5.32 (1H, d,= 8.1 Hz, H-1′);13C-NMR (125 MHz, CD3OD): 48.8 (C-1), 69.7 (C-2), 76.3 (C-3), 44.1 (C-4), 49.5 (C-5), 19.2 (C-6), 33.5 (C-7), 41.3 (C-8), 48.5 (C-9), 39.0 (C-10), 24.8 (C-11), 129.5 (C-12), 139.7 (C-13), 42.8 (C-14), 29.6 (C-15), 26.5 (C-16), 48.2 (C-17), 55.0 (C-18), 73.6 (C-19), 42.9 (C-20), 27.2 (C-21), 38.3 (C-22), 66.4 (C-23), 13.9 (C-24), 17.7 (C-25), 17.6 (C-26), 24.7 (C-27), 178.5 (C-28), 27.1 (C-29), 16.6 (C-30), 95.8 (C-1′), 73.9 (C-2′), 78.3 (C-3′), 71.1 (C-4′), 78.3 (C-5′), 62.4 (C-6′)。以上波谱数据与文献报道基本一致[7],故鉴定化合物5为苦莓苷F1。
化合物6:白色无定形粉末(甲醇)。1H-NMR (500 MHz, CD3OD): 1.29 (3H, s, CH3-27), 1.00 (3H, s, CH3-23), 0.99 (3H, s, CH3-25), 0.94 (3H, s, CH3-30), 0.93 (3H, s, CH3-29), 0.80 (3H, s, CH3-24), 0.74 (3H, s, CH3-26), 5.33 (1H, t,= 3.9 Hz, H-12), 5.37 (1H, d,= 8.1 Hz, H-1′);13C-NMR (125 MHz, CD3OD): 48.1 (C-1), 69.5 (C-2), 84.5 (C-3), 40.5 (C-4), 56.8 (C-5), 19.7 (C-6), 33.3 (C-7), 40.9 (C-8), 49.2 (C-9), 39.4 (C-10), 25.0 (C-11), 124.8 (C-12), 144.4 (C-13), 42.7 (C-14), 29.4 (C-15), 28.6 (C-16), 47.1 (C-17), 45.1 (C-18), 82.4 (C-19), 36.0 (C-20), 29.5 (C-21), 33.8 (C-22), 28.6 (C-23), 17.8 (C-24), 17.4 (C-25), 17.0 (C-26), 24.9 (C-27), 178.5 (C-28), 29.3 (C-29), 25.2 (C-30), 95.8 (C-1′), 73.9 (C-2′), 78.7 (C-3′), 71.1 (C-4′), 78.3 (C-5′), 62.4 (C-6′)。以上波谱数据与文献对照基本一致[5],故鉴定化合物6为2α,3β,19α-三羟基齐墩果-12-烯-28-羧酸-β吡喃葡萄糖基酯。
化合物7:无色蜡状物。1H-NMR (500 MHz, CD3OD): 2.10 (3H, s, CH3-30), 1.53 (3H, s, CH3-24), 1.38 (3H, s, CH3-27), 1.36 (3H, s, CH3-26), 1.31 (3H, s, CH3-23), 1.13 (3H, s, CH3-25), 5.25 (1H, m, H-29a), 5.08 (1H, m, H-29b), 3.83 (1H, m, H-18);13C-NMR (125 MHz, CD3OD): 38.6 (C-1), 28.6 (C-2), 78.5 (C-3), 39.9 (C-4), 56.3 (C-5), 19.1 (C-6), 35.2 (C-7), 41.5 (C-8), 51.3 (C-9), 37.9 (C-10), 21.6 (C-11), 26.5 (C-12), 39.3 (C-13), 43.2 (C-14), 30.6 (C-15), 33.2 (C-16), 57.0 (C-17), 48.1 (C-18), 50.1 (C-19), 151.6 (C-20), 31.6 (C-21), 37.9 (C-22), 29.0 (C-23), 16.8 (C-24), 16.7 (C-25), 16.8 (C-26), 15.3 (C-27), 179.2 (C-28), 110.3 (C-29), 19.8 (C-30);以上波谱数据与文献报道基本一致[8],故鉴定化合物7为桦木酸。
化合物8:无色针状结晶(氯仿),10%硫酸-乙醇显紫红色,与β-谷甾醇对照品混合熔点不下降,Rf值在多种展开剂系统中与对照品一致,故鉴定化合物8为β-谷甾醇。
化合物9:淡黄色结晶(甲醇)。1H-NMR (500 MHz, CD3OD): 5.93 (1H, d,= 2.3 Hz, H-8), 5.86 (1H, d,= 2.3 Hz, H-6), 6.83 (1H, d,= 2.0 Hz, H-2′), 6.76 (1H, d,= 8.1 Hz, H-5′), 6.71 (1H, d,= 8.1, 2.0 Hz, H-6′), 4.56 (1H, d,= 7.5 Hz, H-2), 3.97 (1H, td,= 7.9, 5.4 Hz, H-3), 2.84 (1H, dd,= 16.1, 5.4 Hz, H-4a), 2.50 (1H, dd,= 16.1, 8.1 Hz, H-4b);13C-NMR (125 MHz, CD3OD): 81.4 (C-2), 67.4 (C-3), 27.1 (C-4), 156.1 (C-5), 94.1 (C-6), 156.4 (C-7), 94.9 (C-8), 155.5 (C-9), 99.4 (C-10), 130.8 (C-1′), 113.8 (C-2′), 144.8 (C-3′), 144.8 (C-4′), 114.7 (C-5′), 118.6 (C-6′)。以上波谱数据与文献对照基本一致[9],故鉴定化合物9为儿茶素。
4 细胞毒活性测试
采用MTT法测试化合物1~9对4种肿瘤细胞(HeLa、BGC823、HCT-116、HepG2细胞)的细胞毒活性。肿瘤细胞培养于含10%胎牛血清的DMEM培养基中,待细胞生长至培养瓶底90%左右,用适量0.25%胰蛋白酶将细胞消化,并按100 μL/孔(6×103个/mL)接种于96孔板中,置于37 ℃、5% CO2培养箱中培养24 h后,向孔里分别加入100 μL化合物1~9(浓度梯度为25、20、15、12.5、10、7.5、5.0、2.5 μmol/L),紫杉醇为阳性对照组,在37 ℃、5% CO2培养箱培养48 h后弃去培养液,每孔加入100 μL含0.5 mg/mL MTT的细胞培养液,置培养箱继续培养4 h,用酶标仪检测波长490 nm处的吸光度(),实验重复3次,计算半数抑制浓度(IC50)。结果表明,化合物7对BGC823及Hela细胞的IC50分别为19.0、19.6 μmol/L,化合物8对BGC823及HeLa细胞的IC50值分别为16.2、15.8 μmol/L,其他化合物在25 μmol/L未检测出细胞毒活性。
5 讨论
本研究通过植物化学方法,从金樱根中分离到9个化合物,包括1个新的乌苏烷型三萜皂苷,对所分离成分进行了细胞毒性筛选,化合物7和8对BGC823及HeLa细胞显示出一定的细胞毒作用,该研究可为金樱根的质量标准提升、进一步开发和应用提供一定的实验依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 江苏新医学院. 中药大辞典(上册) [M]. 上海: 上海人民出版社, 2005: 1977.
[2] 国家中医药管理局《中华本草》编委会. 中华本草[M]. 上海: 上海科学技术出版社, 2000: 226.
[3] Yuan J Q, Yang X Z, Miao J H,. New triterpene glucosides from the roots ofMichx [J]., 2008, 13(9): 2229-2237.
[4] 代华年, 马国需, 邹节明, 等. 金樱子根三萜类的化学成分研究 [J]. 中草药, 2016, 47(3): 374-378.
[5] 吴小鹏, 黄小燕, 张小坡, 等. 小果蔷薇中三萜类化学成分研究 [J]. 中草药, 2014, 45(5): 626-630.
[6] Durham D G, Liu X, Richards R M. A triterpene from[J]., 1994, 36(6): 1469-1472.
[7] Wu Z J, Ouyang M G, Wang C Z,. Anti-tobacco mosaic virus (TMV) triterpenoid saponins from the leaves of[J]., 2007, 55(5): 1712-1717.
[8] 刘书霞, 李振麟, 兰太进, 等. 石崖茶的化学成分研究 [J]. 中草药, 2016, 47(14): 2436-2440.
[9] 张思巨, 王怡薇, 刘丽, 等. 锁阳化学成分研究II [J]. 中国药学杂志, 2007, 42(13): 975-977.
A ursane type triterpenoid glycoside from roots of
LI Bin1, PENG Cai-yun1, CHEN Yu-yan2, DUAN Shu-li1, PENG Yi-ling1, MUHAMMAD Danial1, WANG Wei1, LI Shun-xiang2
1. TCM and Ethnomedicine Innovation & Development International Laboratory, School of Pharmacy, Hunan University of Chinese Medicine, Changsha 410208, China 2. Hunan Engineering Research Center of Bioactive Substance Discovery of Chinese Medicine, School of Pharmacy, Hunan University of Chinese Medicine, Changsha 410208, China
To isolate and elucidate the constituents of the roots of.The constituents were isolated by chromatography on silica gel, Sephadex LH-20, ODS, semi-preparation HPLC and recrystallization. The structures were elucidated based on the chemical evidence and spectroscopic data, and all compounds were evaluated for cytotoxic activity on Hela, BGC 823, HCT-116 and HepG-2 cells by MTT assay.Nine compounds were obtained: 2α,3β,11α,19α-tetra hydroxyurs-12-en-28-oic acid-β--glucopyranosyl ester (1), euscaphic acid (2), pinfaensin (3), rosamultin (4), niga-ichigoside F1 (5), arjunetin (6), betulic acid (7), β-sitosterol (8), catechin (9). Compounds 7 and 8 showed cytotoxicities against human gastric cancer cells (BGC 823) with the IC50values of 19.0 and 16.2 μmol/L, respectively, and on human cervical cancer cell lines (Hela) with the IC50value of 19.6 and 15.8 μmol/L, respectively.Compound 1 is a new triterpenoid glycoside and named as rosalaevioside, compound 3 is isolated fromfor the first time, 7 and 8 show moderate cytotoxicities against BGC823 and Hela cells.
Michx.; Rosaceae; ursane-type triterpenoid glycoside; rosalaevioside;betulic acid; cytotoxicity
R284.1
A
0253 - 2670(2021)02 - 0335 - 06
10.7501/j.issn.0253-2670.2021.02.005
2020-08-04
湖南省自然科学基金项目(2016JJ6118);湖南省中医药管理局中医科研项目(201673);侗医药研究湖南省重点实验室平台建设(2017CT5025);湖南中医药大学中药学开放基金项目(ZY201503)
李 斌,博士,女,副教授,从事中药民族药物药效物质基础及分析研究。E-mail: libin-hucm@qq.com
李顺祥,博士,教授,博士生导师,从事中药化学与资源研究。E-mail: lishunxiang@hotmail.com
王 炜,博士,教授,博士研究生导师,从事中药民族药药效物质基础研究。E-mail: wangwei402@hotmail.com
#并列第一作者:彭彩云,硕士,教授,硕士研究生导师,从事中药民族药药效物质基础研究。E-mail: caiyunpeng-hucm@qq.com
[责任编辑 王文倩]

