外源5-氨基乙酰丙酸对盐胁迫下玉米种子萌发及幼苗生长的影响
张嘉祥 国一凡 张梅
摘要:为探究外源5-氨基乙酰丙酸(ALA)对盐胁迫下玉米种子萌发及幼苗生长的影响,试验以‘金海5号’作为试验材料,设置NaCl浓度100 mmol/L模拟盐胁迫,5-氨基乙酰丙酸浓度为0、25、50、100、200 mg/L,处理种子和幼苗,测定种子发芽率、种子活力以及幼苗丙二醛(MDA)、可溶性糖、脯氨酸和叶绿素含量,并对这些生理生化指标进行分析。结果表明,盐胁迫下玉米种子萌发和幼苗生长均受到不同程度的抑制,而施用5-氨基乙酰丙酸明显降低了植物的盐害水平,增强了种子活力,并提高了幼苗中有关抗逆性物质的含量。其中,当5-氨基乙酰丙酸浓度为25 mg/L时,对种子萌发,以及幼苗生长发育有较好的促进作用,明显优于其它处理。实验结论,以期为今后玉米生产实践提供参考和借鉴。
关键词:5-氨基乙酰丙酸(ALA);玉米;盐胁迫;种子萌发;幼苗生长发育
中图分类号:S513文献标志码:A论文编号:cjas20191000231
Effects of 5-Aminolevulinic Acid on Seed Germination and Seedling Growth of Maize Under Salt Stress
Zhang Jiaxiang, Guo Yifan, Zhang Mei
(China Agricultural University, Yantai 264670, Shandong, China)
Abstract: The purpose is to explore the effects of ALA on maize seed germination and seedling growth under salt stress.‘Jinhai 5’was selected as the experimental material, NaCl concentration was set at 100 mmol/L, and ALA concentration gradient was set at 0, 25, 50, 100 and 200 mg/L. The seeds and seedlings were treated to determine the germination rate and seed vigor, and the content of MDA, soluble sugar, proline and chlorophyll, and to analyze the physiological and biochemical indexes. The results showed that maize seed germination and seedling growth were inhibited to varying degrees under salt stress, while the application of ALA significantly reduced the level of plant salt damage, enhanced seed vigor, and increased the content of stress-resistant substances in seedlings. Among them, when the concentration of ALA was 25 mg/L, seed germination, seedling growth and development could be promoted, and the effect was significantly better than that of other treatments
Keywords:5-aminolevulinicAcid(ALA),Maize,SaltStress,SeedGermination,SeedlingGrowthandDevelopment
0引言
土壤盐渍化问题是农业生产中面临的巨大危机,中国耕地盐渍化面积有920.9万hm2,占全国耕地面积的6.62%[1]。由于不合理的灌溉和水肥等因素,盐渍化问题还在不断加深,因此造成的经济损失也不断增加。种子萌发期对环境变化和逆境信号的感应最为敏感,同样也是植物适应环境变化进行生理调节的活跃期[2]。所以,在萌发期通过调控措施解除盐胁迫,对种子能否正常萌发尤为重要,并对萌发后的生长阶段也有很大影响。而植物在生长发育期受到盐胁迫,会导致渗透胁迫、离子失调、膜透性改变及代谢紊乱等问题,会使植物生长矮小,叶色暗绿或变黄,营养器官发育受阻,严重时导致植物盐害或脱水死亡。因此,在农业生产中,调控措施的运用能显著提高植物抗盐性、产品产量和品质,帮助减少植物损害和经济损失。玉米作为重要的粮食作物,在我国乃至世界农业中占比很高,而盐胁迫是近年来越发影响玉米生长发育及产量品质的一个重要因素,因此,通过调控来缓解甚至提高玉米在盐胁迫环境下的生长发育状况,对我国农业生产以及经济提高有不可忽视的作用。已有研究表明,NaCl胁迫明显抑制了玉米种子的萌发,其强度随NaCl浓度的增加而增强[3]。玉米苗期受到盐害后,植株表现出矮小瘦弱,分蘖少,叶片狭窄发黄的现象,若长时间受到盐胁迫或盐胁迫水平过高,会使叶片卷曲枯萎甚至死亡[4]。
5-氨基乙酰丙酸,作为细胞内生物合成的一种前體物质,普遍分布于各类生物体内,由于其能参与合成叶绿素,很早就受到重视。近年来,有研究表明外源5-氨基乙酰丙酸不仅能影响植物的光合作用,还能在高浓度时用作无污染的除草剂,在低浓度下提高作物产量[5]。对于逆境胁迫下的植物,它能参与细胞渗透调节、活性氧(Ros)代谢及植物光合特性等生理进程的调控,并作为一种植物生长调节剂间接影响植物多种生理进程[6]。Watanabe等[7]证实,外源5-氨基乙酰丙酸对高盐胁迫下棉花抗盐性的提高作用明显。Wang等[8]认为外源5-氨基乙酰丙酸有利于转化卟啉化合物亚铁血红素,促进小白菜种子在高盐环境下萌发。对于外源5-氨基乙酰丙酸在提高玉米抗逆性方面,孙阳[9]等通过研究认为,外源5-氨基乙酰丙酸能从多个生理进程方面促进低温下幼苗生长。关于外源5-氨基乙酰丙酸对玉米抗盐性方面的研究鲜有报道,故本实验以玉米为实验材料,创造盐胁迫环境,并施用不同浓度的外源5-氨基乙酰丙酸,探究玉米种子及幼苗在其作用下的萌发和生长发育状态,并通过分析与抗逆性有关的若干生理生化指标,为外源5-氨基乙酰丙酸在生产中合理高效应用及提高玉米抗盐性提供依据。
1材料与方法
1.1试验材料
玉米‘金海5号’,购于烟台市农资种子公司。
1.2试验设计
1.2.1种子萌发试验根据预实验结果,选择100mmol/L的NaCl浓度,设置6个外源5-氨基乙酰丙酸浓度梯度:0、10、25、50、100、200 mg/L(T1~T6),并额外设置一组双空白对照组CK。挑选健壮、饱满、胚完整且大小一致的玉米种子,加入盛有相应处理液(CK、T1~T6)的烧杯内,于50℃的温度下温汤浸种15 min,随后在室温下继续浸泡种子24 h。浸种结束后,将种子放入铺有单层滤纸的培养皿内(30粒/皿),加入适量处理液(处理液浸透滤纸,水层可见但不浸没种子的一半),于室温下进行发芽。每日定时定量补充蒸馏水,保证ALA和NaCl浓度恒定。2天测发芽势,以种子白露顶出种皮为萌发标准;6天测发芽率,以芽长为种子一半为发芽标准;最终进行种子活力的计算,试验设置三组重复。
1.2.2幼苗生长发育试验选取玉米种子,将其种植于实验盆内,土壤选取营养土,每盆定苗7株。以每三日每盆50 mL的浇水量,将玉米培养至三叶一心时期。随后开始施用不同浓度ALA处理液并进行盐胁迫处理,胁迫处理一周后测量MDA、可溶性糖、叶绿素和脯氨酸的含量。试验设置三组重复。

1.3.2幼苗生理参数用硫代巴比妥酸(TBA)检测法测定MDA和可溶性糖含量,磺基水杨酸法测定植物体内游离脯氨酸含量,用乙醇提取叶绿素并通过比色法测定叶片叶绿素含量。
1.4数据处理
试验运用Microsoft Excel 2007进行数据统计及绘图,用IBM SPSS Statistics 20对数据进行统计分析。
2结果与分析
2.1不同浓度ALA对玉米种子萌发的影响
由图1可以看出,玉米种子在不同处理下,发芽势的变化非常明显,而发芽率在施用ALA的处理中变化不大。在经过T1处理后,玉米种子的发芽势、发芽率相较于对照组明显降低,其中发芽势从CK的54.4%降低为T1的28.9%,发芽率从CK的94.4%降低到T1的71.1%。说明NaCl的存在明显抑制了种子的萌发。经过ALA处理后,T2~T6的发芽势都有了不同程度的提高,呈先升后降的趋势。在T3处理时发芽势达最高的72.2%,随后不断下降到T5的41.1%和T6的38.9%,两者均显著高于未经ALA处理的T1(P<0.05),但低于对照组CK。发芽率的趋势也是先升后降,在T4处理下发芽率达最高的97.8%,但与CK、T2和T3相比不显著(P>0.05)。在T6处理下降低至81.1%,虽仍然显著高于T1却低于CK。说明10 mg/L到50 mg/L的浓度范围内,ALA能普遍提高种子的发芽率,使其恢复至对照组水平。
活力指数的变化趋势为先升后降。在NaCl处理下,活力指数显著降低,施用ALA后,活力指数升高,在T3处理下达最大值9.65,之后随ALA浓度提高而降低。在所有处理中,仅有T3处理的活力指数显著大于CK和T1,T2和T4高于T1但不显著,T6低于T1但不显著,T5显著低于T1。说明在T3浓度下,种子根系生长速度快,发芽速率快,使活力指数较高。

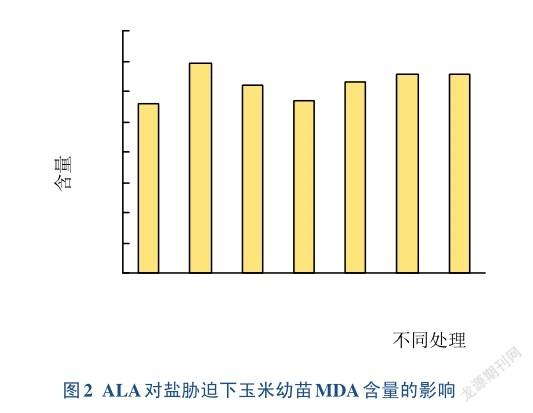
2.2不同浓度ALA对玉米幼苗MDA含量的影响
MDA是膜脂过氧化重要产物,能反映膜系统受损程度以及植物抗逆性。由图2可以看出,经过不同处理后的玉米叶片MDA量也产生了不同变化。在对照处理CK下的MDA量最低(5.57 nmol/g),在经过NaCl处理后,T1的MDA含量迅速升高到最大值(6.95nmol/g),与其他所有处理有显著差异。经ALA处理后,MDA含量先下降后升高,但T2~T6处理下MDA浓度均显著低于T1浓度,其中T3处理下MDA浓度为5.68 nmol/g,显著低于NaCl胁迫下其它处理组的浓度(P<0.05),略高与CK,差异不显著。随后T4~T6处理下MDA重新升高至6.55和6.57 nmol/g,但均显著低于T1处理。说明盐胁迫下MDA的含量增加,而ALA能帮助保护膜结构,降低MDA含量。
2.3不同浓度ALA对可溶性糖含量的影响
可溶性糖是一类渗透调节物质,并能起到保护细胞膜的作用,其在胁迫环境下会主动积累,提高作物抗盐性。由图3看出,经ALA处理后可溶性糖含量提高,整体趋势先升后降。与CK(0.0476 mmol/g)相比,T1處理可溶性糖含量显著上升(0.0540 mmol/g),在T3处理时达最高(0.0715 mmol/g),显著高于其他处理组。随后可溶性糖含量下降,到T5时已恢复到盐胁迫T1的水平(与T1差异不显著)。说明ALA能促进可溶性糖积累,降低细胞渗透势。
2.4不同浓度ALA对玉米幼苗叶绿素含量的影响
图4图像变化也呈先升后降趋势,在受到NaCl胁迫时叶绿素有显著下降(T1处理下叶绿素含量为2.06 mg/g),随后在ALA的处理下叶绿素含量开始升高,在T3处理下达到最值后开始下降(其中叶绿素含量为2.92 mg/g)。总体来看,经过ALA处理后叶绿素含量提升,并普遍显著高于盐胁迫水平,恢复到对照组水平,其中T3、T4处理下显著高于对照组。作为合成叶绿素的前体物质,适量施用ALA,能帮助盐胁迫下的玉米叶绿素含量恢复到CK水平,帮助玉米幼苗在逆境下保持正常的光合作用和生长状态,减少经济损失。


2.5不同浓度ALA对玉米幼苗脯氨酸含量的影响
作为最重要和有效的有机渗透调节物质,细胞在绝大多数逆境下都会主动进行脯氨酸的积累,从而保护细胞膜和降低细胞渗透势。从图5中可以看出,CK处理下的脯氨酸含量最低(48.53μg/g),明显低于其他所有处理组的含量。在NaCl处理后,玉米叶片中的脯氨酸含量上升非常显著,达到了84.14μg/g,相比CK提升了73.4%。随着ALA施用的浓度不断增加,脯氨酸含量首先升高到T3处理下的最高值141.98μg/g,随后其含量开始下降,最终在T5和T6处理下降至91.12、78.54μg/g,与T1差异已经不显著。经过适量的ALA处理,脯氨酸含量大幅增加,帮助作物提高抗盐性。

3結论与讨论
植物种子萌发期和幼苗期是植物生长史中两个重要阶段,萌发期的外界环境直接导致了种子能否正常生根发芽,而幼苗期植物生长状况的优劣直接影响到植物体后期的生长发育和形态建成,从而影响到产量和品质[10]。ALA作为多种合成进程中的一种前体物质,兼具生物调节剂的功能,其缓解盐胁迫的作用方式是多方面且复杂的,本实验为了更为具体的探究不同浓度的ALA处理下对玉米盐胁迫的缓解作用,选择了多个生理指标进行检测。结果证明,ALA对玉米在种子萌发期或幼苗生长期受到的盐胁迫有一定的缓解作用,这些作用包括提高了种子发芽势和发芽率,进而提高了种子活力指数,并提高了幼苗体内的MDA、可溶性糖、叶绿素和脯氨酸含量。
3.1 ALA对种子萌发生理的影响
发芽势和发芽率能衡量种子的发芽速度和整齐度,种子活力指数是检验种子质量和生活力的指标,其数值则更直接体现了种子的生活力。本实验中,NaCl处理明显降低了种子的发芽势,发芽率和活力指数,分别降低了46.9%、24.7%和52.2%,达到了显著水平。后经ALA处理使三个指标明显上升,发芽势和活力指数在25 mg/L处理达到最大,发芽率在50 mg/L处理时达最高,但与10 mg/L和25 mg/L处理不显著。适宜浓度ALA处理可以有效提高盐胁迫下种子的发芽势和发芽率,促进种子的萌发,过高浓度反而会产生抑制,这与吴旭红等[11]的研究相同。已有研究表明,ALA能促进亚铁血红素的合成转化,诱导提高植物体内抗氧化酶活性[12-14]。故ALA能通过抗氧化酶活性的提高,以及呼吸强度的提升提高盐胁迫下种子的萌发质量。在测定活力指数时发现,适宜浓度的ALA能显著提高种子根长从而提高活力指数,这与喻泽莉等[15]关于ALA能促进胚根及下胚轴的研究相同。
3.2 ALA处理对MDA含量的影响
MDA是多不饱和脂肪酸过氧化作用的最终产物[16]。当细胞内产生和清除自由基的平衡被打破时MDA会增加,其含量可以反映植物遭受逆境伤害的程度。而MDA的积累又会引起膜蛋白变性而降低膜脂流动性,导致膜透性升高,加剧逆境对细胞膜结构的破坏[17]。本实验中可以看出,在盐胁迫下,幼苗叶片中MDA含量上升了24.8%,效果显著。ALA处理过的组与盐胁迫处理组的MDA含量相比均有了显著降低。25 mg/L处理下MDA含量最低,与盐胁迫组相比降低了18.3%,恢复到CK水平。研究表明,施用ALA后能提高抗氧化酶系活力(SOD、POD、CAT),帮助清除活性氧,减少MDA含量[18]。说明适宜浓度的ALA可以帮助清除产生过多的自由基,降低MDA水平,缓解逆境胁迫。这与张春平等[19]的结果相同,适量ALA降低了植物叶片中MDA量,减弱膜脂过氧化,很好的稳定了膜结构。
3.3 ALA处理对可溶性糖含量的影响
可溶性糖是构成细胞骨架的重要物质,为植物提供物质和能量,并作为一种渗透调节类物质,当无机离子浓度过高时可以作为一种保护酶[20]。有研究表明,可溶性糖还参与植物体内氧自由基的清除[21]。实验中,盐胁迫处理后玉米叶片中可溶性糖含量上升13.4%,在经过ALA处理后,在25 mg/L时可溶性糖含量达最高,相比盐胁迫处理提高了32.4%。逆境胁迫下,可溶性糖在细胞内会主动累积,降低渗透势进行吸水,施用适宜浓度ALA后,可溶性糖含量继续提升,帮助细胞吸水,使细胞的渗透调节能力大幅加强,提高植物抗盐性。ALA的能帮助合成有关可溶性糖合成的酶,或是提高相应酶的生理活性,促进可溶性糖的合成,使其维持在较高水平[22]。
3.4 ALA处理对叶绿素含量的影响
植物进行光合作用依赖叶绿素,叶绿素对于植物生长发育和干物质积累有重要作用。植物受盐胁迫时,蛋白质合成下降且加速分解,影响到叶绿素的合成[23]。本实验可以看出,在盐胁迫下,叶绿素下降了11.6%。在经过ALA处理后叶绿素含量开始升高,在25 mg/L时达到最大,与盐胁迫处理相比叶绿素分别提高了41.7%。作为叶绿素合成的前体物质,施用ALA对植物体内叶绿素含量的提高是可以预见的,此外,ALA还能以生长调节类物质的方式间接调控叶绿素水平,减缓了光合色素降低的趋势,提高了光能转化效率[24]。
3.5 ALA处理对脯氨酸含量的影响
脯氨酸是细胞内最重要和有效的有机渗透调节物质,逆境胁迫会引起其含量大幅增加,脯氨酸维持在较高浓度,有利于在逆境下保持细胞较高含水量,并使膨压稳定,维持玉米细胞内一系列正常的生理功能[25]。同时脯氨酸也能很好的保护多种膜结构,增强酶的稳定性,在逆境下极大程度的保护细胞生理结构[26]。本试验中,脯氨酸含量在盐胁迫处理后增加了73.4%,在施用ALA后脯氨酸含量继续增加,在25 mg/L达到最大,脯氨酸含量与盐胁迫处理相比增加68.7%。说明适量的ALA提高了细胞内脯氨酸的浓度,较好的保护了细胞的结构和功能。
从本试验来看,ALA提高玉米抗盐性主要有三个方面:一是提高渗透调节物质水平,降低细胞渗透势,使作物正常吸水,保持由膨压控制的细胞活性;二是增强保护酶系统功能,减轻膜脂过氧化程度,恢复自由基的产生、清除平衡,稳定膜结构;三是维持光合系统的正常运行,保证有机物合成和作物正常生长发育。
4结论
本试验通过设置100 mmol/L浓度盐胁迫,并施加不同浓度ALA,对玉米种子及幼苗相关生理指标做了探究。试验显示,施用ALA能明显缓解玉米种子及幼苗的盐胁迫状况,在10~200 mg/L浓度下能显著提高种子的发芽势和发芽率,减少MDA含量;在10~50 mg/L的浓度下显著提高作物可溶性糖、脯氨酸以及叶绿素含量;并在25~50 mg/L浓度下显著增强种子活力。综合来看,ALA浓度为25 mg/L时,种子及幼苗相关指标均达到了最佳效果,明显优于其它处理,属于适合实践的,经济高效的浓度。
参考文献
[1]王佳丽,黄贤金,钟太洋,等.盐碱地可持续利用研究综述[J].地理学报,2011,66(5):673-684.
[2]吴旭红,冯晶旻.外源5-氨基乙酰丙酸对盐胁迫下南瓜种子萌发及耐盐性的影响[J].种子,2016,35(12):90-93.
[3]斯琴巴特爾,吴红英.盐胁迫对玉米种子萌发及幼苗生长的影响[J].干旱区资源与环境,2000,14(4):76-80.
[4]高英,同延安,赵营,等.盐胁迫对玉米发芽和苗期生长的影响[J].中国土壤与肥料,2007(2):30-34.
[5]汪良驹,姜卫兵,章镇,等.5-氨基乙酰丙酸的生物合成和生理活性及其在农业中的潜在应用[J].植物生理学报,2003,39(3):185-192.
[6]BinduRC,VivekanandanM.Hormonalactivitiesof5-aminolevulinic acid in callus induction and micropropagation[J]. Plant Growth Regul,1998,26:15-18.
[7]Watanabe K, Tanaka T, Hotta Y, et al. Improving salt tolerance of cotton seedlings with 5- aminolevulinic acid[J]. Plant Growth Regulation,2000,32(1):97-101.
[8]Wang L J, Jiang W B, Liu H, et al. Promotion by 5-Aminolevulinic Acid of Germination of Pakchoi (Brassica campestris ssp. chinensis var. communis Tsen et Lee) Seeds Under Salt Stress[J]. Journal of Integrative Plant Biology,2005,47(9):8.
[9]孙阳,王燚,曲丹阳,等.5-氨基乙酰丙酸提高玉米幼苗抗低温性及其生理机制[J].生态学杂志,2016,35(7):1737-1743.
[10]谢英赞,何平,韦品祥,等.外源5‐氨基乙酰丙酸对盐胁迫下决明幼苗生理特性的影响[J].广西植物,2013(1):102-106.
[11]吕婷婷.不同种质菘蓝对氮形态的差异化响应及ALA对其盐胁迫下生长的影响[D].南京:南京农业大学,2015.
[12]Thomas J, Weinstein J D. Measurement of Heme Efflux and Heme Content in Isolated Developing Chloroplasts[J]. Plant Physiology, 1990,94(3):1414-1423.
[13]Huystee R B V. Porphyrin and peroxidase synthesis in cultured peanut cells[J]. Canadian Journal of Botany,1977,55(10):1340-1344.
[14]Poulos T L, Kraut J. The stereochemistry of peroxidase catalysis[J]. Journal of Biological Chemistry,1980,255(17):8199-205.
[15]喻泽莉.外源ALA和SNP对干旱胁迫下决明种子萌发及幼苗生理特性的影响[D].重庆:西南大学,2012.
[16]Moller IM, Jensen PE, Hansson A. Oxidative Modifications to Cellular Components in Plants[J]. Annual Review of Plant Biology, 2007,58(1):459-481.
[17]刘健伟.5-氨基乙酰丙酸和亚精胺对茄子幼苗抗冷性的影响[D].重庆:西南大学,2010.
[18]陈罡,管安琴,万云龙,等.外源5-氨基乙酰丙酸(ALA)对盐胁迫下小型西瓜幼苗抗氧化酶活性的影响[J].江苏农业科学,2016,44(6): 252-255.
[19]张春平,何平,韦品祥,等.外源5-氨基乙酰丙酸对盐胁迫下紫苏种子萌发及幼苗抗氧化酶活性的影响[J].中草药,2011,42(6):1194-1200.
[20]武香,倪建伟,张华新,等.盐胁迫下不同盐生植物渗透调节的生理响应[J].东北林业大学学报,2012,40(8):29-33.
[21]栾晓燕,陈怡,杜维广,等.不同抗性大豆品种(系)感染SMV后可溶性糖和游离氨基酸的研究[J].大豆科学,2000,19(4):000356-361.
[22]孙阳,王燚,曲丹阳,等.5-氨基乙酰丙酸提高玉米幼苗抗低温性及其生理机制[J].生态学杂志,2016,35(7):1737-1743.
[23]姚侠妹,张瑞娥,偶春,等.外源5-氨基乙酰丙酸对盐胁迫下栀子幼苗生理特性的影响[J].东北林业大学学报,2015(4):37-41.
[24]张春平,何平,刘海英,等.外源性5-氨基乙酰丙酸对盐胁迫下决明子萌发及幼苗生理特性的影响[J].中草药,2012,43(4):778-787.
[25]阎勇.玉米耐旱生理特性研究[D].南宁:广西大学,2007.
[26]尹田夫.大豆脯氨酸累积与抗逆性[J].大豆科学,1984(2):153-158.

