天津地区黄瓜多主棒孢对啶酰菌胺的敏感性研究
高苇 杨利娟 王勇 马建芳 刘亚全
摘要:为明确黄瓜多主棒孢(Corynespora cassiicola)对生产上常用防治药剂啶酰菌胺的敏感性水平,采用平板生长速率测定法,检测来自天津6个区县的102株黄瓜多主棒孢对烟酰胺类杀菌剂啶酰菌胺的敏感性。结果表明,天津地区黄瓜多主棒孢对啶酰菌胺的药剂敏感性存在较大差异,EC50最小值为0.29μg/mL,最大值为773.33μg/mL;对啶酰菌胺的抗性频率为78.43%,其中高抗频率为4.9%。天津地区黄瓜生产中啶酰菌胺使用频率较高,啶酰菌胺具有中度抗性风险,该药剂在天津地区不适宜用于黄瓜棒孢叶斑病防治。
关键词:黄瓜;多主棒孢;啶酰菌胺;敏感性;抗性水平
中图分类号:S482.2文献标志码:A论文编号:cjas2020-0042
Sensitivity of Corynespora cassiicola Causing Cucumber Corynespora Spot to Boscalid in Tianjin
Gao Wei1, Yang Lijuan1, Wang Yong1, Ma Jianfang2, Liu Yaquan2
(1Institute of Plant Protection, Tianjin Academy of Agricultural Sciences, Tianjin 300384, China;
2Agricultural Technology Extension and Service Center in Xiqing District of Tianjin, Tianjin 300381, China)
Abstract: To investigate the sensitivity level of Corynespora cassiicola to boscalid, a new carboxamide, 102 isolates of C. cassiicola in Tianjin were evaluated by mycelial growth rate method. The results showed that there existed significant difference in the sensitivity of C. cassiicola. The minimum value of EC50 was 0.29μg/mL, and the maximum value was 773.33μg/mL. The total resistance frequency of the 102 strains to boscalid was 78.43%, and the high resistance frequency was 4.9%. The application frequency of boscalid in cucumber production in Tianjin is relatively high, and it has moderate resistance risk, which is not suitable for the control of Corynespora leaf spot in Tianjin.
Keywords: Cucumber; Corynespora cassiicola; Boscalid; Sensitivity; Resistance Level
0引言
黄瓜由多主棒孢(Corynespora cassiicola)侵染造成的黄瓜棒孢叶斑病,又叫黄瓜靶斑病,是国内黄瓜生产上危害较为严重的病害,在天津、河北、山东等17个省市严重发生,田间发病率10%~25%,严重时超过60%,甚至导致全棚绝产[1-3]。病原菌多主棒孢寄主范围广泛、侵染力强、传播扩散快、极易变异,造成病害一旦发生难于控制[4-6]。由于缺乏有效的抗病品种,生产上仍以化学药剂防治为主。目前,对多主棒孢引起的棒孢叶斑病有效的化学药剂主要有啶酰菌胺、氟吡菌酰胺、嘧菌酯、苯醚甲环唑、咪鲜胺、戊唑醇等[6-9],国内2014年开始才有用于防治黄瓜棒孢叶斑病的化学药剂登记[10],因此,导致农民生产上长期存在药剂使用盲区,无法及时选择有效的药剂控制其危害。
啶酰菌胺(boscalid)是烟酰胺类内吸性杀菌剂,属于琥珀酸脱氢酶抑制剂(SDHIs),具有抑制病原菌呼吸作用的机制,被用于多种植物真菌病害的防治[11-12],2006年在日本登记用来防治黄瓜棒孢叶斑病并取得较好的防效[13- 14],但随后又陆续有抗药性产生的报道[15-16]。2008年起开始在国内登记用于防治黄瓜灰霉病,同时发现其对多种病原靶标具有较好的防效,因此成为田间常用的蔬菜真菌病害的广谱性防治药剂[17]。由于缺乏黄瓜棒孢叶斑病推荐药剂,国内生产上也常将啶酰菌胺用于黄瓜棒孢叶斑病的防治。2018年朱发娣等[18]研究發现,啶酰菌胺对多主棒孢敏感种群毒力高、防效好,但在环渤海周边省市多主棒孢种群中发现了大量抗性菌株,这也是这些地区黄瓜棒孢叶斑病发生严重未能及时防控的主要原因。各省区开展多主棒孢对啶酰菌胺田间抗性监测对黄瓜棒孢叶斑病的有效防控具有重要的意义。本研究采用菌丝生长速率法测定来自天津6个区县的102株黄瓜棒孢叶斑病病原菌对啶酰菌胺的敏感性,分析不同地区菌株间的敏感性差异和抗药性水平,旨在为其抗药性风险评估及合理化学防治策略制定提供理论依据,从而保障啶酰菌胺在天津地区合理应用。
1材料与方法
1.1供试菌株
2017—2018年从天津各区县黄瓜种植区采集了黄瓜棒孢叶斑病发病叶片,对其进行组织分离和纯化后获得102株黄瓜多主棒孢,于4℃冰箱保存备用。
试验于2017年3月—2018年12月在天津市植物保护研究所种苗病害研究室进行。
1.2试验药剂
95%啶酰菌胺原药由北京燕化永乐农药有限公司生产。将该原药溶于适量丙酮溶剂中,配成浓度为105μg/mL药剂母液。
1.3黄瓜多主棒孢对啶酰菌胺的敏感性测定
采用菌丝生长速率法。将供试菌株在PDA平板上活化培养,25℃培养5天后,用灭菌的打孔器在菌落边缘打取直径为6 mm的菌饼,将其菌丝面朝下接种于啶酰菌胺浓度为104、103、102、10、1、0.1μg/mL的含药平板上,放入25℃恒温箱中培养5天,每个药剂浓度处理3次重复,以加入无菌水的培养基为对照,试验重复2次。5天后采用十字交叉法测量各处理菌丝块扩展直径,抑菌率计算如式(1)。
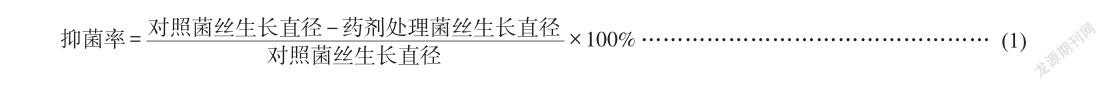
1.4数据统计分析
采用DPS统计学软件进行药剂浓度与防效之间的线性回归分析,求出药剂对每一个菌株的毒力回归方程及有效抑制中浓度(EC50)。啶酰菌胺抗性水平标准参照Zhu等[19]的报道,以啶酰菌胺对黄瓜多主棒孢群体的敏感性基线EC50=0.95±0.51μg/mL为标准,计算抗性水平值(RF),如式(2)。RF≤9.5为敏感菌株(S),9.5

2结果与分析
2.1黄瓜多主棒孢对啶酰菌胺的敏感性
采用菌丝生长速率法测定天津地区102株黄瓜多主棒孢菌对啶酰菌胺的敏感性,其敏感性分布结果见图1。102个菌株对啶酰菌胺敏感性差异较大,EC50最低为0.29μg/mL,最高为773.33μg/mL,两者相差2630倍。其中,啶酰菌胺EC50值在0~20μg/mL范围内的菌株数量最多,有47株,分离频率46.08%;有5株菌株的EC50值大于100μg/mL,分离频率4.90%。从EC50值分布图可以看出,对啶酰菌胺的敏感性不同菌株的出现频率未呈现出正态分布,说明天津地区黄瓜多主棒孢对啶酰菌胺已存在普遍抗性,形成抗啶酰菌胺的稳定种群。
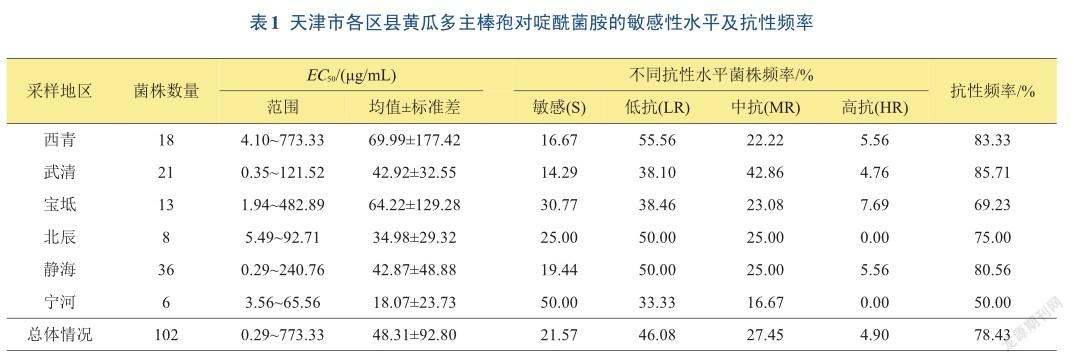
2.2不同区县黄瓜多主棒孢对啶酰菌胺敏感性差异

采集的102株黄瓜多主棒孢来自天津6个区县的黄瓜种植基地,其对啶酰菌胺的敏感性测定结果(表1)表明,来源于西青区病原菌对啶酰菌胺的敏感性最低,其18个菌株的平均EC50值为(69.99±177.42)μg/mL;来源于宁河区的菌株对啶酰菌胺的敏感性最高,其6个菌株的平均EC50值为(18.07±23.73)μg/mL。同一区县采集的黄瓜多主棒孢对啶酰菌胺的敏感性差异较大,其中静海区多主棒孢菌株间的EC50值差异最大,最大值和最小值相差830倍;北辰区和宁河区菌株间EC50值差异较小,最大值和最小值相差17和18倍。
天津地区黄瓜多主棒孢菌对啶酰菌胺产生了不同程度的抗性,其敏感性菌株频率仅为21.57%,抗性频率达到78.43%;宁河区菌株以敏感性表型为主,武清区菌株以中抗菌株为主,其余区县黄瓜多主棒孢菌均以低抗水平为主,西青、静海、武清和宝坻4个区县均出现1~2株高抗菌株。6个不同区县黄瓜多主棒孢抗性菌株频率统计结果表明,其抗性频率为50.00%~ 85.17%。其中,宁河区菌株抗性频率最低,武清区黄瓜抗性水平最高。
3结论
本研究采用菌丝生长速率法对天津地区采集的102株黄瓜多主棒孢菌对烟酰胺类杀菌剂琥珀酸脱氢酶抑制剂啶酰菌胺的敏感性进行测定。试验结果表明,该地区菌株对啶酰菌胺产生了明显的抗药性,且抗性水平差异较大,EC50最低和最高菌株间相差2630倍;不同区县获得菌株抗性水平存在显著差异,宁河區以敏感性菌群为主,武清区抗性菌株分离频率最高。杀菌剂对病原菌的选择压力增大是抗性频率变高的主要原因,因此杀菌剂的抗药性监测结果,可指导农户因地制宜合理使用不同作用机制的农药,抑制抗性种群的发展,延长药剂使用寿命,为农药的减量使用提供理论依据。
4讨论
黄瓜棒孢叶斑病是黄瓜生产中的主要病害之一,设施栽培长期的高温高湿环境,为病原的累积和病害的暴发提供较好的环境条件[19-20],造成黄瓜棒孢叶斑病的危害日益严重。化学防治是目前生产上最直接有效的控制手段,但国内对该病害登记药剂较少,导致农民对防治药剂的选择存在很大程度的盲目性[21]。啶酰菌胺于2006年在日本登记用于黄瓜棒孢叶斑病的防治,取得了较好的防控效果[22]。2009年发现使用过啶酰菌胺棚室分离到的多主棒孢药剂敏感性显著下降,田间出现抗性群体,因此加强田间抗性水平监测对该药剂的田间应用具有重要意义[17-20]。
本研究对2017—2018年采集的天津6个区县的黄瓜多主棒孢进行啶酰菌胺的敏感性分析,发现其对啶酰菌胺的敏感性显著下降,抗性菌株频率高达78.43%,高于Zhu等[19]2019年报道的抗性频率66.7%。由于啶酰菌胺近年来在天津地区被广泛用于设施蔬菜灰霉病、菌核病的防治、棒孢叶斑病的防治中,该地区菌株出现了普遍抗性,敏感性野生菌株分布极少,检测获得敏感性较高的菌株大部分来自露地首次种植地块。因此,天津地区黄瓜棒孢叶斑病的防治应适当调整用药方法,减少啶酰菌胺及同类型的琥珀酸脱氢酶类杀菌剂的使用频率和使用量,采用多种类型药剂交替使用,控制抗药群体的发生和蔓延。加强田间病原菌的抗药性监测,及时控制抗药群体出现[23-24]。
啶酰菌胺属于琥珀酸脱氢酶类抑制剂(SDHIs),其抗性主要由病原真菌线粒体复合物II B/C/D亚基编码蛋白的核苷酸序列点突变导致,且不同突变位点代表了不同的抗药水平。下一步研究可以结合不同抗性水平菌株的靶标位点基因检测,分析该菌株抗药性产生的机制,明确是否存在新的突变类型。
参考文献
[1]张自心,谢学文,傅俊范,等.黄瓜棒孢叶斑病病原学和抗性基因研究进展[J].生物技术进展,2016,6(3):169-173.
[2]李晗,冉茂,陈海涛,等.植物棒孢霉叶斑病的发生及防治研究进展[J].植物医生,2020,33(1):15-20.
[3]吴桥,赵秀香,吴元华.辽、冀、鲁黄瓜褐斑病菌(Corynespora cassiicola)培养性状及致病力分化研究[J].沈阳农业大学学报, 2017,48(2):207-212.
[4]张艳菊,刘奇,刘东,等.黄瓜棒孢叶斑病菌的毒力分化及AFLP分析[J].北方园艺,2016(16):92-96,98.
[5]李淑菊,王惠哲,杨瑞环,等.黄瓜棒孢叶斑病菌基因组ISSR分子指纹分析[J].分子植物育种,2015,13(11):2531-2536.
[6]李俊香,洪霓,古勤生.22种杀菌剂对甜瓜靶斑病菌的室内毒力测试[J].中国瓜菜,2018,31(9):13-16.
[7]禾丽菲,,李晓旭,朱佳美,等.不同杀菌剂对黄瓜靶斑病菌的毒力作用特性比较[J].农药学学报,2018,20(1):25-32.
[8]温浩,张桂军,毕扬,等.草莓棒孢叶斑病的病原菌鉴定及其对9种杀菌剂的敏感性[J].农药学学报,2019,21(3):279-284.
[9]MacKenzie K J, Xavier K V, Wen A, et al. Widespread QoI Fungicide Resistance Revealed Among Corynespora cassiicola Tomato Isolates in Florida.[J]. Plant disease,2020,104(3):893-903.
[10]农业农村部农药鉴定所.中国农药信息网[EB/OL].(2020-04-08). http://www.chinapesticide.gov.cn/.
[11]张慧丽,张文,康永利,等.新型烟酰胺类杀菌剂啶酰菌胺的合成[J].农药,2016,55(7):491-492,503.
[12]华乃震.SDHI类杀菌剂啶酰菌胺[J].世界农药,2018,40(5):9-15.
[13]Ruprecht J, Yankovskaya V, Maklashina E, et al. Structure of Escherichia colisuccinate: quinoneoxidoreductasewithan occupied and empty quinone-binding site[J]. J Biol Chem,2009,284: 29836-29846.
[14]于乐祥,张秀珍.新型烟酰胺类杀菌剂啶酰菌胺的研究进展[J].山东农药信息,2009(11):21.
[15]Ishii H, Miyamoto T, Ushio S, et al. Lack of cross-resistance to a novel succinate dehydrogenase inhibitor, fluopyram, in highly boscalid- resistantisolatesofCorynesporacassiicolaand Podosphaera xanthii[J]. Pest management science,2011,67(4):474-482.
[16]Ishii H, Yano K, Date H., et al. Molecular characterization and diagnosis of QoI resistance in cucumber and eggplant fungal pathogens[J]. Phytopathology,2007,97:1458-1466.
[17]Miyamoto T, Ishii H, Seko T, et al. Occurrence of Corynespora cassiicola isolates resistant to boscalid on cucumber in Ibaraki Prefecture, Japan[J]. Plant Pathology,2009,58(6):1144-1151.
[18]朱發娣.黄瓜多主棒孢菌(Corynespora cassiicola)对啶酰菌胺的抗性及其机理研究[D].北京:中国农业科学院,2018.
[19]Zhu F D, Shi Y X, Xie X W, et al. Occurrence, distribution and characteristics of boscalid-resistant Corynespora cassiicola in China[J]. Plant Disease,2019,103:69-76
[20]Miyamoto T, Ishii H, Stammler G, et al. Distribution and molecular characterization of Corynespora cassiicola isolates resistant to boscalid[J]. Plant Pathology,2010,59(5):873-881.
[21]纪军建,张小风,王文桥,等.黄瓜褐斑病化学药剂防治研究进展[J].河北农业科学,2010,14(8):28-31.
[22]李宝聚,高苇,石延霞,等.多主棒孢和棒孢叶斑病的研究进展[J].植物保护学报,2012,39(2):171-176.
[23]于淑晶,王满意,田芳,等.黄瓜棒孢叶斑病的防治及抗药性研究进展[J].农药,2014,53(1):7-11,33.
[24]白滨,何苏琴,荆卓琼,等.分离自黄瓜的多主棒孢霉不同表型菌株对杀菌剂的敏感性[J].微生物学通报,2016,43(2):322-329.

