谷子白发病卵孢子重寄生真菌的分离鉴定
岳 娟,王培娇,韩彦卿,高俊明
(山西农业大学植物保护学院,山西太谷030801)
谷子(Setaria italica(L.)P. Beauv.)是 1 年生草本植物,广泛种植于欧亚大陆的温带和热带。我国黄河中上游为谷子的主要栽培区,其他地区也有少量栽种,其是我国重要的粮食作物之一。然而,一直以来谷子各种植区内谷子白发病多有发生,严重影响和危害着谷子的产量与品质。谷子白发病(Sclerospora graminicola(Sacc.)Schroet)病原是谷子白发病菌,其属于卵菌门霜霉科指梗霉属禾生指梗霉(Sclerospora graminicola)。在我国谷子种植区域,一般白发病发病率为5%~10%,个别地块发病率可达50%[1]。韩飞等[2]研究发现,陕西省榆林市府谷县谷子白发病平均发病率在20%~40%。程富英等[3]研究报道,谷子白发病已经成为谷子病害中具有毁灭性的严重病害之一。关于谷子白发病的防治,传统的药剂防治方法虽然有见效快的优点,但同时也存在污染环境、造成农药残留等问题,严重危害人类的健康。故通过生物防治来防治植物病害的优势更为明显。
ZHU 等[4]研究发现,多孢木霉是可以用于杂草防除的生防治剂。贺超等[5]研究发现,绿色木霉具有抑制病原菌、促进植物生长的功能,可用于植物病原菌的生物防治。利用重寄生真菌防治植物病害是一种利用有益微生物杀灭或压低病原生物数量以控制植物病害发生、发展的一类措施。西欧国家在很久以前就开始利用重寄生菌来防治植物病害。WHIPPS[6]研究发现,镰孢菌对指梗霉属等真菌的卵孢子具有重寄生作用。MULLER 等[7]研究发现,重寄生非致病镰孢菌可以防治列当(Orobanche coerulescens Steph)导致的植物病害。
在我国,江浙地区曾利用木霉制剂防治茉莉花白绢病[8]。潘潇涵等[9]研究了哈茨木霉VT9-3r 和枯草芽孢杆菌VT4-1x 对3 株马铃薯致病菌的抑制作用效果,结果显示,哈茨木霉主要通过重寄生、枯草芽孢杆菌主要通过拮抗机制抑制马铃薯致病菌,2 种不同抑菌机制的菌剂复配施用能更有效防治马铃薯黑痣病。阎玉婷等[10]研究发现,谷子白发病卵孢子可以被3 种镰孢菌寄生。申红妙等[11]研究了葡萄生单轴霉上的重寄生真菌层生镰刀菌,并研究了其对葡萄生单轴霉菌的防治效果,结果表明,层生镰刀菌对葡萄生单轴霉具有重寄生作用,且对葡萄霜霉病具有较强的预防控制作用。因此,筛选出更多能抑制谷子白发病卵孢子生长的具有生防潜力的重寄生菌株,并将其用于白发病的防治,将对于谷子白发病菌的生物防治具有非常重要的意义。
本研究利用诱捕法对谷子白发病卵孢子进行埋置诱捕处理,以分离筛选出具有潜在生防效果的重寄生真菌,同时对其进行形态学和分子生物学鉴定,旨在为利用生防菌来防治谷子白发病奠定一定的理论基础。
1 材料和方法
1.1 试验材料
供试卵孢子于2019 年从山西农业大学农作站谷子病田白发发丝上面直接收集。
供试病田土壤从山西农业大学农作站谷子病田中直接采集。
1.2 主要试剂与仪器
主要试剂有 25%乳酸、20 μg/mL 青霉素、40 μg/mL 链霉素、葡萄糖、琼脂、蒸馏水;主要仪器有电子天平(CP512)、立式自动压力蒸汽灭菌锅(G154DWS)、热空气消毒箱(GR-240)、净化工作台(SW-CJ-2FD)、隔水式恒温培养箱(GSP-9270MBE)、高速台式冷冻离心机(Sorvall ST 16R Centrifuge)
1.3 试验方法
1.3.1 谷子白发病卵孢子的诱捕收集 将收集的卵孢子称取21 份,每份质量为1 g。在山西农业大学农作站病田,选取40 m×20 m 的地块,将其分为21 块5 m×5 m 的小区,在每个小区里面用小铁锹挖出长、宽、高均为20 cm 的土坑,取出500 g 距离地面大概5 cm 深度的土壤,与1 g 卵孢子充分混匀,用双层纱布包裹后埋至之前挖好的土坑内,填平土坑,同时写好标签,注明填埋时间以及土壤与卵孢子的比例;之后每隔30 d 随机挖取3 个埋置点的土样,采用盐水悬浮过筛法回收与土样混埋后的卵孢子。连续回收、分离4 次。
先将诱捕埋置点挖取回的3 份500 g 土样分别放入10 kg 桶内,加500 mL 饱和盐水,用玻璃棒充分搅拌溶解,并用孔径830 μm 筛网捞取底部沙粒和悬浮的植物残体,然后停止搅拌;静置3 min 后,将浑浊液依次倒入孔径为 120、75、41、23 μm 的四型网筛过滤;过滤完后弃筛网拦截物,用无菌水从网筛背面冲洗回收拦截物,并收集洗液至500 mL烧杯中,即为试验所需的卵孢子回收液。
1.3.2 卵孢子重寄生真菌的分离 在无菌操作台中,直接在体视显微镜下从卵孢子回收液中用移液枪挑取单个卵孢子,按照图1 的排列方式将单个的卵孢子接种至加有 20 μg/mL 青霉素、40 μg/mL 链霉素和25%乳酸[12-14]的PDA 平板上有记号笔标定的位置,每个平板接10 个卵孢子,每次接10 个平板,以未诱捕埋置的卵孢子作为对照,进行分离;最后将处理组和对照组接好单个卵孢子的平板置于25 ℃恒温培养箱黑暗培养,每天定时观察、拍照并记录每个PDA 平板圆圈标记处是否有菌落长出。

1.3.3 谷子白发病卵孢子重寄生真菌的纯化 若PDA 平板被标记处有菌落长出,立即用挑针挑取菌落边缘不同区域的菌丝并移接到新的PDA 平板上,置于25 ℃恒温培养箱黑暗培养7 d,并且每天定时观察记录菌落的大小、形态和颜色的变化。每个菌株做3 个重复,并做好标记。若其菌落生长速度及菌落形态和颜色变化一致,说明该重寄生真菌已被纯化,否则需要采用尖端菌丝分离法进一步纯化。后置于4 ℃冰箱保存备用。
1.3.4 谷子白发病卵孢子重寄生真菌形态学鉴定先将1.3.3 低温保存的菌株活化,再分别用直径5 mm 打孔器打取菌饼并接种于PDA 培养基上,置于25 ℃恒温培养箱黑暗培养7~14 d,观察并记录菌落大小和颜色,挑取菌丝制作临时玻片,在显微镜下观察菌丝及孢子形态,并拍照记录;之后参照《真菌鉴定手册》[15]对谷子白发病卵孢子重寄生真菌进行初步鉴定,从而筛选出具有潜在生防潜力的木霉菌株。
1.3.5 重寄生木霉的分子生物学鉴定 参考Ezup柱式真菌基因组DNA 提取试剂盒的提取方法提取菌株的DNA;采用真菌16S rDNA ITS 的通用引物 ITS1(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)对木霉真菌基因组DNA 进行PCR 扩增。其中,2 种引物均由上海生物工程有限公司合成;其扩增体系为2×PCR Mix 10 μL,上下游引物各 2 μL,DNA模板 1~2 μL,最后用双蒸水定容到50 μL。反应条件为95 ℃预变性 3~5 min;94 ℃变性 30 s,55~60 ℃退火 25~30 s,72 ℃延伸 30~50 s,共 35 个循环;最后 72 ℃修复延伸5~8 min。然后取5 μL PCR 扩增产物用1.7%琼脂糖凝胶进行琼脂糖凝胶电泳(条件为150 V、100 mA、20 min);待电泳结束后取出凝胶,在成像系统Image Lab 中进行拍照观察,后将具有特异性条带的产物送至上海生工科技有限公司进行测序。最后将ITS 测序结果提交至NCBI 中GenBank 的Blast 程序,与相似度高的相关序列进行同源性比较,采用邻接法(Neighbor-joining,NJ)构建系统发育树,分析各分支序列。
2 结果与分析
2.1 卵孢子被寄生现象显微观察结果

将谷子白发病卵孢子接种到PDA 培养基25 ℃进行黑暗培养,24 h 后在光学显微镜下连续观察发现,对照组卵孢子无任何变化(图2-A);而处理组卵孢子周围均有菌丝长出(图2-B、C、D),说明处理组卵孢子均被寄生。
2.2 卵孢子重寄生真菌的分离结果
从图3 可以看出,在PDA 平板上圆圈标记处卵孢子表面长出了数量不等而且形态、颜色均不同的菌落,由于谷子白发病菌是专性寄生菌,因此,这些菌落即为卵孢子重寄生真菌。

2.3 卵孢子重寄生真菌的形态学鉴定结果
对分离得到的81 株重寄生真菌进行形态学鉴定,根据其显微形态特征将菌株大致分为4 个属,依次是木霉属(Trichoderma)21 株、链格孢属(Alternaria)7 株、青霉属(Penicillium)10 株和镰孢菌属(Fusarium)43 株。
2.3.1 木霉属(Trichoderma) 其形态学特征如图4所示。

木霉属菌株生长迅速,在PDA 上培养至第4 天时菌落长满了整个培养皿,蛛丝状菌落,初始颜色为纯白色,有少量气生菌丝,后在菌落正面产生暗绿色产孢体铺满整个白色菌落(图4-A),菌落背面白色至浅黄绿色。在电子显微镜下观察发现,菌丝透明,有分枝且为有隔菌丝(图4-B);分生孢子梗呈树状分枝,瓶状小梗产孢,瓶梗基部稍收缩,中部略宽,向上渐变窄呈瓶状(图4-C);分生孢子椭圆形或近圆形(图 4-D),大小为(2.8~3.6)μm×(2.5~3.2)μm。据其形态特征初步鉴定为木霉属。
2.3.2 链格孢属(Alternaria) 该属菌株生长速度中等,菌落绒状或絮状,菌落颜色初期暗白色,后期变为褐绿色,菌落背面颜色为褐色(图5-A);该属菌株典型形态特征是分生孢子倒棒形,具横隔和纵隔,横隔较粗,如壁砖状(图5-B);分生孢子梗及菌丝有横隔(图5-C)。据其形态特征初步鉴定为链格孢属。

2.3.3 青霉属(Penicillium) 该属菌株生长迅速,菌落密毡状,菌落颜色灰绿色或绿色至深绿色,上有粉状物,边缘整齐,背面颜色多为白色(图6-A);该属菌株典型形态特征是其菌丝产生较长的分生孢子梗,分生孢子梗顶端有梗基,梗基多次分枝形成瓶状小梗,小梗上生椭圆形或球形的分生孢子,由于分枝形状形似扫帚,故常称其为帚状体(图6-B)。据其形态特征初步鉴定为青霉属。

2.3.4 镰孢菌属(Fusarium) 该属菌株生长速度中等,菌落多为蛛网状、羊绒状或棉絮状,菌落颜色大多呈白色(图7-A)或淡粉色,背面颜色多为淡紫色;该属菌株典型形态特征是其分生孢子有大型分生孢子和小型分生孢子2 种类型,其中,大型分生孢子镰刀形,有较多隔(图7-B),小型分生孢子多呈卵形或纺锤形,无隔,串生(图7-C),有的在孢子链顶端形成假头状着生(图7-D)。据其形态特征初步鉴定为镰孢菌属。

2.4 木霉属(Trichoderma)的分子生物学鉴定结果
由形态学鉴定结果可知,得到的4 种属中除木霉属外,其他3 种属的菌株均是植物的致病菌,不可用作生防菌株,因此,将木霉菌属筛选为具有潜在生防效果的菌株,并对其进行进一步的分子生物学鉴定。
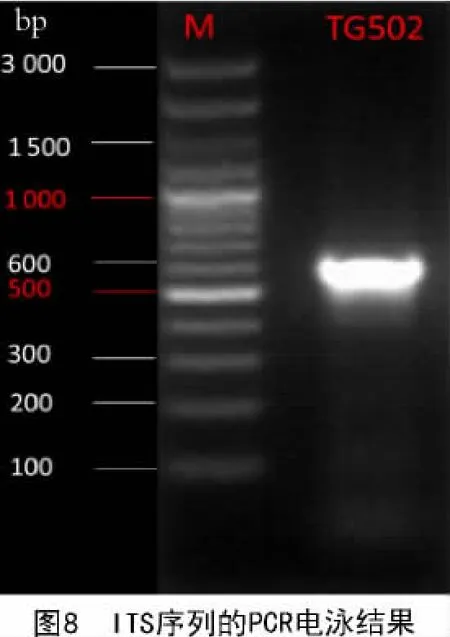
2.4.1 PCR 结果 由图 8 可知,DNA 条带亮度较高,无降解,说明提取的DNA 满足PCR 扩增要求;通过分光光度计检测浓度和纯度可知,OD260/280在1.7~2.0,说明DNA 质量较好;电泳时使用的Marker为3 000 bp,该菌株的PCR 结果在500~600 bp。
2.4.2 分子鉴定结果 在GenBank 中,Blastn 比对的结果为供试菌株ITS 序列与Trichoderma harzianum的同源性最高,达到了100%;在GenBank 中搜索相似度高的序列,再选取Trichoderma viride 和Trichoderma longibrachiatum 作为外群,通过MEGA 软件构建系统发育树(图9),可以看出,目的菌株TG502与哈茨木霉(Trichoderma harzianum)聚在同一个分支,结合形态学和分子生物学,该菌株被鉴定为木霉属(Trichoderma sp.)哈茨木霉(Trichoderma harzianum)。

3 结论与讨论
本研究利用诱捕法分离了谷子白发病卵孢子上面的重寄生真菌,并对分离到的81 株重寄生真菌进行了初步的形态学鉴定,将得到的卵孢子重寄生真菌划分为4 个属,分别为镰孢菌属(Fusarium)、青霉属(Penicillium)、木霉属(Trichoderma)、链格孢属(Alternaria),筛选出具有潜在生防潜力的重寄生木霉,并结合形态学和分子生物学将其鉴定为哈茨木霉。
马平等[16]研究发现,非致病镰孢菌可用于棉花黄萎病的防治。李舒展[17]研究发现,青霉菌可抑制黄瓜枯萎病菌生长,并可促进黄瓜生长。丛韫喆等[18]研究发现,黑根霉和拟康氏木霉混合发酵液对苹果链格孢菌具有显著的抑制作用,可用于苹果半点落叶病等的防治。陈勇等[19]研究发现,青霉菌灭活菌丝体可防治水稻病害,并可促进其生长。此外,非致病的链格孢和腐霉菌同样具有生防作用,如寡雄腐霉可抑制多种植物病原菌生长,并能诱导植物产生抗病性[20]。
这些研究结果均表明,生防菌株在植物病害防治中具有显著的成效,说明本研究通过筛选的生防菌株来防治植物病害是一种可行有效的植物病害防治手段。阎玉婷等[10]研究证明,对谷子白发病卵孢子的重寄生真菌具有重寄生作用的真菌有3 种镰孢菌,这与本研究结果一致,但不同之处在于其筛选的镰孢菌虽然能作为生防菌株抑制卵孢子的萌发,但对植物有害;而本研究中筛选出的哈茨木霉既可作为抑制卵孢子萌发的生防菌株,同时又对植物无害,符合生防菌株的筛选要求。在本试验的基础上,可以通过研究接种白发病卵孢子后的谷种萌发、植株生长情况来进一步验证木霉菌株对卵孢子生长萌发的抑制作用,将为谷子白发病的生物防治提供一定的理论依据。

