易分解有机碳输入量对武夷山不同林型土壤激发效应的影响
王 浩,杨 钰,习 丹,丘清燕,胡亚林
福建农林大学林学院森林生态稳定同位素研究中心, 福州 350002
土壤有机碳库(SOC)是陆地生态系统最大的碳库,其碳储量是植物碳库的5倍、大气碳库的4倍[1]。土壤每年向大气排放(98±12) Pg C,相当于是森林砍伐和化石燃料等排放的10倍左右[2]。因此,土壤有机碳库的微小变化也会导致大气CO2浓度的巨大改变[3- 4]。过去数十年中,许多研究表明外源有机质的输入可以改变土壤有机碳的矿化速率,而这种改变可能导致加快或减缓土壤有机碳的矿化,即呈现正或负的土壤激发效应[5- 8]。虽然先前的大多数研究认为,土壤的激发效应是短暂的,只能持续几分钟或是几个小时[5,9- 10],但近期越来越多的研究则表明,即使添加的易分解有机物被完全分解后,激发效应仍可以持续数周甚至数个月,并最终影响土壤碳平衡[11- 12]。因而,在研究土壤有机碳动态变化过程中,不能忽视外源易分解有机物对土壤激发效应的影响。
根系分泌物和植物凋落物是土壤的主要外源有机质的来源,在全球气候变暖和CO2浓度升高的背景下,由植物凋落物或是根系分泌物释放的可溶性有机质将增多[13- 14],这就意味着输入土壤的易分解有机碳将增加,外源易分解有机物的增加可能会对土壤的激发效应产生影响。有部分研究认为,土壤有机碳的矿化随着易分解有机碳输入量的增加而增加,即随着输入量的增加土壤激发效应也随之增加[15- 16]。不过也有研究指出,土壤激发效应随着易分解有机物输入量的增加而减少[17]或是外源碳输入量与土壤激发效应之间并无明显关系[18]。还有些学者认为土壤激发效应与底物添加量之间存在阈值,即外源易分解有机物输入增加时激发效应增加,但外源有机物添加到一定量时激发效应就不再增加[19- 20]。综上所述,目前关于土壤的激发效应与易分解有机碳输入量增加之间到底存在怎样的关系尚不明确。探究易分解有机物输入量与其所引起的土壤激发效应之间的关系,对于预测外源易分解有机物输入对土壤碳动态和土壤碳平衡的影响具有重要意义。
虽然土壤激发效应是由易分解有机物诱导产生的,但是激发效应的强度受到土壤微生物群落组成、土壤养分状况的影响。有研究认为,在土壤激发过程中伴随着土壤微生物群落的转变。多数研究认为在易分解有机物添加初期主要促进了r-策略者(主要是细菌的生长)而后期主要是K-策略者(如真菌、放线菌等)[21- 22],有研究发现,葡萄糖添加前后土壤真菌群落数量有显著的区别,而细菌群落数量则不明显,即形成正激发效应[23],也有研究发现易分解有机物输入抑制了SOC的矿化形成负激发效应,但影响负激发效应的因素与土壤微生物无明显关系,而是由于影响了微生物代谢导致的[20]。此外,土壤中的N素可以通过改变土壤C/N来影响土壤微生物的生长情况进而影响土壤激发效应。易分解有机物输入量的增加,可能造成微生物对氮源需求量的增加,而为了获取氮源微生物可能加快对原有有机碳的分解(即,呈现正的激发效应)。又或者是外源易分解有机物输入使得微生物出现氮限制,从而抑制了微生物的活性,降低了对原有SOC的分解(即,呈现负的激发效应)。由于不同林型土壤的养分状况以及微生物群落组成不同,因而不同林型对外源易分解有机物输入量增加的响应可能存在差异。研究易分解有机碳输入增加背景下不同林型土壤微生物群落组成以及土壤氮素含量变化有利于揭示土壤激发效应产生的机理。
综上所述,本研究拟提出以下科学问题:(1)外源易分解有机物输入量增加与土壤激发效应之间存在怎样的关系? (2)这种关系是否因林型而异? (3)易分解有机碳输入量增加下其引起土壤激发效应的作用机理是什么? 针对以上科学问题,以武夷山不同森林类型(常绿阔叶林、混交林、马尾松林)土壤为研究对象,通过向土壤中添加13C标记葡萄糖来研究:(1)葡萄糖输入增加对土壤激发效应的影响;(2)不同林型对葡萄糖添加的响应是否存在差异;(3)葡萄糖添加对不同林型土壤激发效应影响的作用机理。研究结果有利于阐明易分解有机碳输入量与土壤激发效应的关系,揭示易分解有机碳输入量增加背景下土壤激发效应产生的机理,这对于预测外源易分解有机物输入对土壤碳动态和土壤碳平衡的影响具有重要意义。
1 材料与方法
1.1 试验地概况与土壤样品采集
土壤样品采自福建省武夷山自然保护区(27°33′—27°54′N,117°27′—117°51′E),该地区为亚热带季风气候,年平均气温约12—13℃,年降水量在2000 mm,年相对湿度高达85%,雾日在100 d以上,土壤为黄红壤。武夷山高海拔使得山上植物与土壤的垂直带谱丰富。海拔由低到高的植被类型为落叶阔叶林、常绿阔叶林、针阔叶混交林、针叶林、中山苔藓矮曲林、中山草甸等。常绿阔叶林乔木层通常包含2—3个亚层,高度为12—25 m。群落主要由壳斗科(Fagaceae)、山茶科(Theaceae)和樟科(Lauraceae)等构成,主要优势树种有甜槠(Castanopsiseyrei)、苦槠(Castanopsissclerophylla)、青冈栎(Cyclobalanopsisglauca)、罗浮栲(Castanopsisfabri)和木荷(Schimasuperba)等;针阔混交林群落发育明显,乔木层高度从8 m到20 m以上不等,分为明显的3个亚层。乔木层物种主要有山茶科(Theaceae)、杉科(Taxodiaceae)、壳斗科(Fagaceae)和松科(Pinaceae)等树种组成,主要优势树种为杉木(Cunninghamialanceolata)、马尾松(Pinusmassoniana)、栲树(Castanopsisfargesii)、乳源木莲(Manglietiayuyuanensis)等组成;针叶林乔木层主要有松科、杜鹃花科(Ericaceae)和禾本科(Gramineae)植物构成,主要优势种为马尾松(Pinusmassoniana)、毛竹(Phyllostachysheterocycla)杉木(Cunninghamialanceolata)和黄山松(Pinustaiwanensis)等[24- 25]。
本研究土壤样品采集于武夷山国家自然保护区的常绿阔叶林、马尾松林、针阔混交林,在三个林型分别设置3块20 m×20 m的样地,土壤采集时先去除表层凋落物然后在每个样地内用土钻按“S”型取5个点的表层(0—20 cm)土壤,并将同一林型的土壤混合均匀,剔除其明显的动植物残体、石砾等,并过2 mm筛。所有土壤样品分为两份,一份自然风干用于测定土壤基本理化性质,另一份放在4℃冰箱用于培养试验。土壤理化性质如表1所示。
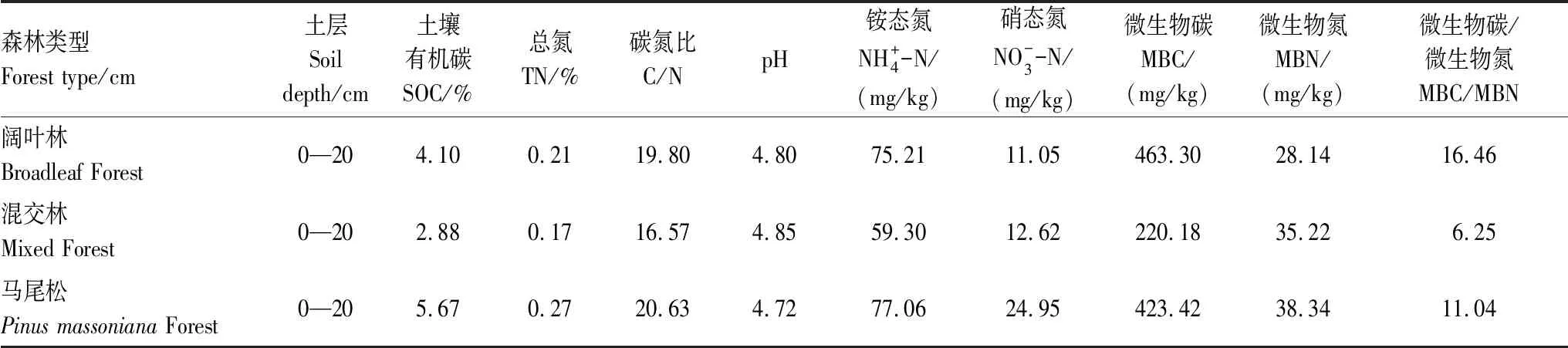
表1 试验土壤基本理化性质
1.2 试验设计与方法
1.2.1培养实验
称取相当于干土重的40 g的鲜土于300 mL的玻璃培养瓶中,用去离子水调节土壤水分含量到田间持水量的60%。所有土壤均在25℃下预培养7 d,使土壤的微生物趋于稳定。在预培养结束之后,向土壤中添加13C标记葡萄糖(99atom%13C)。在本研究中,三种林型土壤分别设置4种浓度梯度的葡萄糖碳添加试验,4个浓度梯度分别为0、100、200、400 mg C/kg,每种梯度设置3个重复。葡萄糖以溶液的形式添加,在添加时用移液枪吸取4 mL的葡萄糖溶液将其均匀滴入土壤表面,对照组则添加等量的去离子水。为了检测土壤所释放的二氧化碳,在培养瓶中放20 mL 0.5 mol/L的NaOH来吸收土壤所释放的CO2,并用橡胶塞将培养瓶塞紧。再用3个不放土壤的空瓶子作为空白,用于测定碱液吸收的空气中的CO2的量。在第一次添加相应溶液后的第1、3、5、7、11、15、20、25、30、45、65、85 d后取出NaOH溶液,然后在溶液中加入0.5 mol/L的BaCI2溶液形成沉淀,随后再用0.5 mol/L的HCI溶液滴定剩余的NaOH溶液。将上述沉淀装入离心管中以1200 r/min离心三次,每次10分钟,期间用纯水冲洗BaCO3沉淀,除去上清液后将沉淀在50℃下烘干。采用同位素比值质谱仪(IRMS, Isoprime 100, UK)测定BaCO3沉淀中的δ13C同位素值,得到的该同位素值可用于计算葡萄糖来源CO2的排放。
1.2.2测定方法
土壤pH用电位法测定(PhS- 3C)。土壤矿质氮的测定采用2 mol/L KCl浸提1 h后用全自动间断化学分析仪(SmartChem)进行分析测试。土壤微生物生物量碳(MBC)和微生物生物量氮(MBN)采用氯仿熏蒸K2SO4溶液浸提法,浸提液用总有机碳分析仪(TOC-L, CPH, Shimadzu, Japan)进行测定,土壤微生物量碳/氮(MBC/MBN)分别以熏蒸和未熏蒸提取液中碳/氮含量的差值除以转换系数0.45和0.54计算得到。土壤微生物群落结构采用磷脂脂肪酸(PLFA)方法测定,PLFA的提取过程参考Frostegård等[26]方法。取5 g土样于50 mL离心管中,加入20 mL的0.2 mol/L的KOH甲醇溶液,漩涡震荡10 min后在 37℃水浴锅中温育1 h,使其充分酯化。加入3 mL的1 mol/L醋酸溶液用于中和溶液pH值。加入10 mL正己烷,旋涡震荡10 min使磷脂脂肪酸转移到有机相中,3000 r/min离心15 min。立即将上层澄清的正己烷转到干净的玻璃试管中,使其在氮气流下吹干,加入1 mL的正己烷∶甲基叔丁基醚为1∶1的溶液,充分溶解3—5min,获得的溶液过 0.22 μm的有机滤头。所有试验样品均设3个重复。GC-MS仪器分析分析采用CP8944柱,二阶程序升温,起始温度为70℃,以20℃/min升至170℃,维持2 min,而后5℃/min升至280℃,维持5 min,最后以40℃/min升至最高温度300℃,维持1.5 min。气化室温度250℃,检测器温度300℃,载气为 H2(2 mL/min)、尾气为N2(30 mL/min),柱前压10.00 psi(1 psi=6.895 KPa);进样量1 μL,进样分流比100∶1。
1.3 计算
1.3.1不同处理土壤对CO2排放的贡献
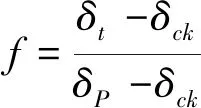
(1)
式中,f表示葡萄糖来源CO2排放占土壤总CO2排放的比例,其中δp表示葡萄糖的 δ13C值,δck表示未添加葡萄糖土壤所得到的BaCO3沉淀的 δ13C值,δt表示添加葡萄糖土壤所得到的BaCO3沉淀的 δ13C值。
土壤有机碳来源CO2的排放比例=1-f
(2)
土壤激发效应PE=[CO2-C]t-[CO2-C]ck
(3)
式中,[CO2-C]t表示葡萄糖处理下来自土壤有机碳矿化的CO2排放速率;[CO2-C]ck表示未添加葡萄糖的土壤的CO2排放速率;

(4)
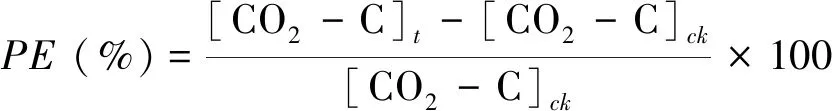
(5)
1.4 统计分析
采用SPSS 20进行分析。用One-way ANOVA中Duncan检验法分析葡萄糖添加对不同森林土壤不同来源CO2排放、MBC、PLFAs以及土壤可利用氮的影响。统计显著性水平设置为P<0.05。作图采用Sigmaplot 12.5。
2 结果与分析
2.1 葡萄糖添加对土壤总CO2排放的影响
三个林型对葡萄糖添加的响应存在明显的差异,具体体现在葡萄糖添加显著提高了阔叶林土壤CO2的排放量(增幅介于29%—36%,图1),并且CO2排放量随着葡萄糖添加量的增加而增加,不过葡萄糖的三种添加梯度(100、200、400 mgC/kg)之间并无显著差异(P>0.05);针阔混交林对葡萄糖添加的影响并不敏感,各处理间无显著性差异(P>0.05);马尾松林在葡萄糖添加量为200 mgC/kg时具有最大的土壤累积CO2排放量(37.86 mg/kg),显著高于对照组以及100 mg C/kg 添加组,并且其引起的CO2排放在三种林型土壤中是最大的。
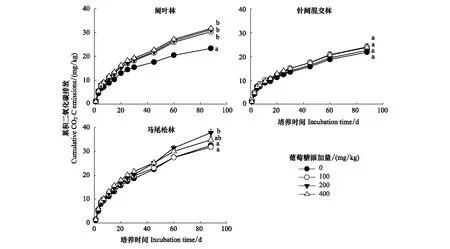
图1 土壤累积CO2排放动态(平均值±标准误,n=3)Fig.1 Dynamics of cumulative CO2 emission from different forest soils (Mean±SE, n=3)不同小写字母表示同一林型各处理间在P<0.05水平上差异显著
2.2 葡萄糖添加对土壤不同来源CO2排放的影响及相对激发效应
葡萄糖的添加明显抑制了土壤有机碳的矿化,即呈现负的激发效应(图2)。但是葡萄糖对土壤激发效应强度的影响因林型和添加量而异(图2)。在阔叶林,土壤来源CO2排放量随着葡萄糖添加量的增加而显著降低,在100、200、400 mgC/kg处理下降低了25.8%、51.2%和61.4%。在针阔混交林中,土壤有机碳矿化的减少量约为35%—63.2%。在马尾松林中,葡萄糖的添加使土壤有机碳的矿化量降低了63%左右,但是100、200、400 mgC/kg处理下对土壤有机碳矿化的影响并不明显。从图3得知,三种林型土壤的相对激发效应均为负值,且阔叶林土壤的相对激发效应随着葡萄糖添加量的增加而增强,差异达显著水平(P<0.05);针阔混交林土壤在添加量为200 mgC/kg时相对激发效应是最弱,400 mgC/kg添加量时最强;而马尾松林土壤的相对激发效应对葡萄糖添加量的响应并不敏感,但是在相同葡萄糖添加量下马尾松林引起的激发效应强度大于其他两个林型土壤。
葡萄糖来源CO2排放在三个林型中也存在差异(图2)。在阔叶林中,葡萄糖来源的CO2排放量在添加量增加下占总排放量的42.8%—71.5%,且随着葡萄糖添加量的增加而增加。在针阔混交林中,葡萄糖来源CO2排放量在葡萄糖添加量为200 mgC/kg时最低,400 mgC/kg时最高,葡萄糖添加量占总CO2排放量的37.1%—66.3%,在马尾松林中,在葡萄糖添加量为200 mgC/kg时葡萄糖来源CO2排放量最大,并显著高于其他两种葡萄糖添加模式,在该林型中,葡萄糖来源CO2占总CO2排放量的61.5%—67.1%。
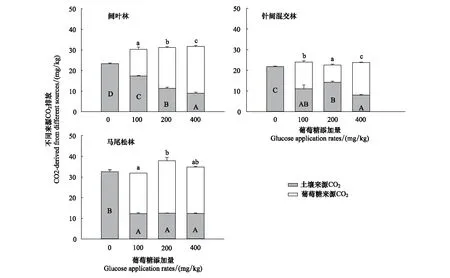
图2 土壤与葡萄糖来源CO2排放量(平均值±标准误,n=3)Fig.2 CO2-derived from soil and glucose mineralization (Mean±SE, n=3)不同小写字母表示同一林型葡萄糖来源CO2排放在各处理间存在显著性差异(P<0.05),不同大写字母表示同一林型土壤来源CO2排放在各处理间存在显著性差异(P<0.05)
2.3 葡萄糖添加对土壤微生物生物量碳以及葡萄糖添加占微生物碳量百分比的影响
不同葡萄糖输入量的添加对三种林型土壤的微生物生物量碳(MBC)没有造成差异,并且针阔混交林土壤中MBC低于阔叶林土壤和马尾松林土壤。葡萄糖添加量与土壤微生物碳量的比值在阔叶林中分别为16%—75.8%;在针阔混交林中为32.9%—124.3%;在马尾松林中为19.3%—74.7%(图5)。

图3 葡萄糖添加量对土壤相对激发效应的影响(平均值±标准误,n=3)Fig.3 Effect of the glucose application rate on the relative priming effect (Mean±SE, n=3)
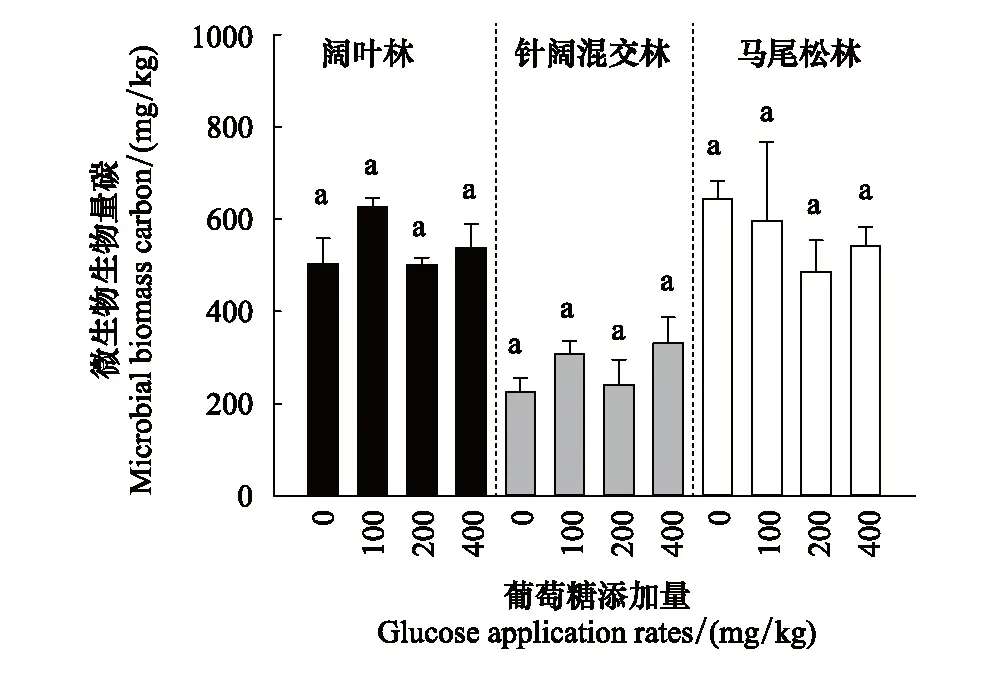
图4 葡萄糖添加对土壤微生物生物量碳的影响(平均值±标准误,n=3)Fig.4 Effects of glucose application rates on MBC (Mean±SE, n=3)
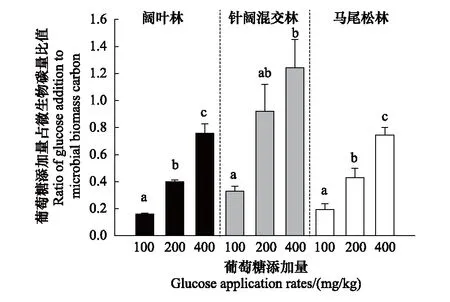
图5 葡萄糖添加量占微生物碳量比值(平均值±标准误,n=3)Fig.5 Ratio of the amount of the glucose addition to microbial biomass carbon (Mean±SE, n=3)
2.4 葡萄糖添加对土壤PLFAs的影响
葡萄糖的添加在一定程度上提高了三个林型土壤总PLFAs和细菌的丰度,以及真菌细菌比(图6)。虽然在阔叶林土壤中上述这些指标随葡萄糖添加量的增加并未达到显著水平(P>0.05),但是存在增加的趋势;在针阔混交林土壤中高葡萄糖添加量下(400 mgC/kg)使细菌、放线菌、细菌真菌比和总PLFAs的含量显著增加;马尾松林土壤中200 mgC/kg添加量下提高了细菌的含量和细菌真菌的比值。
2.5 葡萄糖添加对土壤可利用氮的影响
葡萄糖的添加显著降低了土壤可利用氮的含量(图7)。这种降低在阔叶林和针阔混交林中最为明显。在阔叶林中,可利用氮的减少量介于6.8%—26.2%;在针阔混交林中可利用氮含量降低了4.4%—19.7%,在马尾松林中高葡萄糖添加下减少了13.3%左右,而其余三种处理的差异不显著(P>0.05)。
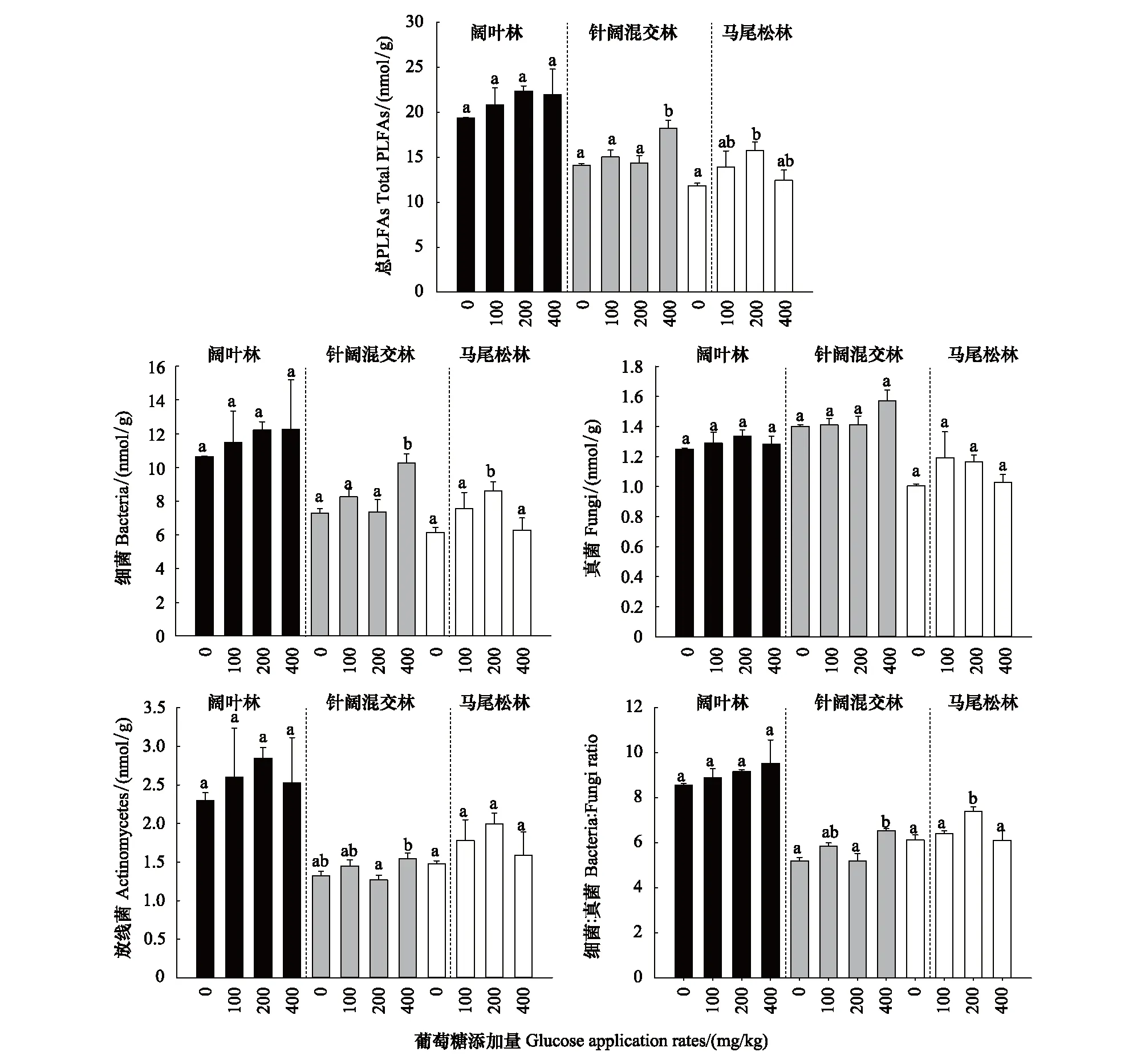
图6 葡萄糖添加对土壤微生物磷酸脂肪酸(PLFAs)含量的影响(平均值±标准误,n=3)Fig.6 Effects of glucose application rates on microbial phosphate fatty acid (PLFAs) content(Mean±SE, n=3)
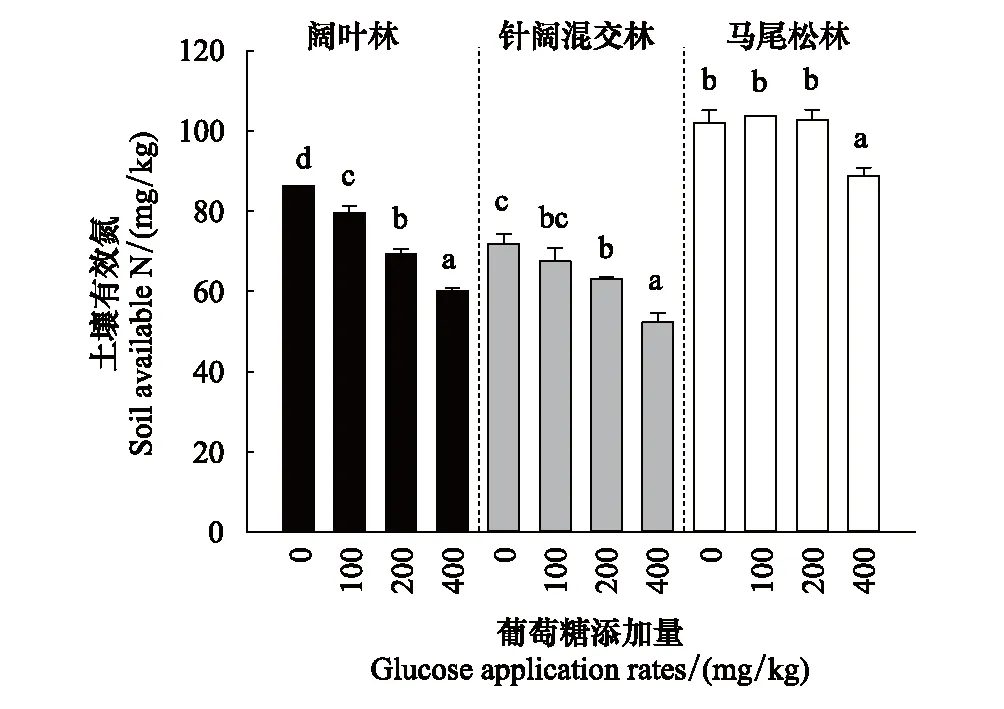
图7 葡萄糖添加对土壤可利用氮变化(平均值±标准误,n=3)Fig.7 Effects of glucose application rates on soil available N (Mean±SE, n=3)
2.6 土壤相对激发效应与土壤生物化学指标的关系
从表2可以看出,土壤总CO2排放、土壤来源CO2、相对激发效应和葡萄糖添加量与微生物碳量之比受森林类型、葡萄糖添加量以及它们之间交互作用的影响。而微生物指标主要受林型的影响。
通过皮尔森相关分析,在阔叶林中土壤相对激发效应与土壤可利用氮量呈正相关关系,和葡萄糖添加量与微生物碳量之比呈负相关关系;在针阔混交林中土壤相对激发效应和放线菌呈负相关关系;在马尾松林中和真菌呈负相关关系(表3)。
3 讨论
3.1 易分解有机碳输入量对不同林型土壤激发效应的影响
本研究中外源有机碳的添加显著抑制了土壤有机碳的矿化(图3),形成负的激发效应,这与近年来大部分研究的结果不同,之前的研究对易分解有机碳的输入大多观察到的激发效应是正向的[11,16]。两者结果的不同可能与本研究中外源易分解有机碳的输入量较高有关,进而使土壤微生物在外源有机质输入后优先利用了外源易分解有机质而减少了对原来土壤有机碳的利用[27],形成负激发效应,如De Graaff等[22]发现较高的外源有机碳输入下(21.7 mgC/g)土壤的激发效应为负向,并认为是外源有机碳输入量的增加使土壤微生物发生对底物选择性利用的结果。而Luo等[17]认为森林土壤由于存在凋落层,因此有机质输入是常见的,就会使得兼性利用SOC和外源有机质的土壤微生物种类增加,因而输入外源易分解有机质后会进行底物选择利用。本研究中易分解有机碳的输入抑制了SOC的分解,并且随着输入量的增加葡萄糖来源CO2排放量也相应地增加,证明土壤微生物优先利用易分解有机碳,减少了对SOC的利用,从而出现负激发效应(图2)。从底物的角度来说可能是葡萄糖作为易分解有机物相对于SOC可以更好被土壤微生物利用,并且之前的研究认为葡萄糖在其分解时的产物和土壤有机质通过黏合作用而降低了SOC的分解[9]。

表2 双因素方差分析结果
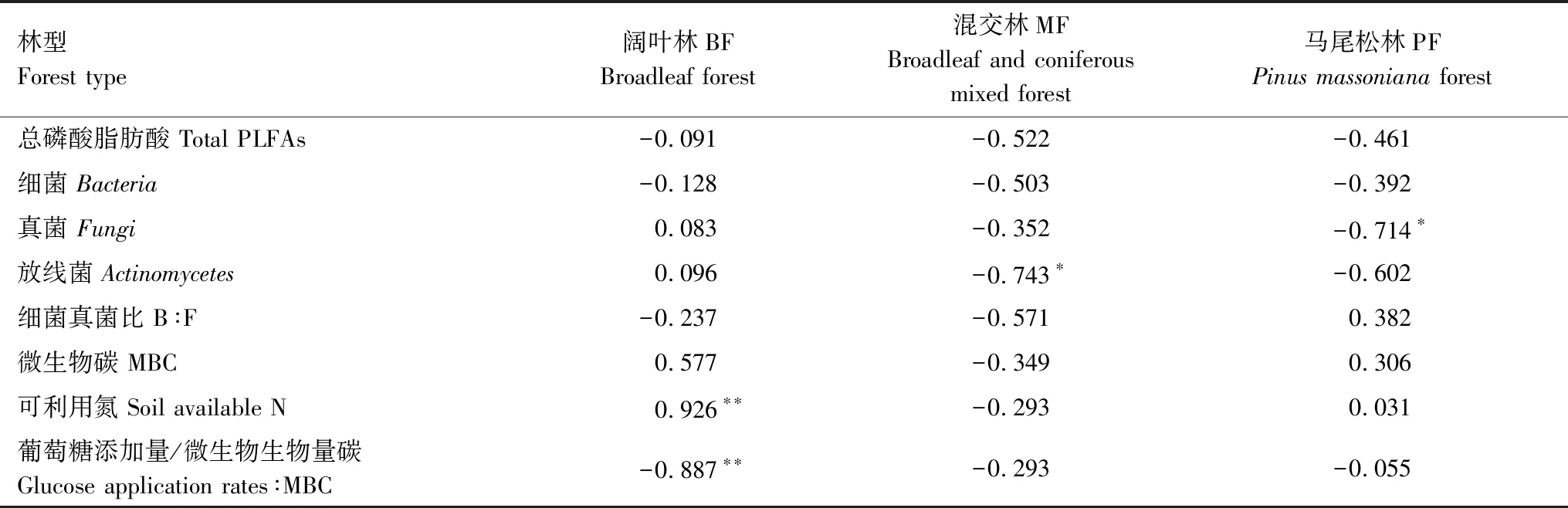
表3 土壤相对激发效应与土壤生物化学指标之间的相关关系
3.2 微生物群落与土壤可利用氮对易分解有机碳输入增加下土壤激发效应的影响
微生物的生长和活性很大程度上依赖于底物的可利用程度,这两者通过激发效应影响了SOM的分解[28]。而激发效应反映了两个种类的微生物(K-型微生物和r-型微生物)在外源碳的输入下的竞争模式,在易分解有机物输入土壤的前期由细菌主导,后期真菌占主导作用[21- 22]。在本研究中易分解有机碳的输入引起的激发效应强度在不同林型土壤中存在差异,虽然之前研究发现土壤激发强度和外源有机碳输入量之间没有明确的线性关系[18],但是Blagodatskaya和Kuzyakov[29]研究发现,外源有机质总量对激发效应的影响更多取决于外源碳输入量和MBC的比例,当碳输入量少于MBC的50%时,激发效应强度随外源碳输入量线性增加,当碳输入量相当于MBC的50%—200%时,激发效应强度与碳输入量呈指数减少,当碳输入量大于MBC的200%时,对激发效应的影响不明显。通过测定PLFAs(图6)可得知易分解有机碳的输入对阔叶林土壤微生物群落没有影响,表明阔叶林土壤的微生物对易分解有机碳的输入的响应不敏感。之前也有相似的研究发现,当易分解有机碳输入到土壤中虽然引起了激发效应但是土壤微生物群落组成并没有发生显著的变化,并且认为这是由于易分解有机碳的添加使土壤微生物代谢酶活性受到影响导致的[20,22]。从外源有机碳占土壤微生物碳量的比来说,阔叶林土壤的外源易分解有机碳输入量占MBC量的16%—76%,激发强度随着添加量的增加呈增加趋势,说明阔叶林土壤对外源易分解有机碳的添加更敏感,这一结果与张政等[30]研究的结果相似,他在研究三明格氏栲阔叶林发现,与碳含量较低的凋落物相比,碳含量较高的凋落物减缓了原有土壤有机碳的分解,即呈现负的激发效应。并且阔叶林土壤的可利用氮随着外源易分解有机碳的输入量增加而降低(图7),说明影响阔叶林土壤激发效应强度的因素可能跟土壤养分有关,通过皮尔森分析我们证实了这一点(表3),也就是说土壤养分越充足阔叶林土壤负激发强度越大。针阔混交林和马尾松林土壤分别与放线菌和真菌存在负相关关系(表3),说明对于混交林和马尾松林土壤来说放线菌和真菌丰度越大,激发强度越小。这类K-型微生物可兼性利用易分解和难分解碳源,因此放线菌和真菌丰度升高则会加速利用SOC,使负激发效应降低。对于马尾松林土壤来说三种外源易分解有机碳的添加量对激发强度和土壤可利用氮的含量并无影响,可能是即使是最低输入量也已到达马尾松林土壤微生物利用碳的饱和值,进而减少了对SOC的利用[11]。从氮的可利用性角度来说,有研究表明易分解有机碳输入土壤导致土壤中氮的固持,那么微生物则需要分解土壤中原有的有机质释放可利用氮来满足自身对氮养分的需求,而这一过程将加速土壤原有有机碳的矿化,形成正的激发效应[31]。也有研究表明外源易分解碳输入土壤中如果土壤中的氮素缺乏,不能够维持土壤微生物生长所需要的碳氮化学计量比,则土壤微生物的活性将受到抑制,这将降低其对土壤原有有机碳的分解利用,即形成负的激发效应[10]。从图6和图7中得知,随着葡萄糖添加量的增加土壤有效氮含量降低,而土壤微生物群落并未发生转变,表明土壤中的可利用氮并不是限制土壤微生物代谢的限制因素。对于微生物来说土壤中的氮素依旧能够满足其利用分解葡萄糖的需求,只有当土壤中的可利用氮低于某一个临界值时,微生物才会通过矿化原有土壤有机质来获取氮源。
4 结论
外源易分解碳对不同林型土壤有机碳的矿化均有抑制作用,形成负激发效应。而且土壤激发效应强度与林型有关,其中阔叶林土壤的负激发效应强度随着外源易分解碳的添加量的增加而增强,针阔混交林土壤激发效应强度呈先增加后减小的趋势,马尾松林对易分解有机碳输入量的响应并不明显,但是激发效应强度大于其他两种林型土壤。阔叶林激发效应强度并非取决于土壤微生物的组成,而是取决于土壤可利用氮含量以及葡萄糖添加量与微生物碳量的比;针阔混交林受到放线菌的影响;而马尾松林土壤受真菌群落的影响。

