冠心病患者血清肌腱蛋白C水平变化及临床意义
庞阳 梁春 伍锋 厉娜 黄志刚
200003 海军军医大学附属上海长征医院心血管内科
肌腱蛋白C(Tenascin C,TNC)是一种在胚胎发生过程中短暂表达的细胞外基质糖蛋白,在已经发育成熟的器官中只有低水平的TNC表达[1-3]。机体在特定状态下如炎症、感染、肿瘤、损伤和重构等病理条件可上调TNC的表达[4]。动物实验表明,TNC在动脉粥样硬化斑块中强烈表达,并优先在脂质核心、斑块肩部和破裂区域周围富集[5]。此外,Jin等[6]发现在小鼠模型中TNC和早期动脉粥样硬化和血管损伤存在相关性。TNC水平也与冠状动脉钙分数显著相关。基于以上证据,推测TNC参与了冠状动脉粥样硬化的病理生理机制,对冠心病的发病和预后可能有预测价值。因此,本研究旨在评估TNC在冠心病患者中的预后价值,为临床实践提供新的证据。
1 对象和方法
1.1 研究对象
纳入2017年1月至2018年1月于本院心内科住院行经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)的冠心病患者200例,其中男性108例。根据CAD种类,患者分为稳定性心绞痛组(stable angina pectoris,SAP)88例,急性冠状动脉综合征(acute coronary syndrome,ACS)112例。纳入标准:(1)年龄18~75岁;(2)确诊为冠心病:参照中华医学会冠心病指南诊断标准[7-8];(3)均行PCI治疗。排除标准为:(1)既往曾发生ACS;(2)严重心力衰竭(NYHA心功能Ⅳ级);(3)恶性肿瘤史;(4)严重肝、肾功能不全;(5)激素替代疗法;(6)结缔组织疾病或自身免疫性疾病;(7)精神疾病;(8)甲状腺疾病。本研究方案已得到本院伦理委员会审核批准,研究流程严格遵循赫尔辛基宣言,所有研究对象均签署知情同意书。
1.2 方法
收集患者住院资料:包括年龄、性别、体质指数、吸烟、冠心病家族史、高血压、糖尿病、心房颤动、肌钙蛋白I、C反应蛋白、肌酐、血脂;同时,收集患者药物治疗信息,包括抗血小板药物、血管紧张素转换酶抑制剂/血管紧张素受体拮抗剂、他汀类药物、β受体阻滞剂。
1.3 TNC检测
患者入院第二天晨取空腹血5 ml,4 500 r/min离心8 min,取上清置于-80℃冰箱备用,从抽血至测定TNC不超过3 h。TNC的测定采用酶联免疫吸附法,试剂盒购自于武汉优尔生物,为单克隆抗体4F 10TT。使用酶标仪测量波长450 nm处的吸光度。 根据不同浓度重组TNC建立的标准曲线,测量每位患者的TNC浓度。
1.4 随访计划及观察指标
采用门诊随访与电话随访相结合的方式进行随访,随访截止时间为2018年12月31日。有心绞痛症状者入院复查造影。本研究终点为主要不良心血管事件(major adverse cardiovascular events,MACEs)的复合终点,包括心血管原因死亡、再发心肌梗死和再次血运重建。
1.5 统计学方法
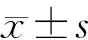
2 结果
2.1 两组的一般资料情况
共纳入200例行PCI的冠心病患者,其中男性102例(51.0%)。两组年龄、性别、吸烟、心房颤动、冠心病家族史、替格瑞洛/氯吡格雷、阿司匹林、他汀和β受体阻滞剂等差异无统计学意义(均为P>0.05)。ACS组患者的体质指数、TNC、高血压和糖尿病患病率、肌钙蛋白I、C反应蛋白和肌酐均高于SAP组(均为P<0.05)。见表1。
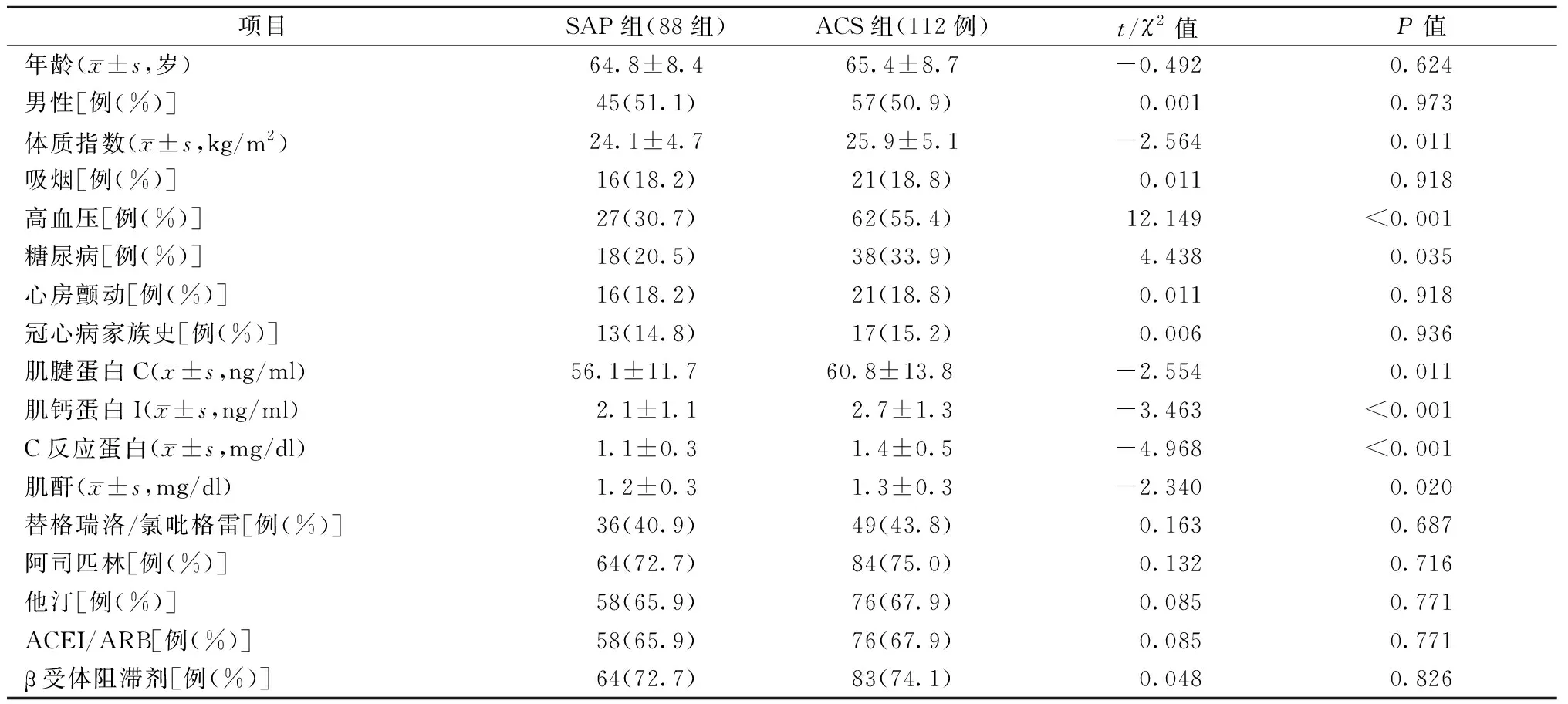
表1 两组冠心病患者的基线资料比较
2.2 随访结果
随访12个月,4例患者失访。其中,MACEs共发生21例(SAP患者9例,ACS患者12例),包括心血管原因死亡3例(SAP患者1例,ACS患者2例),再发心肌梗死7例(SAP患者3例,ACS患者4例),靶病变血运重建11例(SAP患者5例,ACS患者6例),故1年MACEs发生率为10.7%,两组的MACES发生率无明显差异(10.2%比10.7%,P=0.911)。
2.3 ROC曲线
经ROC曲线分析发现,在所有冠心病患者中,TNC预测冠心病发生MACEs的最佳截断值为52.3 ng/ml,敏感度为83.6%,特异度为68.5%,AUC为0.755;在稳定型心绞痛患者中,TNC预测冠心病发生MACEs的最佳截断值为52.8 ng/ml,敏感度为87.8 %,特异度为67.3%,AUC为0.737;在ACS患者中,TNC预测冠心病发生MACEs的最佳截断值为51.6 ng/ml,敏感度为90.6%,特异度为66.0%,AUC为0.770。
2.4 单因素及多因素Cox回归分析
以MACEs为因变量进行单因素Cox回归分析发现,吸烟、高血压、糖尿病、TNC、肌钙蛋白Ⅰ是冠心病患者发生MACEs的危险因素(均为P<0.05)。将单因素分析有意义变量纳入多因素Cox回归分析,发现吸烟(HR=2.43,95%CI:1.56~2.37)、糖尿病(HR=1.26,95%CI:1.19~1.87)、TNC(HR=1.27,95%CI:1.16~1.65)及肌钙蛋白I(HR=1.14,95%CI:1.08~1.44)是患者发生MACEs的独立危险因素。
3 讨论
在过去的几十年中,冠心病的治疗取得了很大进展,但冠心病患者的5年生存率并未显著改善[9]。近年来,随着精准医学的发展,对疾病的精确诊断和预后的准确预测要求越来越高,确定一种对评估冠心病预后具有高度敏感性和特异性的生物标志物,对于优化个性化治疗和降低死亡率十分必要。本研究发现,血清TNC水平升高是行PCI的冠心病患者预后不良的独立预测因素,当TNC为52.3 ng/ml时,其预测MACEs的灵敏度为83.6%,特异度为68.5%,AUC为0.755,故对冠心病患者预后具有一定的预测价值。
国内尚未发现TNC与冠心病患者预后相关性的研究。既往研究发现,TNC可能参与了冠心病发生发展的一系列病理生理过程。黄君文等[10]在高脂饲料喂养的小鼠中观察到,随着饲养时间的延长,实验组小鼠TNC表达水平升高,与动脉粥样硬化斑块不稳定性增加相关。同样,Gao等[11]报道,冠心病患者与非冠心病患者相比,其血清TNC水平显著升高(P<0.001)。在急性心肌梗死小鼠模型中,组织学分析发现TNC mRNA和蛋白在梗死心肌中高度表达[12]。且在心肌梗死患者中,TNC的表达与冠心病患者的病变复杂程度密切相关[13]。本研究发现血清TNC水平升高是行PCI的冠心病患者预后不良的独立预测因素,与先前的研究一致。
TNC预测冠心病患者预后不良的机制尚不清楚。研究表明,冠心病患者细胞水平的心室重构包括心肌细胞肥大和死亡、细胞外基质沉积、间质纤维化和促炎细胞因子的上调等。而心脏细胞外基质的组成包括结构蛋白,例如纤维胶原和基质细胞蛋白,它们通过直接与细胞相互作用或通过调节生长因子、细胞因子、蛋白酶和其他细胞外基质蛋白的活性,作为细胞功能的生物介质介导心室重构[14]。TNC是一种典型的基质细胞蛋白,在成人心脏中正常情况下不表达,但在病理条件下短暂出现,在组织重塑中起重要作用[15]。最近的研究表明,TNC敲除小鼠在冠状动脉永久结扎后第28天时心室重构显著降低,心脏功能较野生型小鼠有所改善。此外,TNC敲除鼠在第28天残余心肌间质纤维化较野生型明显降低,这一发现可能提示TNC可能加重心室重构的进展[16]。在组织修复的早期,心室重构伴随着细胞外基质的变化,一些与基质转换相关的分子,如基质金属蛋白酶及其组织抑制剂,一直是急性心肌梗死后左室重构和预后发展的关键。TNC减弱了心肌细胞对结缔组织的黏附,并上调了基质金属蛋白酶的表达和活性[17]。因此,TNC可能是一种新的细胞外基质重塑的生物标志物。
综上所述,本研究发现血清TNC水平升高是行PCI的冠心病患者预后不良的独立预测因素,为冠心病患者预后生物标记物选择提供了新的证据。
利益冲突:无

