鱼类原始生殖细胞标记基因研究进展
程琳 ,黄天晴,刘晨斌,谷伟,徐革锋,史秀兰,姚作春,王丽薇,王炳谦
(1.哈尔滨师范大学生命科学与技术学院,黑龙江 哈尔滨 150025;2.中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070)
鱼类早期胚胎发育阶段生殖细胞系与体细胞系发生分离,随后形成原始生殖细胞(primordial germ cells,PGCs)。PGCs 起源于胚胎外,通过胚胎组织迁移到生殖嵴,分化为精原细胞或卵原细胞,进一步发育成卵母细胞和精母细胞,最终形成成熟卵子和精子[1],是配子在胚胎中的前体。精子与卵子结合后将遗传信息传递给下一代,以保证物种延续和进化[2]。作为亲本与后代之间的联系,研究鱼类PGCs 发育及迁移对遗传资源保护、性别控制和水产养殖具有重要意义,也为研究其他生物提供了机制线索和模型[3,4]。生殖细胞具有特定的基因表达模式,脊椎动物的一些基因在PGCs 中特异表达,如Vasa,Dead end(dnd)和Nanos3 等,越来越多的研究以这些基因为标记来研究PGCs 的迁移和发育。
1 鱼类PGCs 的起源及形成机制
受精卵的细胞质中存在一些由特殊mRNA 和蛋白组成的细胞质决定因子,即生殖质(germ plasm),随着胚胎发育及细胞分裂,生殖质被不对称地分配到细胞中,含有生殖质的细胞将分化为PGCs[1]。生殖质为生殖细胞的发源地,决定PGCs 的形成及发育[5]。最开始由于缺乏PGCs 标记,只能利用光学和电子显微镜简单地鉴定PGCs 的形态特征。形态学研究表明,PGCs 一般为梨形、圆形或椭圆形,比体细胞大(直径通常为10~12 μm),细胞直径因不同种属及发育时期差异较大;核质分界明显,细胞核较大(一般为6~10 μm),位于细胞一侧,常呈圆形或分叶状,核膜清晰,核仁较明显(一般1~2 个)[6]。超微结构表明,PGCs 具有与线粒体相关的电子致密物。Nedelea 等[7]在鲤Cyprinus carpio PGCs 胞质中最早发现该物质。刘少军[8]将革胡子鲇Clarias lazera PGCs 中的这种电子致密物称为生殖质。这种结构不仅能储存PGCs 分化及发育所需的RNA 和蛋白质,在生殖系发育中发挥关键作用,还可能参与调节生殖系的转录及翻译[9,10]。有些鱼类的PGCs 中还有卵黄块,在胚胎发育早期为PGCs 提供营养物质[8]。在迁移期间,PGCs 中还常见丝状伪足或叶状伪足[11]。
不同种属鱼类的PGCs 起源不同,大致可分为两种:一种起源于内胚层,如中华鲟Acipenser sinensis、虹鳟Oncorhynchus mykiss、大麻哈鱼Oncorhynchus keta、泰山螭霖鱼Varicorhinus macrolepis、革胡子鲇和黑尾近红鲌Ancherythroculter nigrocauda 等,都在原肠早期内胚层中鉴别出PGCs[12];另一种起源于中胚层,如普氏七鳃鳗Entosphennus wilderi 和泥鳅Misgurnus anguillicaudatus[11]。
随着斑马鱼Danio rerio PGCs 中特异表达基因Vasa 的出现,鱼类PGCs 研究取得了长足进展[13]。Vasa RNA 在早期卵裂胚胎中被定位到32 细胞期的4 个细胞中。这4 个细胞随后分化为PGCs,表明在胚胎发育早期斑马鱼的生殖细胞与体细胞就已经发生分离,在原肠期进入内胚层后PGCs 数量保持不变并开始积极迁移到形成性腺的部位[14]。之后在大西洋鳕Gadus morhua、大西洋鲑Salmo salar、大菱鲆Scophthalmus maximus、鲤、金鱼Carassius auratus 和泥鳅等中发现了与斑马鱼具有相似的PGCs形成模式,称为先成论[15]。PGCs 还有一种形成方式称为后成论,该观点认为,生殖细胞是由体细胞周围组织诱导分化而来,在发育晚期才能鉴定出生殖细胞,如青鳉Oryzias latipes Vasa RNA 在卵裂期胚胎细胞中广泛分布,直到原肠晚期PGCs 中才鉴定出Vasa 基因[16],虹鳟、真鲷Pagrosomus major 的PGCs形成模式与青鳉相似[15]。
对斑马鱼和青鳉PGCs 迁移方式的研究比较系统和深入。目前认为有3 种方式迁移至生殖嵴:通过脏壁中胚层到达肠系膜,再迁移至生殖嵴;通过体节迁移沿体壁中胚层到达生殖嵴;最后一种为借助血液循环迁移至生殖嵴[17]。斑马鱼在囊胚期时,PGCs 开始从非运动模式转变为运动模式[18]。在体细胞发生后期,PGCs 位于肠道周围,被中胚层体细胞包围,通过肠道和肠系膜的中胚层从体细胞附近开始迁移[19]。在体节发育阶段,PGCs 位于外侧中胚层,呈两条线性分布,随后这些细胞沿着背-腹轴向躯干腹部迁移,然后聚集在原始生殖嵴中[20]。鱼类PGCs 在迁移中除自身独特性外,还具有主动及被动迁移能力,如有些鱼类PGCs 表面观察到伪足形成,认为这是PGCs 主动迁移的标志;一些PGCs在迁移过程中受到周围组织细胞推动而被动迁移[21]。
2 鱼类PGCs 标记基因
在许多物种中已鉴定的生殖质是一些保守的RNA 结合蛋白或编码这些蛋白的mRNA,对生殖细胞的命运至关重要。已生殖细胞中发现的特异表达基因,如Vasa、Nanos、Dead end(dnd)、bucky ball、Ca15a、sdf1 和Dazl,可用作PGCs 特异分子标记。研究这些基因的功能具有理论意义,对鱼类生殖细胞操作技术及相关应用研究,如生殖细胞生物学、遗传资源保护、性别控制等具有潜在的应用价值。本文综述了几种常见标记基因的研究进展,为了解鱼类标记基因提供借鉴。
2.1 Vasa 基因
Vasa 基因(也称为Ddx4)是DEAD-box(Asp-Glu-Ala-Asp)蛋白家族的重要成员,参与RNA 编辑、mRNA 启动、rRNA 加工、翻译起始、核mRNA 输出以及mRNA 降解等过程[22]。在大多数鱼类中,仅在生殖细胞系中检测到Vasa 基因杂交信号。该基因为生殖细胞形成和配子发生所必需,被作为优良分子标记广泛用于鱼类PGCs 的起源、迁移、分化及性腺和配子发生等研究中[23]。目前,已在许多鱼类中成功克隆得到其同源基因,如斑马鱼[13]、虹鳟[24]、罗非鱼Oreochromis spp[25]、青鳉[16]、异育银鲫Carassius auratus gibelio[26]、黄鳝Monopterus albus[27]、牙鲆Paralichthys olivaceus[28]、草鱼Ctenopharyngodon idellus[29]、鲈Dicentrarchus labrax[30]、大菱鲆[31]、大西洋鳕[32]、七彩神仙鱼Symphysodon haraldi[33]、半滑舌鳎Cynoglossus semilaevis Gunther[20]、革胡子鲶[34]、南方鲈Silurus meridionalis[35]、石首鱼Totoaba macdonaldi[36]、金鱼[37]、翘嘴红鲌[38]和真鲷Pagrus major[39]等。
Vasa 基因由Schüpbach 等于1986 年首次在黑腹果蝇Drosophila melanogaster 中发现,证实其为生殖质的前体,具有母源遗传效应。该基因发生突变会导致生殖细胞无法正常形成[40]。Vasa 亚族蛋白具有DEAD-box 家族典型的8 个保守结构域(图1)[41],AXXXGKT 和DEAD 分别为ATP 酶A-motif 和ATP酶B-motif 结合域,A 区域为ATP 结合位点,B 区域为ATP 水解部位。SAT 保守结构域也是ATP 结合位点,GRIGRXXR 与其他几个结构域可能间接参与RNA 结合及解旋活动[42]。锌指结构(CCHC 框)为Vasa 蛋白特有结构,该结构可能与核酸结合有关,也可能与靶RNA 分子特异性相关。大多数Vasa 蛋白的N 末端存在甘氨酸富集区(G-rich region)和多个RGG(arginine-glycine-glycine)重复序列。N 末端起始密码子及C 末端终止密码子附近有Vasa 保守结构常见的色氨酸(W)残基,有些Vasa 蛋白还具有ARKF 框、GXVGXA 框及位于C 末端的EXEEXW框[43]。
研究表明,七彩神仙鱼从受精卵开始Vasa 基因即稳定表达,一直到出膜期,均检测到表达信号,到囊胚期时含量达最大,随后逐渐降低[33]。罗非鱼和青鳉早期胚胎中,到原肠早期Vasa mRNA 均高表达,原肠期时开始下降,呈低表达[16,25]。这些研究均证实:Vasa 基因是母源性表达基因,Vasa 在PGCs中特异性表达,随着胚胎发育,直到出膜之前,体细胞开始大量分裂,数量逐渐增加,此时与体细胞相比,生殖细胞占总细胞数减少,Vasa 基因的表达量降低。在斑马鱼胚胎第一次和第二次卵裂沟末端检测到Vasa 信号,信号逐渐迁移到囊胚期的四个卵裂球中,随后卵裂球分化成PGCs,在囊胚期结束之前,PGCs 中富集大量Vasa mRNA 和合子Vasa 转录物。随着胚胎发育,母源性Vasa mRNA 逐渐在生殖质附近聚集,这证实Vasa mRNA 是组成斑马鱼生殖质的重要成分[13]。
孙冬捷等[44]研究发现,Vasa 基因在斑马鱼不同发育期生殖细胞中特异性表达,整个发育阶段的表达量先上升再下降;同一发育期,精巢与卵巢中Vasa 基因表达量基本一致,卵巢略高于精巢。七彩神仙鱼各发育期卵巢中Vasa 基因的表达量均高于精巢[33],繁殖前的精巢中含有大量的精子,但检测到的Vasa 基因表达量却低于繁殖后期,这也进一步证实Vasa 为母源性基因。
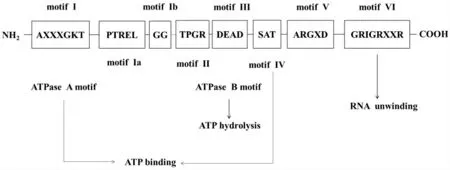
图1 Vasa 蛋白8 个保守结构域[41]Fig.1 Eight conserved motifs in Vasa protein[41]
鱼类Vasa mRNA 在精子和卵子发生中的表达模式不同。在卵子发生过程中,Vasa 基因在卵原细胞中杂交信号较弱,在I、II 期的卵母细胞中杂交信号较强,在III、IV 期卵母细胞中又急剧减弱,但外周皮层区域阳性信号仍较强,呈现低高低的表达模式[20,37]。不同鱼类精子发生过程一般也不同。Kobayashi 等[25]研究显示:罗非鱼Vasa 基因在精原细胞中大量表达,初级精母细胞中表达下降,胞质中的杂交信号均匀且强烈,在次级精母细胞、精子细胞和成熟精子中则没有杂交信号,这一模式与金鱼、青鳉等相似;Vasa 基因在异育银鲫精原细胞中表达量低,但在初级精母细胞中大量表达,精细胞和精子中信号较低或检测不到,此结果与七彩神仙鱼、半滑舌鳎和革胡子鲶等结果相似[26]。
虽然Vasa mRNA 在卵子和精子发生过程中表达模式不同,但Vasa 基因信号均在配子发生前期较强,后期较弱或不表达。这证实Vasa 基因对早期生殖细胞产生、分化及发育过程中发挥重要作用。在一些报道中,Vasa 基因mRNA 的表达不止局限于生殖细胞,其他组织中也有表达,如青鳉脑、躯干和尾部[45];虹鳟心脏和脑部[24]及半滑舌鳎的心脏[46]都曾报道过Vasa mRNA 的低量表达,这说明Vasa 对体细胞的发育也有一定作用。
2.2 Dnd 基因
Dead end(Dnd)是Gilbert Weidinger 等2003 年首次在斑马鱼中发现并被分离出来。该基因能编码RNA 结合蛋白,是组成生殖质的重要成分,在生殖质及PGCs 中特异表达,对PGCs 存活和迁移至关重要[10,47]。Dnd 在进化上很保守,其基因编码的蛋白包含一个保守的RNA 识别基序(RRM)和五个保守结构域(图2)[48],其中RRM为主要的功能区域。五个保守结构域包括N 末端区域(NR)和四个C 末端区域[49]。Dnd 蛋白位于斑马鱼PGCs 核周的生殖质颗粒中,在核周区域的亚细胞定位与RRM有关,若RRM突变将导致Dnd 无法从核中区域转移到生殖质颗粒中,导致其功能丧失;虽然在亚细胞定位中Dnd 蛋白的C 端不起主要作用,但若其发生突变也会显著影响Dnd 功能[50]。Dnd 基因还具有特殊的稳定结构(3’非翻译区即3’UTR)。这种稳定依赖于mRNA 与某些蛋白质的相互作用,如Dnd-1,保护它们免受miRNA 介导的抑制,如斑马鱼Dnd 蛋白可与生殖系基因Nanos1 和tdrd7 的3’UTR 结合,防止miR-430b 复合物介导的RNA 将这两种基因降解[51]。最新的研究表明:斑马鱼Dnd 蛋白的C 末端具有ATPase 活性,这种活性对于PGCs 的存活至关重要,且C 端突变将导致PGCs 数量减少[52]。Dnd基因对伪足的形成和稳定也有很大关系[10],敲除Dnd导致PGCs 错误迁移,斑马鱼不育[50]。
目前,在斑马鱼[10]、青鳉[53]、泥鳅[54]、金鱼[55]、尼罗罗非鱼[56]、大黄鱼Pseudosciaena crocea[47]、斯特拉鲟[57]、中华鲟[58]、大西洋鲑[59]、大菱鲆[60]、真鲷Pagrus major[61]、大西洋鳕[62]、牙鲆[63]、稀有鮈鲫Gobiocypris rarus[64]和半滑舌鳎[20]等鱼类中都成功克隆了Dnd同源基因。
Dnd 基因翻译受阻可完全抑制PGCs 在早期胚胎发生过程中的迁移和发育;Dnd 的缺失会导致PGCs 功能丧失[63]。方玲玲等[65]研究表明:敲除Dnd基因导致尼罗罗非鱼性腺中缺失生殖细胞,随着胚胎发育,雄性精巢中仅存在大量体细胞;精巢中还出现大量空腔,无法形成正常的配子。敲除大西洋鳕鱼Dnd 基因导致PGCs 相关基因mRNA 表达量降低。抑制泥鳅Dnd 基因导致生殖细胞消失,形成无生殖细胞的雄性个体[54]。Dnd 基因对mRNA 还具有保护作用,如斑马鱼PGCs 中,Dnd 可以通过与富含尿嘧啶区域的靶mRNAs(URRS)结合,阻碍一些短片段非编码的单链小RNA(miRNAs)对靶mRNA的降解[66]。
在早期胚胎发育中,青鳉Dnd 基因一直处于较高水平,直到桑葚胚阶段明显下降,且仅在性腺中高表达。原位杂交结果表明:青鳉卵巢中的卵原细胞和早期卵母细胞中Dnd 信号强烈。睾丸周围精原细胞信号强,初级和次级精母细胞中减弱,但在精子中却很难检测到。因此,也将Dnd mRNA 作为雄性青鳉生殖细胞在减数分裂前期和后期的标记物[48]。桂建芳等[67]用Dnd 特异性寡聚核苷酸介导的敲除方法,建立了一个完整的生殖细胞衰竭性腺模型,揭示了银鲫雌核发育中所有雌鱼原始生殖细胞的完全缺失,改变了性别偏向基因的表达,发生不育雄性。上述结果表明:异育银鲫Dnd 转录物能成为配子发生不同阶段的极好标记,也是追踪胚胎发育过程中PGC 迁移的有用标记[53]。Lin 等[60]发现,大菱鲆Dnd 基因发生模式与斑马鱼似,仅在生殖细胞中特异性表达,并呈现明显的性别二态性,推测Dnd 基因可能参与大菱鲆性别分化过程。

图2 Dnd 结构简图[48]Fig.2 The structure diagram of Dnd protein[48]
2.3 Nanos 基因
Nanos 基因最先在果蝇中发现,是一种母源效应基因,能够编码一种RNA 结合蛋白,与Pumilio RNA 结合蛋白相互作用形成核蛋白复合物,共同抑制母源hunchback mRNA 的翻译,调控果蝇胚胎后腹部细胞的分化,其编码的蛋白是组成生殖质的重要成分[68,69]。Nanos C 端有两个为翻译调控所必需的特异Cys-Cys-His-Cys(CCHC)锌指基序[70],缺失或突变都使Nanos 失去功能。Nanos 参与PGCs 的迁移和维持,为生殖干细胞自我更新和生殖细胞发育所必需,突变会导致性腺中极细胞无法正常迁移,且无法形成生殖细胞,并造成胚胎大量死亡[71]。如果蝇缺失Nanos 基因将不能形成腹部,形成的极细胞不能准确迁移,分化出的生殖细胞不具有正常功能并最终发生凋亡[72]。
目前,已鉴定出的Nanos 同源基因有三种:Nanos1、Nanos2 和Nanos3。这三种Nanos 同系物在不同物种中的功能不同。秀丽隐杆线虫Caenorhabditis elegans 含有三个Nanos 同源基因,Nanos1 和Nanos2 对PGCs 有调节作用,单独缺失时,多数生殖细胞都能正常发育,但同时缺失则导致线虫不孕;Nanos3 与FBF-1 能调节雌雄同体线虫精子和卵子发生的转换点[73]。小鼠的Nanos1 在中枢神经系统、成体大脑和睾丸输精管中均有高表达,但在生殖细胞发育过程中没有表达。缺乏Nanos1 的小鼠并未表现出异常,表明Nanos1 对小鼠性腺发育并非必需[74]。据报道,Nanos2 只在雄性细胞中表达,敲除其导致成年睾丸中精原细胞丢失,因此将Nanos2 作为雄性生殖细胞的特异性标记,调控小鼠的性别决定[75]。Nanos3 在两性生殖细胞中均有表达,敲除Nanos3 会导致PGCs 在迁移过程中凋亡[76]。
对鱼类Nanos 的研究还不多,目前仅在斑马鱼、青鳉、日本鳗鲡Anguilla japonica、泥鳅、牙鲆、金鱼、鲱Clupea pallasi、大黄鱼、虾虎鱼Gobiidae、黑脊倒刺鲃Spinibarbus caldwell、白氏文昌鱼、中华鲟、团头鲂Megalobrama amblycephala 等鱼类中有过报道[77-79]。Koprunner 等[80]以Nanos 为标记基因,向缺失母源Nanos 的斑马鱼细胞胚胎注射Nanos3′UTR mRNA,证实了Nanos 是斑马鱼PGCs 迁移和成活所必需的基因。随后Draper 等[81]证实,Nanos对维持成体斑马鱼卵巢产生卵母细胞至关重要。青鳉的Nanos1 有两种亚型Nanos1a 和Nanos1b,Nanos1a 在卵母细胞和精子细胞周围的体细胞中表达,但Nanos1b 不表达。在成年卵巢和精原细胞仅有Nanos2 表达,但在性腺分化早期未发现该信号。Nanos3 在早期胚胎发生和成体青鳉雌性卵母细胞迁移的PGCs 中有所表达,因此,一般选用Nanos3标记PGCs[82]。Hitomi 等[83]发现,在胚胎发育过程中Nanos3 在体细胞和PGCs 中都能被转录,但只在PGCs 中被翻译,这与其3’UTR 密切相关,3’UTR区域的翻译调控元件(TCE)和微小元件能调控细胞特异性表达。向青鳉中注射GFP-半滑舌鳎Nanos 3′UTR mRNA,能够标记胚胎发育过程中的PGCs,这也证实了Nanos3 可作为鱼类PGCs 的理想标记基因[20]。
Nanos 基因在半滑舌鳎性腺中高表达;在精巢中的表达量高于卵巢,在其他组织中,脑和肝脏的表达量相对较高。原位杂交结果表明,半滑舌鳎Nanos mRNA 在卵巢中卵子发育I 期、II 期信号较强,之后逐渐减弱;在精巢中,主要在与精子形成相关细胞中高表达,其他细胞中未检测到信号,为典型的性别二态性表达[20]。Nanos 基因在黑脊倒刺鲃生殖细胞发生早期起重要作用,在后期作用并不是很大[84]。
比对发现,不同鱼类Nanos3 3’UTR 序列差异很大。在斑马鱼、罗非鱼等少数鱼类的3’UTR 中发现了识别结合miR430 促进RNA 降解的序列GCACUU。该序列附近存在U-rich 区域。研究发现,斑马鱼的Dnd 蛋白能够与Nanos3 3’UTR 的U-rich区域结合,抑制miR 430 与3’UTR 的结合,从而抑制PGCs 中Nanos mRNA 的降解[10]。朱林等[85]对团头鲂的研究也证实这一点。团头鲂Nanos3 3’UTR中存在一个非经典的miR430 识别位点(GCACTA)。该位点突变可影响Nanos3 3’UTR 对斑马鱼PGCs 的标记效率,证实其有利于Nanos3 在非PGCs组织中的降解。目前,关于Nanos3 3’UTR 的多变性了解的还很不透彻,还需要在其他硬骨鱼中进行相关研究。
3 小结
随着分离鉴定出的鱼类原始生殖细胞标记基因的增多,对PGCs 的研究也日益透彻。了解生殖细胞分化和配子发生过程中基因表达的变化,不仅为研究PGCs 不同发育阶段生殖细胞起源、迁移和分离奠定基础,也为鱼类的应用研究提供了理论支持。尽管对这些基因有了一定的了解和应用,但在很多方面都不成系统,对其功能的认识也只通过敲除、RNA 干扰及转基因等方式进行推测,对这些基因的研究也仅局限于生殖细胞,几乎没有在非生殖细胞中进行功能研究。因此,对这些鱼类标记基因的研究有着非常广泛的空间,可以在更多鱼类中发掘更多标记基因。随着RNA 定点表达(localized RNA expression,LRE)技术的广泛应用,更加明了对些标记基因在鱼类体内的调控机理,对鱼类生殖细胞研究及繁殖育种都有极大的帮助,对于生殖细胞体外培养和移植、濒危鱼类的保护和利用以及鱼类生殖发育生物学的研究都具有重要意义。

