三角帆蚌耗氧率和排氨率的昼夜变化及不同饵料浓度下的摄食节律
孙明龙,白志毅,傅百成,何志然,郭思鹏
(1.上海海洋大学农业农村部淡水水产种质资源重点实验室,上海 201306;2.上海海洋大学,上海水产养殖工程技术研究中心,上海 201306;3.浙江佰瑞拉农业科技公司,浙江 绍兴 311800)
耗氧率和排氨率是衡量动物生理代谢的重要指标,滤食性贝类摄食和这方面的生理代谢已有较多研究[1,2]。海水贝类,如青蛤Cyclina sinesis、华贵栉孔扇贝Chlamys nobilis 和马氏珠母贝Pinctada martensii 等[3,4]工厂化人工育苗技术较成熟,已达到规模化和产业化养殖,并且这些贝类摄食和代谢生理研究也较多,而淡水贝类的耗氧率、排氨率和摄食节律研究还较少。
三角帆蚌Hyriopsis cumingii 属双壳纲、真瓣鳃目、蚌科、帆蚌属,是我国主要淡水育珠贝类之一。中国珍珠产量约为世界总产量的80%,总淡水珍珠产量的95%,但是,我国珍珠的总产值却不足世界珍珠销售份额的10%[7,8]。我国淡水珍珠养殖还是传统养殖模式,引发了一系列的环境问题:滥用家畜粪便和化肥使养殖水体富营养化,养殖尾水通常直排或未达标排放,造成水环境污染[9],珍珠养殖产业迫切需要升级转型,寻找绿色生态养殖模式才是出路。工厂化循环水养殖模式是生态环保节水养殖模式,同时淡水珍珠高附加值的特点也满足工厂化养殖模式品种要求;因此,淡水珍珠工厂化循环水养殖模式是一种值得开发的模式。目前本实验联合相关企业对工厂化淡水珍珠蚌养殖已有探索,也取得了一定研究成果[10]。本实验在室内环境条件下研究了三角帆蚌的日代谢规律和摄食节律,可为工厂化养殖三角帆蚌的投喂管理提供一定的基础数据。
1 材料与方法
1.1 材料
实验蚌取自浙江佰瑞拉农业科技有限公司养殖基地,随机选取健康、规格相近的一龄三角帆蚌60 只,体尺参数分别为壳长(72.42±11.64)mm,壳宽(11.62±2.67)mm,体质量(18.43±4.21)g,清洗干净其表面附着物后,放入20 L 圆形塑料桶内暂养。暂养用水为曝气的自来水,溶氧量>5 mg·L-1,氨氮含量<0.020 mg·L-1,亚硝酸盐氮含量<0.005 mg·L-1,实验厢房内装有空调,用恒温棒控制水温在27℃。实验水体用增氧机增氧,3 d 换一次水,换水量30%。实验期间每天早上6 点投喂小球藻Chlorella sp.,使养殖水体小球藻浓度达1.0×109ind·L-1,适应饲养环境7 d 后,开始实验。
投喂的小球藻采自浙江佰瑞拉农业科技有限公司藻种池,用721 分光光度计、采用光密度法检测藻液浓度[11]。
实验结束时,用游标卡尺测量蚌的壳长、壳宽(精确到0.01mm);将蚌表面附着的杂物清理干净后,拭干水分称量蚌的体质量(精确到0.01g)。
1.2 方法
1.2.1 三角帆蚌耗氧率和排氨率的昼夜变化试验
将60 只蚌分为3 个重复组,置于3 个20 L 塑料桶内,其中对照组为不放蚌的空白组,每个桶内加入15 L 的自来水。试验开始前先将桶内充分曝气,实验早上6:00 开始,用恒温棒控制水温在27℃,采用静水法养殖,每隔2 h 检测水体溶氧含量以及氨氮含量,连续检测3 d。采取虹吸法取底部水样,夜间检测时用黑纱挡光。采用Winkler 碘量法测定实验水体的溶解氧量,采用奈氏比色法测定水体的氨氮浓度。
计算耗氧率以及排氨率,测量方法参考唐贤明等[12]。耗氧率(OR)=[(DOn-DOn+2-△DO空白)V]·(wt)-1,排氨率(NR)=[(Nn+2-Nn-△N空白)V]·(wt)-1,式中,DOn和DOn+2分别为实验n h 时和(n+2)h 时水体DO 含量(mg·L-1),△DO空白是n 到n+2 时2 h 内空白对照组溶氧量变化值,Nn和Nn+2 分别是实验开始n h 时和(n+2)h 时水体氨氮含量(mg·L-1),△N空白是n 到n+2 时2 h 内空白对照组氨氮含量值变化量,V 为实验水体体积,w 代表擦干后三角帆蚌总的湿重,t 为两次测量间隔的时间(h)。
1.2.2 不同饵料浓度下三角帆蚌昼夜摄食节律试验
实验蚌放入20 L 塑料桶内,按耗氧率和排氨率的昼夜变化试验分组进行4d 试验,根据预实验结果,设置投喂小球藻初始浓度依次为第1 d 1.9×109ind·L-1、第2 d 3.2×109ind·L-1、第3 d 4.1×109ind·L-1和第4 d 5.0×109ind·L-1,温度控制在27 ℃,pH 控制在7~8 之间,增氧保持桶内溶氧充足,每个浓度设3 个重复组,对照组只投喂小球藻、不放蚌。每天早晨6:00 投喂,每次投喂后测出实验水体中小球藻的浓度,投喂后每2 h 后测量一次。连续记录24 h,每天试验后换水重新投饵。
摄食率指单位时间内的平均摄食率(IR),计算公式为:IR=[(On-On+2-△O)V]·(w×t)-1。式中:On为实验开始n h 测量的小球藻浓度,On+2代表实验开始(n+2)h 测量的小球藻浓度,△O 为n h 至(n+2)h之内空白对照组的浓度变化,V 为实验水体体积,w代表擦干后三角帆蚌总的湿重,t 为两次测量间隔的时间(h)。
1.3 统计分析
实验数据以平均值±标准差(Mean±SD)表示,差异显著性采用SPSS 19.0 分析。
2 结果与分析
2.1 三角帆蚌的昼夜耗氧率和排氨率变化
实验期间,实验蚌的存活率为100%。由图1 可知,3 个实验组蚌的平均耗氧率连续3d 的变化情况基本相同,同时间点的耗氧率重复组差异不显著(P>0.05),三角帆蚌耗氧率出现两次波动,最低谷出现在中午12 点,然后逐渐提升,至夜间20 点出现第一次高峰,然后逐步下降,至凌晨0—2 点之间处于第二个低谷期,凌晨4 点出现第二次高峰。3d的最低值依次为(3.44±0.31)μg·(g·h)-1、(2.86±0.29)μg·(g·h)-1和(3.34±0.34)μg·(g·h)-1,夜间20点的耗氧率依次为(5.28±0.18)μg·(g·h)-1、(4.93±0.71)μg·(g·h)-1和(5.19±0.53)μg·(g·h)-1,凌晨4点的耗氧率依次为(5.14±0.28)μg·(g·h)-1、(4.65±0.57)μg·(g·h)-1和(5.14±0.73)μg·(g·h)-1。

图1 一龄三角帆蚌24 h 耗氧率的变化Fig.1 Change in 24 h oxygen consumption rate of oneyear-old freshwater mussel Hyriopsis cumingii
由图2 可知,实验组蚌连续3d 相同时间点的排氨率无显著差异(P>0.05),此外三角帆蚌排氨率同样出现两次波动,最低谷出现在中午12 点,然后逐渐提升,至夜间20 点出现第一次高峰,然后逐步下降,至凌晨0 点至2 点之间处于第二个低谷期,凌晨4 点出现第二次高峰。12 点的排氨率依次为(0.44±0.10)μg·(g·h)-1、(0.41±0.12)μg·(g·h)-1和(0.43±0.04 μg·(g·h)-1,20 点的排氨率依次为(0.68±0.11)μg·(g·h)-1、(0.63±0.09)μg·(g·h)-1和(0.62±0.09)μg·(g·h)-1,凌晨4 点的排氨率依次为(0.66±0.09)μg·(g·h)-1、(0.60±0.07)μg·(g·h)-1和(0.66±0.09)μg·(g·h)-1。

图2 一龄三角帆蚌24 h 排氨率的变化Fig.2 Change in 24 h ammonia excretion rate of one-yearold freshwater mussel Hyriopsis cumingii
2.2 不同饵料浓度下三角帆蚌昼夜摄食率的变化
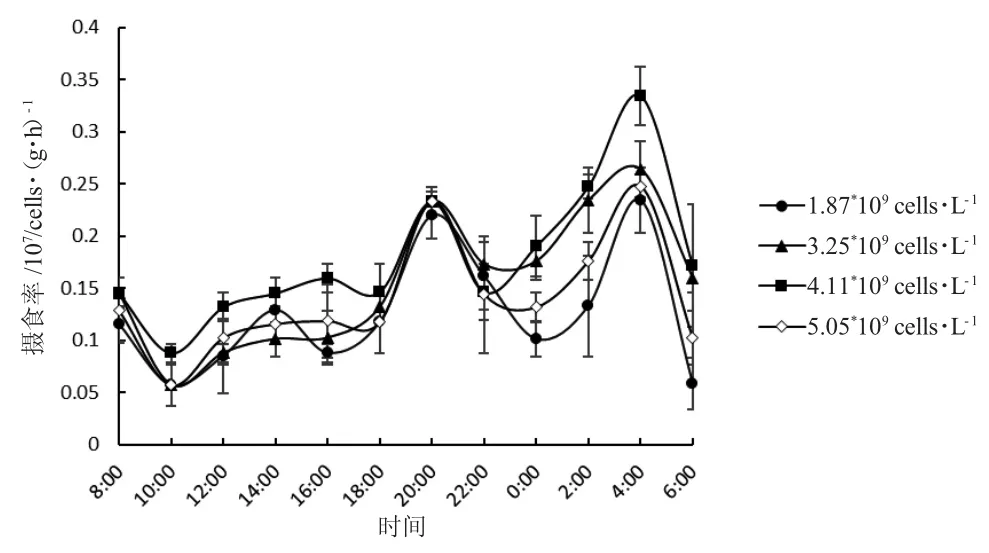
图3 投喂四种浓度小球藻后一龄三角在帆蚌不同时间的摄食率Fig.3 The food intake rate of one-year-old freshwater mussel Hyriopsis cumingii fed four concentrations of green alga Chlorella at different time
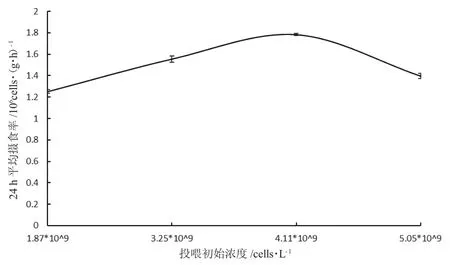
图4 一龄三角帆蚌摄食四种浓度小球藻时24 h 平均摄食率的变化Fig.4 Variation in average 24 h intake rate of one-year-old freshwater mussel Hyriopsis cumingii fed four different concentrations of green alga Chlorella
由图3 可知:小球藻初始浓度为1.87×109cells·L-1和4.11×109cells·L-1时,三角帆蚌摄食率差异显著(P<0.05),其他浓度无显著差异(P>0.05);摄食高峰在夜间20 点和凌晨4 点,低谷在上午10 点。四组浓度下,三角帆蚌24 h 平均摄食率按投喂浓度递增依次为:(1.25±0.01)×106cells·(g·h)-1、(1.56±0.03)×106cells·(g·h)-1、(1.78±0.01)×106cells·(g·h)-1和(1.40±0.02)×106cells·(g·h)-1;初始浓度为4.11×109(cells·L-1)时,24 h 平均摄食率最高(图4)。
3 讨论
3.1 贝类昼夜代谢变化规律
有氧呼吸能反映水生生物的生理代谢强度,研究贝类的耗氧率可为工厂化大规模养殖确定合理密度提供基础数据[13]。影响贝类生理代谢活动的因素有许多,胡梦红等[14]发现不同藻类环境下三角帆蚌的代谢底物不同,其中绿藻环境下呼吸代谢底物主要为蛋白质,处于不受胁迫的良好生长状态,所以投喂单胞藻小球藻较为适宜。本实验中,氧氮比(O∶N)变化在7.03~8.34 之间,低氧氮比表明三角帆蚌处于不受胁迫的正常状态。不同规格和温度下,三角帆蚌的呼吸代谢活动不同,耗氧率随单位体质量的增加而下降;24~28℃时耗氧率最高[15]。温度变化影响许氏帆蚌Hyriopsis schlegerii 代谢的底物,代谢率在一定温度范围内随温度的升高而增加,超出这个范围,贝类的生理活动产生异常,甚至死亡[16]。静水法测量耗氧率时会有溶解氧含量(DO)分层,所以本实验采用虹吸法吸取底层水样进行测量以减小误差。
有报道表明:三角帆蚌夜间生理代谢活动高于白天[17],昼夜时间段的确存在代谢规律。滤水率也能反映贝类的生理活动,闵棱钧等[18]发现在凌晨4:30 和夜间19:30 时三角帆蚌滤水率处于高峰,在白天10:30 时滤水率最低。Mccorkle 等[19]也认为,光照强度影响贝类耗氧代谢,白天随着光照增强,代谢活动减弱;夜间光照减弱,代谢活动增强。与三角帆蚌同属珠蚌科的紫黑翼蚌Potamilus alatus,二者的昼夜呼吸代谢节律也较为接近[20]。
3.2 贝类摄食昼夜节律及其对藻类浓度的摄食反馈
贝类的摄食不仅与其规格、放养密度有关,还和饵料种类、浓度、温度及水流速度等水环境因素密切相关[21]。本摄食率实验研究中,投喂藻类的初始浓度参考了朱爱民等[1]、高建华等[22]的研究。费志良等[23]发现,藻类的密度为106个·mL-1左右时,三角帆蚌对藻类清除效果最佳。合浦珠母贝Pinctada martensii 和大珠母贝Pinctada maxima 稚贝的摄食率都在夜间0:00 时最高,在早上6:00 时最低,这可能与淡水珍珠贝类和海水珍珠贝类的生存环境不同有关[24]。
不同贝类对藻类的摄食选择性与食物颗粒大小及种类密切相关,食物的营养价值和浓度也会影响贝类摄食行为和进入进水管的水流速度,此外贝类的鳃对一些食物也有选择性[25]。饵料的浓度变化显著影响缢蛏Sinonovacula constricta 对球等鞭金藻Isochrysis sphaerica 的摄食[26]。饵料浓度过高时,一部分食物进入消化系统被消化吸收,另一部分没有被消化,最终以“假粪”的形式排出体外,说明贝类摄食存在一定的阈值,即其单位时间内能够消化的饵料量存在上限[27]。本实验中,小球藻浓度在1.9×109cell·L-1、3.25×109cell·L-1和4.11×109cell·L-1时,水底部未发现假粪,表明三角帆蚌代谢正常;当浓度达到5.05×109cells·L-1时水底部开始出现假粪,表明一龄三角帆蚌对小球藻摄食的阈值可能在4.11×109cell·L-1至5.05×109cells·L-1之间。若投饵量过低,贝类捕获饵料颗粒的机会变少,摄食能力受到限制,不能保障正常生长发育需要的能量,而当浓度超出一定值,饵料会以假粪的形式排出体外,既造成饵料浪费,同时也影响贝类正常生长。

