鲤CCAAT 增强子结合蛋白α 基因的克隆与时空表达特征
孙志鹏 ,吕伟华,党红阳,2,曹顶臣,匡友谊,鲁翠云,郑先虎
(1.中国水产科学研究院黑龙江水产研究所,淡水鱼类育种国家地方联合工程实验室,黑龙江 哈尔滨 150070;2.上海海洋大学,农业农村部淡水水产种质资源重点实验室,上海 201306)
CCAAT 增强子结合蛋白 (CCAAT enhancer binding protein,C/EBP) 是碱性区亮氨酸拉链(basic region/leucine zipper,Bzip)蛋白家族的一个转录因子[1]。C/EBP 转录因子包含一个高度保守的DNA 结构域和一个亮氨酸拉链二聚体结构域,形成同源或异源二聚体结合到相似的序列上[2]。其中,C/EBPα 在脂肪细胞、骨髓细胞、肝脏、肺及胎盘等多种细胞或组织中均有表达[3-5],具有调控细胞分化、参与能量代谢、抑制细胞增殖等多种生物学功能[6],脂肪细胞分化过程中控制动物腹腔脂肪沉积的主效基因或与主效基因紧密连锁。Lekstrom 和Xanthopoulos[7]发现:C/EBPα 基因的过表达能加速前脂肪细胞向成熟脂肪细胞分化,在大多数特异性脂肪细胞基因转录之前表达。Yeh 等[8]和Rosen 等[9]揭示,C/EBPα 在脂肪细胞分化的终末阶段大量表达,与过氧化物酶体增殖剂激活受体(peroxisome proliferator activated receptor,PPARγ)共同作用,开启一系列脂肪特异性基因的表达,合成、摄取和储存长链脂肪酸,使细胞停止增殖,呈现完全分化状态。
目前,关于C/EBPα 与脂肪沉积关系的研究主要集中在哺乳动物和畜禽方面。Wang 等[10]研究发现:小鼠C/EBPα 基因表达受到干扰后,腹部脂肪沉积明显下降。Lee 等[11]研究显示,敲除C/EBPα 基因后,小鼠丧失了磷酸烯醇丙酮酸羧激酶(PEPCK)基因功能,影响糖代谢和脂肪生成。耿蓓等[12]研究表明,高脂饮食会抑制小鼠血液中C/EBPα 的表达。张爱朋等[13]比较了C/EBPα 突变肉鸡与未突变个体发现,突变个体腹脂含量及腹脂率显著高于未突变个体。然而,C/EBPα 基因在鱼类中却鲜有报道。本研究通过克隆鲤Cyprinus carpio C/EBPα 基因全长cDNA 序列,并将其编码氨基酸序列与其他物种进行了同源性多重比较及系统进化分析,研究C/EBPα 基因在鲤不同组织中及其在不同胚胎发育时期的表达特征,以期为深入研究C/EBPα 基因在鲤脂肪细胞分化及脂肪发生过程中的作用机制提供参考。
1 材料与方法
1.1 材料
实验鱼5 尾为1 龄鱼,体质量200~250 g,取自中国水产科学研究院黑龙江水产研究所呼兰试验站同一养殖池塘,禁食24 h 后,采集腹腔脂肪(脂肪组织)、脑组织、肝脏、心脏、脾脏、肾脏、腹部肌肉、肠组织和血液等样本,迅速放入液氮中保存备用;依次采集鲤受精卵期、8 细胞期、囊胚晚期、原肠胚晚期、7 体节期、心跳期、体循环期、出膜期、开口期和出苗5 d 等10 个不同发育时期胚胎样本,保存于液氮中备用。
1.2 基因全长cDNA 获得
参照RNeasy Min Elute Clean up Kit(QIAGEN)试剂盒说明提取总RNA,使用Prime ScriptTMRT reagent Kit 试剂盒合成cDNA 第一链。从NCBI 检索并下载斑马鱼等硬骨鱼类C/EBPα 基因的cDNA 序列,选择保守区域与鲤转录组文库进行比对,获得鲤C/EBPα 基因部分cDNA 序列,并设计同源简并引物(表1)。以反转录产物cDNA 为模板,PCR 产物纯化后连接到PMD18-T(TaKaRa)载体,转入DH5α 感受态细胞,选择阳性克隆送至苏州金唯智生物科技有限公司测序,获得C/EBPα 基因核心片段序列。参照SeqAmpTMDNA Polymerase(Clontech)试剂盒说明进行5’/3’端RACE 扩增,以获得非编码区(UTR)序列。测序结果经BLAST(https://www.n cbi.nlm.nih.gov/)比对、DNAMAN 分析和Staden(1.7)拼接,最终获得C/EBPα 基因的全长cDNA 序列[14]。
1.3 基因序列特征及系统进化分析
利用ExPASy(https://www.expasy.org/proteomics)等在线软件分析信号肽、跨膜结构、蛋白二级结构、蛋白疏水性及脂肪系数等蛋白特征。使用MEGA6.0软件,采用邻接法(Neighbor-Joining method,NJ)构建系统进化树,Bootsrap 值取1 000 次,由JTT 距离矩阵模型(JTT matrix-based method)计算进化距离[ 15 ]。
1.4 基因表达特征分析
参照测序后获得的C/EBPα 基因全长cDNA 序列,设计荧光定量引物(表1)。以反转录产物cDNA为模板,以鲤18S 为内参基因,参照One Step SYBRPrime ScriptTMRT-PCR Kit II(TaKaRa)试剂盒使用方法,利用ABI 7500 Real-time PCR 定量仪,测定了鲤不同组织间和不同胚胎发育时期C/EBPα 基因的相对表达量,每个样品设3 个重复。采用2-△△Ct方法计算基因相对表达量。利用SPSS 17.0 单因素方差分析(one-way ANOVA)分析了基因相对表达量的差异显著性,差异显著性水平P<0.05,差异极显著性水平P<0.01[16]。
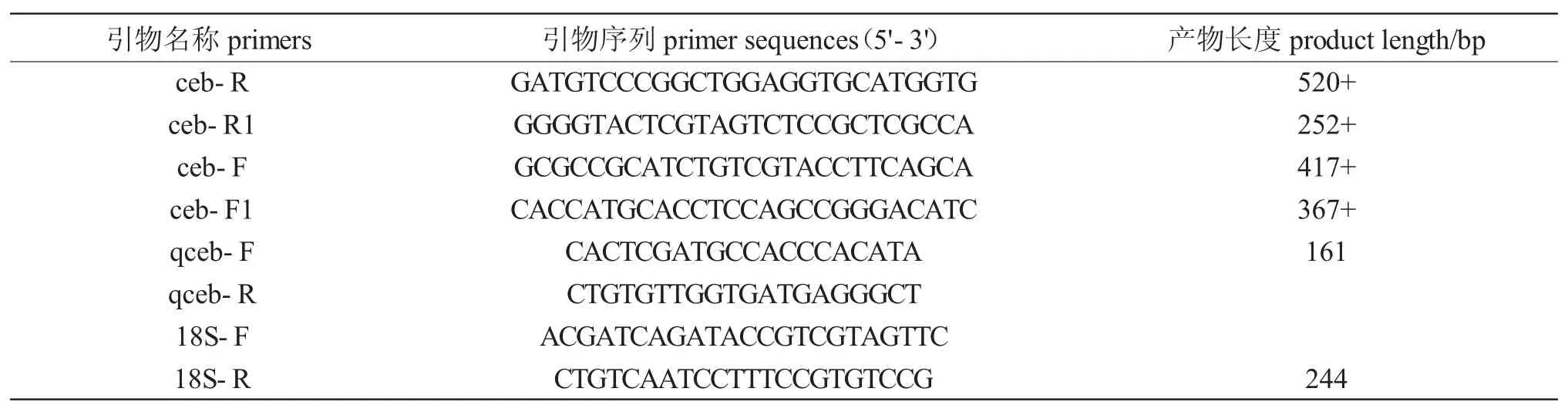
表1 引物序列Tab.1 Primers used in this study
2 结果与分析
2.1 鲤C/EBPα 全长cDNA 序列分析
采用RACE 扩增方法获得C/EBPα 基因的cDNA 全长总长为1 463 bp 的鲤C/EBPα(GenBank 登录号:MN073500)。其中,234 bp 的5’端非编码区(5’-UTR),861 bp 的开放阅读框(编码286 个氨基酸)和368 bp 的3’端非编码区(内含30 bp 的polyA尾巴),polyA 上游176 bp 处存在一个“ACTAAA”加尾信号。
经ExPASy 的ProtParam 工具预测蛋白分子式为C1409H2210N426O438S13,总原子数为4 496 个。蛋白质相对分子量为32.5 kD,理论PI 值7.02;不稳定系数为52.48,蛋白稳定性较低;脂肪系数为63.50,亲水性平均系数为-0.962。氨基酸预测分析表明,脯氨酸含量最高(8.0%),不含色氨酸、苯丙氨酸、丝氨酸;天冬酰胺和谷氨酰胺共带负电荷残基总数36个,精氨酸和赖氨酸带正电荷残基总计35 个。
2.2 氨基酸序列多重比较与进化树构建

图2 基于不同物种C/EBPα 氨基酸序列构建的系统进化树Fig.2 Phylogenetic tree based on C/EBPα amino acid sequences of different species
利用CLUSTAL 2.1 在线分析软件对鲤C/EBPα 氨基酸序列进行比对。结果显示,其与斑马鱼Danio rerio、大西洋鲑Salmo salar、小鼠Mus musculus 氨基酸序列的相似性分别为93.36%、63.64%和52.47%。多重比较结果显示,6 个物种间C/EBPα 氨基酸序列同源性的差异主要集中在C-端的多肽上(图1)。
基于23 个物种C/EBPα 氨基酸序列,采用MEGA 6 软件,用N-J 法构建系统进化树。结果显示,全部鱼类聚为一大支,其中鲤、鲫、斑马鱼等鲤科鱼类聚为一支;虹鳟、大西洋鲑等鲑科类鱼聚为一支;牙鲆Paralichthys olivaceus、半滑舌鳎Cynoglossus semilaevis 等鲆鲽类鱼聚为一支,哺乳动物聚为另一大支(图2)。
2.3 C/EBPα 基因在鲤不同组织表达特征
实时荧光定量PCR 结果显示,C/EBPα 基因在实验组织中均有表达(图3),9 个组织中基因相对表达量由高到低依次为:脂肪、肠、脑、脾、肝、肾、心脏、血液和腹部腹肌。脂肪的相对表达量相对高于其他组织,且差异极显著(P<0.01);脑、脾、肝和肾组织中的表达量相当,无显著差异(P>0.05)。
2.4 C/EBPα 基因鲤不同发育时期表达特征

图3 C/EBPα 基因在鲤不同组织中的相对表达量Fig.3 Relative expression levels of C/EBPα gene in different tissues of common carp C.carpio

图4 鲤不同胚胎发育时期C/EBPα 基因的相对表达Fig.4 Relative expression levels of C/EBPα gene in different embryonic stage of common carp C.carpio
C/EBPα 基因在鲤胚胎不同发育时期表达量变化情况见图4。由图4 可知,受精后至心跳期,随着胚胎的发育,C/EBPα 基因的表达量逐渐上升,心跳期表达量最高,相对其他时期差异极显著(P<0.01)。心跳期后基因表达量显著下降,出膜期后C/EBPα基因表达量有所升高。
3 讨论
自1989 年被发现至今,大量预测研究表明,C/EBPα 蛋白也位于细胞核内,属于b-Zip 家族,具有典型亮氨酸拉链结构[17,18]。不同物种间C/EBPs 转录因子的DNA 结合域和激活域高度同源,尤其是DNA 结构域在进化过程中变异率极低。小鼠C/EBPα 基因编码区长度约1 188 bp,编码395 个氨基酸[11],秦川牛基因编码区长度1 062 bp,编码353 个氨基酸[19],鸡C/EBPα 基因编码区长度约1 300 bp[20],朗德鹅基因编码区长度约975 bp,编码324 个氨基酸[21]。本研究克隆了鲤C/EBPα 基因全长,开放阅读框861 bp,共编码286 个氨基酸,编码氨基酸数较哺乳动物和畜禽类少。鲤C/EBPα 基因编码氨基酸序列与斑马鱼相似度为93.36%,而与人相似度仅为52.47%,可见物种间差异较大。系统进化分析结果显示,哺乳动物聚为一大支,鱼类聚为一大支,鲤科鱼类聚为一小支,说明C/EBPα 基因在进化过程中具有较高的保守性。盘道兴等[22]研究表明,C/EBPα基因在猪皮下脂肪中表达量最高,肝和小肠中表达较高,心和肾中表达量最低,与本研究结果相近,说明在猪和鲤组织中C/EBPα 基因表达量与脂肪细胞的实际分布成正比。
大多数鱼类在饥饿状态下优先动用脂肪作为能量来源[23,24],而且对脂肪的利用能力很高,其用于机体增重和分解供能的总利用率达90%以上[25]。C/EBPα 在脂肪细胞分化、发育过程中起决定作用,众多脂肪细胞特异性表达的基因都含有C/EBPα 的结合位点,可激活大部分脂肪细胞特异性表达基因,如磷酸烯醇丙酮酸羧基酶(PEPCK)基因、葡萄糖转运体(GLUT)-4 基因及瘦素(leptin)等的调控区域,从而启动相关基因的转录表达,同时促进细胞中脂肪的积累[26,27]。脂肪沉积主要通过脂肪细胞数量增多和体积增大来实现。韦璇等[28]发现,C/EBPα 基因表达上调会促进脂肪细胞体积增大,导致阿勒泰羊尾部脂肪沉积。然而对鱼类脂肪性状的研究,应系统探究脂肪沉积、脂肪分解、脂肪酸的形成等,单纯孤立研究某一个或两个基因远远不够,需要更多地发掘鱼类的脂质产生与代谢相关基因表达的差异,从整体上把握这些基因控制鱼类脂肪性状的相关性,清楚地了解鱼类脂肪性状的控制机制。

