三氯生对雄斑马鱼鳃抗氧化相关基因表达的影响
郭向萌,郑芳芳,王凡
(洛阳师范学院生命科学学院,河南 洛阳 471022)
三氯生(Triclosan,TCS)是广泛应用于化妆品、纺织品、家用清洁剂和消毒剂等中的抗菌剂,大量使用不可避免地释放到水环境中,在城市排水系统、污水处理系统、污泥、河流等水体中均可检测到[1-3]。调查发现,虽然TCS 在水环境中分布浓度较低,毒性作用也不明显,但在一定条件下其可以转化为毒性更强物质,因此,TCS 的环境行为和毒理学研究受到越来越多的关注[4]。已有研究表明,TCS具有生物蓄积性、通过食物链传递性和较强的稳定性。TCS 对斑马鱼Danio rerio 和红白鲫Carassius auratus 血红细胞微核率和核异常率的显著影响,表明其对硬骨鲤科鱼类具有潜在的遗传毒性[5,6];长期的TCS 暴露显著改变了黄河鲤Cyprinus carpio 性激素和卵黄蛋白原、斑马鱼甲状腺激素的产生,表明TCS 对鱼类具有内分泌干扰效应[7-9]。TCS 能够不同程度地诱导或抑制剑尾鱼Xiphophorus helleri 肝脏相关代谢酶及其mRNA 的表达,表明TCS 对鱼类的代谢也产生一定程度的影响[10]。迄今为止,TCS对硬骨鱼类抗氧化影响的分子机制研究较少。
斑马鱼是一种与人类基因高度同源,易饲养、繁殖快、生命周期短、对污染物的作用敏感的模式生物,可应用于水质监测、毒理学、药理学等科学研究中[11]。鳃是鱼类直接与水环境接触的主要呼吸器官,可以更加直接反应出污染物对鱼类的毒性作用[12]。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GPx)是生物体内主要的抗氧化酶类。金属硫蛋白-2(MT-2)和s 金属硫蛋白-B(sMT-B)清除自由基的能力远远超过抗氧化酶类。因此,本研究通过探究TCS 对斑马鱼鳃组织SOD、CAT、GPx、MT-2 和sMT-B 基因表达的影响,有助于揭示TCS 对斑马鱼鳃组织影响的分子机制,可为水生生物保护和维护水生态平衡提供科学依据,为TCS 对动物及人类的潜在危害提供有价值的参考。
1 材料与方法
1.1 材料
试验用斑马鱼购自上海诚信渔场,体长为1.5~2.1 cm,选用健康、行为敏捷、规格均匀的个体暂养于60 L 的水族箱中,水量20 L,温度为(22±3)℃,pH 为(6.9±0.2),连续不间断充氧。每天投喂两次,用曝气72 h 的自来水及时换水,并清理缸内斑马鱼残饵及粪便,暂养7 d 后开始正式实验。
试验用试剂有:三氯生(美国Sigma 公司)、总RNA 极速提取试剂盒(上海飞捷生物技术有限公司)、RNA 反转录试剂盒(东洋纺生物科技有限公司)、2×Taq MasterMix(北京康为世纪生物科技有限公司)、GoldView Ⅰ型核酸染色剂、Bestar SybrGreen qPCR mastermix(德国DBI 公司)、二甲基亚砜溶剂(天津紫明化工有限公司)、基因引物(华大基因公司)、琼脂糖、Loading buffer 染料等。
1.2 方法
资料表明,TCS 对斑马鱼96 h 半致死浓度(LC50)为340 μg·L-1[13]。以此为依据,设置对照和3个TCS 浓度处理组:0 μg·L-1、17.0 μg·L-1、34.0 μg·L-1和68.0 μg·L-1。随机取暂养后的斑马鱼幼鱼100尾,置于各浓度组水族箱中,每组2 个平行。每个水族箱用水量20 L,以半静态水体暴露法对斑马鱼进行连续处理42 d。整个试验期间其他条件同暂养。
TCS 处理42 d 后,解剖行动敏捷、生长状况良好且体表完好的斑马鱼。每个浓度斑马鱼均分为五组,每组取出5 尾斑马鱼鳃,混合样为一个样本,取样后迅速保存在超低温冰箱中备用。
1.3 凋亡相关基因表达的检测
1.3.1 引物序列
β-actin(内参)、SOD、GPx1a、CAT、sMT-B 和MT-2 基因的引物序列(表1)来自于相关报道[12,14]。
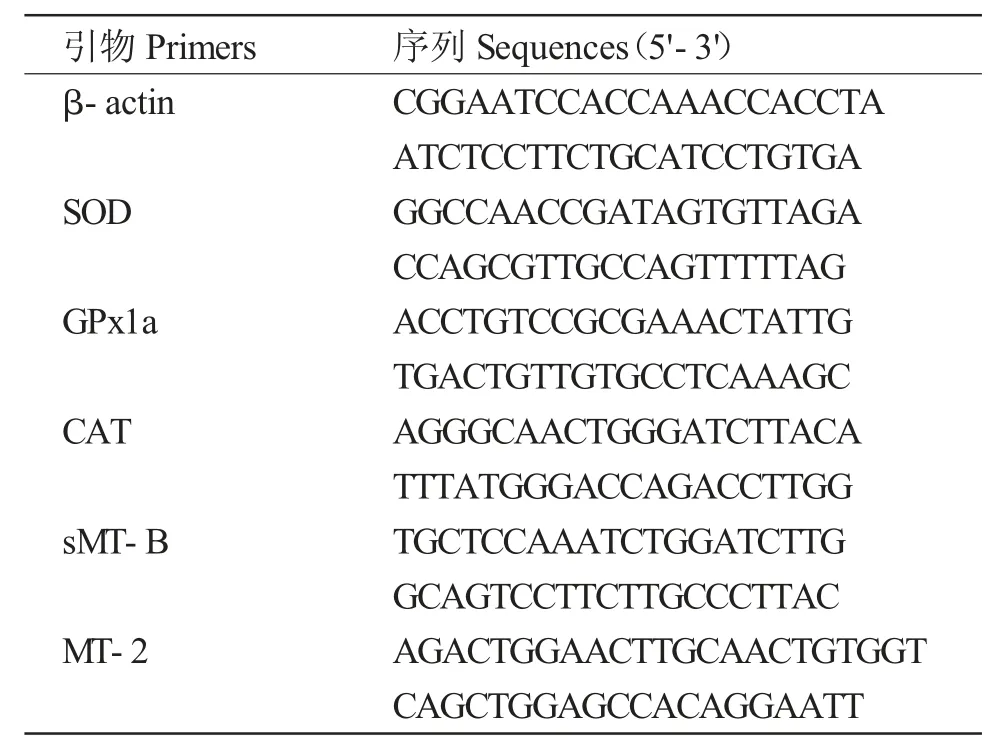
表1 实时荧光定量PCR 所用基因的特异性引物及其序列Tab.1 Primers and their sequences used for real-time PCR
1.3.2 RNA 的提取与反转录
按照总RNA 极速抽提试剂盒提供的方法,提取每个雄斑马鱼的鳃组织混合样本。对提取出的RNA 用凝胶电泳分析其质量,用超微量分光光度计检测其纯度和浓度。对质量好、纯度高且浓度适宜的RNA 样本进行反转录反应。
1.3.3 普通PCR
将反转录得到的cDNA、目的基因或内参基因的上下游引物、2×Taq Master Mix 及无菌水制备25 μL 的普通PCR 反应体系。然后,将反应体系充分混匀,根据普通PCR 步骤进行扩增反应。琼脂糖凝胶电泳检测PCR 扩增情况。
1.3.4 实时荧光定量PCR
为了验证目的基因(SOD、GPx1a、CAT、sMT-B和MT-2)的扩增效率与内参基因(β-actin)的扩增效率是否满足实时荧光PCR 相对定量2-ΔΔct法的要求,将上述目的基因引物与内参基因引物同时做标准曲线分析。结果发现:目的基因和内参基因的扩增效率都接近100%,可以用实时荧光定量中的2-ΔΔct法进行目的基因的相对表达量分析。
将反转录获得的样本的cDNA、目的基因和内参基因的上下游引物、Bestar SybrGreen qPCR mastermix 及无菌水制备20 μL 的实时荧光定量PCR反应体系,充分混匀后,放入实时荧光定量PCR 仪中进行扩增。
1.4 数据分析
分析实时荧光定量PCR 反应后的Cq 值,利用2-ΔΔct法计算目的基因的相对mRNA 表达量,然后应用SPSS13.0 软件对目的基因的相对mRNA 表达量进行单因素方差分析。数据用X±SD(平均值±标准差)表示,采用LSD 法分析各浓度组和对照组之间的差异,P<0.05 表示差异显著;P<0.01 表示差异极显著。
2 结果与分析
2.1 目的基因和内参基因的普通PCR 反应
首先分析每个TCS 浓度组SOD、GPx1a、CAT、sMT-B 和MT-2 基因与内参基因灰度值之比。34.0 μg·L-1和68.0 μg·L-1TCS 浓度组斑马鱼的SOD 基因与内参基因的灰度比明显下降,表明其表达下调(图1)。其他目的基因主要表现为:17.0 μg·L-1浓度组GPx1a 基因的表达水平无明显变化,34.0 μg·L-1和68.0 μg·L-1组表达水平下调;17.0 μg·L-1浓度组CAT 基因的表达水平无明显变化,34.0 μg·L-1和68.0 μg·L-1浓度组表达水平下调;17.0 μg·L-1浓度组sMT-B 基因的表达水平无明显变化,34.0 μg·L-1和68.0 μg·L-1浓度组表达水平下调;17.0 μg·L-1浓度组MT-2 基因的表达水平无明显变化,34.0 μg·L-1和68.0 μg·L-1浓度组表达水平下调(图1)。
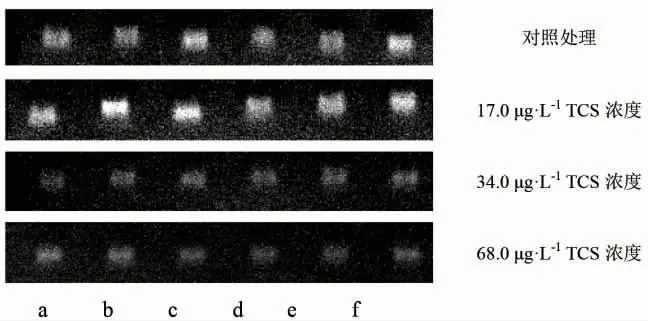
图1 不同TCS 浓度组斑马鱼鳃基因表达情况Fig.1 Gene expression in gill of zebrafish(Danio rerio)exposed to various concentrations of TCS
2.2 TCS 对雄斑马鱼鳃抗氧化酶相关基因表达定量分析
为了验证TCS 对斑马鱼鳃的各种抗氧化酶相关基因的表达量的影响,采用RT-qPCR 法检测并分析处理组的表达与对照之间的差异性。如图2 所示,SOD、GPx1a 和CAT 基因表达均有下调趋势。与对照组相比,SOD 基因在34.0 μg·L-1和68.0 μg·L-1浓度组极显著下调,下调值分别为50.6%和77.7%。GPx1a 基因在68.0 μg·L-1浓度组显著下调,下调了58.4%。CAT 基因在34.0 μg·L-1和68.0 μg·L-1浓度组极显著下调(94.1%和90.2%)。
2.3 TCS 对雄性斑马鱼鳃金属硫蛋白相关基因表达定量分析
金属硫蛋白相关基因的实时定量分析结果如图3 所示。由图3 可知:34.0 μg·L-1和68.0 μg·L-1浓度组斑马鱼的sMT-B 基因表达量极显著下调,依次下调65.4%和65.4%。MT-2 基因表达量随着TCS浓度的增加有不同程度的下调,依次下调了95.1%、78.5%和56.7%。

图2 不同TCS 浓度组斑马鱼鳃抗氧化酶相关基因mRNA 的表达Fig.2 mRNA expression of genes related to antioxidant enzyme in gill of male zebrafish(Danio rerio)exposed to various concentrations of TCS

图3 不同TCS 浓度组斑马鱼鳃金属硫蛋白基因mRNA 的表达Fig.3 mRNA expression of metallothionein gene in gill of male zebrafish(Danio rerio)exposed to various concentrations of TCS
3 讨论
生物体抗氧化系统与生物的免疫水平密切相关,因此,抗氧化类物质(抗氧化酶类和金属硫蛋白类)可作为生物体的非特异性免疫指标[15]。SOD、CAT 和GPx 是生物体内主要的抗氧化酶类,在应对外界物理因素和化学因素刺激和清除生物体内自由基中发挥重要作用。MT-2 和sMT-B 是生物体内普遍存在的两种典型代表性的金属硫蛋白,清除自由基的能力远超过抗氧化酶类。因此本实验研究了TCS 对斑马鱼鳃SOD、GPx1a、CAT、sMT-B 和MT-2基因mRNA 表达的影响。
SOD 基因表达产物为超氧化物歧化酶,能催化超氧化物阴离子自由基,且歧化为过氧化氢(H2O2)与O2,保护细胞免受氧自由基氧化损伤[16]。CAT 是过氧化体中存在的氧化酶,主要将H2O2分解为H2O和O2,即将H2O2及其他过氧化物转变为无毒性产物[17]。GPx 基因表达产物为谷胱甘肽过氧化物酶,通过还原性谷胱甘肽催化还原过氧化物和有机H2O2,保护细胞和其他如DNA、蛋白质及脂质体等敏感生物分子免受氧自由基损伤[18]。GPx1a 是GPx 家族成员之一,能清除过氧化氢和脂肪酸过氧化氢[19]。本研究发现,暴露在34.0 μg·L-1和68.0 μg·L-1浓度的TCS溶液42 d 后,斑马鱼鳃组织SOD 基因和CAT 基因的表达显著下调,表明该浓度TCS 刺激了斑马鱼鳃组织,使超氧化物阴离子自由基增多,而此时SOD要迅速清除过多的超氧阴离子自由基,SOD 基因表达下调,在清除过多的超氧阴离子自由基的同时会导致H2O2和其他的过氧化物迅速增多,CAT 要催化过剩的H2O2和过氧化物也会致使CAT 基因表达量降低。本研究也发现,34.0 μg·L-1和68.0 μg·L-1浓度组GPx1a 的表达量在下调,且在68.0 μg·L-1浓度组显著下调,进一步证实了H2O2和其他的过氧化物在鳃组织中过剩,致使鳃组织氧化系统和抗氧化系统失衡,造成对鳃组织的氧化性损伤。已有研究报道,HgCl2能使斑马鱼SOD 基因表达下调[20],全氟辛烷磺酸类物质可使剑尾鱼SOD 基因表达下调[21];铬使草鱼Ctenopharyngodon idellus 鳃内GPx 活性先增高后降低,且长时间暴露会导致GPx 基因表达降低[22];悬浮物使褐牙鲆Paralichthys olivaceus 幼鱼CAT 基因表达显著下调[23];底泥浸出液使脊尾白虾Exopalaemon carinicauda CAT 酶活力及基因表达下调[24]。这些研究结果和本研究结果一致。
MT-2 基因表达产物为金属硫蛋白-2,其为富含半胱氨酸的短肽,能与机体氧自由基反应,清除游离活性氧,来保护细胞防止氧化性损伤[25]。因此,当体内金属硫蛋白表达量降低,清除体内氧自由基的效率降低,造成细胞的氧化损伤。本研究发现,在TCS 各处理组中MT-2 基因表达极显著下调,表明MT-2 比抗氧化酶更为敏感,也证实了中浓度组和高浓度组的TCS 已经使斑马鱼鳃各类氧自由基过剩,造成鳃内的氧化体系与抗氧化体系失衡,斑马鱼鳃产生了氧化性损伤。但尤日福等[26]和王磊等[27]的研究表明,镉使河蚌Anodonta woodiana 和泥鳅Misgurnus anguillicaudatus 金属硫蛋白基因表达显著升高,其原因可能是他们的研究中使用的污染物浓度过小或者暴露时间过短,而本实验中斑马鱼暴露时长达42 d,长时间胁迫已经致使鱼体内氧化系统和抗氧化系统失衡。sMT-B 也能清除生物体内氧自由基,减轻氧化性损伤,同时与脑神经的一些生理功能也有一定关系[14]。本次研究发现,TCS 浓度为34.0 μg·L-1和68.0 μg·L-1时,sMT-B 基因的表达极显著降低,进一步证实上述结果的可靠性。
综上所述,TCS 对雄性斑马鱼鳃组织的抗氧化基因表达造成一定影响,引起SOD、GPx1a、CAT、sMT-B 和MT-2 等基因表达量降低,体内的氧自由基不能被有效清除,产生氧化性损伤,这将有助于揭示TCS 对斑马鱼影响的分子机制。

