抗抑郁药物治疗前后抑郁症患者血清胶质纤维酸性蛋白的变化*
郭彦祥 杜向农 翟媛媛 李定杰 敖 磊 行养玲 朱俊艳 王 磊
抑郁症是一种精神科常见的致残性疾病,世界范围内的发病率不断提高。有研究显示,在美国抑郁症的终生患病率达到16%[1]。同样是在美国,其他研究显示近四分之一的女性和六分之一的男性在其一生中经历过抑郁症,其中多达65%的比例存在反复发作[2,3]。更为麻烦的是,许多抑郁症患者从未接受过诊断或治疗,只有30%~35%的成年人通过目前的治疗方法获得了缓解,增加了超过三分之二的疾病负担[4]。关于抑郁症发病机制的研究一直是精神科领域的热点。
抑郁症的发生涉及心理、人格、社会、文化、家庭、生理、生化、基因遗传等一系列原因。近二十年来的研究证据显示,星形胶质细胞(Ast)不仅参与大脑代谢、突触间神经递质传递和神经元之间沟通[5],也参与了许多神经精神疾病如抑郁症的病理过程[6];而胶质纤维酸性蛋白(Glial Fibrillary Acidic Protein,GFAP)作为中枢神经系统Ast所独有的细胞骨架蛋白,也是其活化的特征性标志物,Ast损伤后可以导致GFAP表达增加,并反映了中枢神经系统损伤的程度,也与抑郁症等精神疾病的发病有关[7]。本研究通过探讨抗抑郁药物治疗前后GFAP变化来明确其相互关系,为阐明抑郁症的发病机理及其相关因素提供新的视角。
1 对象与方法
1.1 对象 研究组为2018年3月~2019年4月西安市精神卫生中心门诊或住院患者。入组标准:(1)符合美国精神障碍诊断与统计手册第4版(DSM-IV)抑郁症诊断标准;(2)发病2周内从未接受过任何抗抑郁治疗;(3)北方汉族,年龄16~55岁,性别不限,受教育年限≥6年;(4)汉密尔顿抑郁量表-24项(HAMD-24)评分≥20分。对照组入组标准:(1)西安市精神卫生中心体检健康志愿者;(2)年龄16~55岁;(3)既往无精神病史,均为北方汉族。两组排除标准:(1)有脑器质性疾病或头部外伤史或意识丧失超过1 h,明显智力低下,有癫痫发作史;(2)患者有其他严重的或尚未控制的躯体疾病;(3)酒精和药物滥用;(4)筛选前1个月内参加过其他药物临床研究;(5)有抗抑郁药物的禁忌证;(6)筛选基线实验室检查结果异常(除肝肾功能外,实验室检查结果大于正常值1.5倍);(7)妊娠或哺乳期妇女;(8)有听力问题(正常交谈情况下不能听清或理解检查者的言语);(9)红、绿、蓝或黄色盲或色弱。研究组共入组66例,最终完成45例,其中男18例,女27例;年龄(36.29±11.49)岁;文化程度小学6例,初中11例,高中/中专8例,大学及以上20例。对照组共入组43名志愿者,其中男15名,女28名;年龄(33.09±9.27)岁;文化程度小学2名,初中13名,高中/中专12名,大学及以上16名。两组在性别、年龄、受教育程度等一般资料方面比较差异无统计学意义(P>0.05)。研究组随机分为度洛西汀组(22例)和艾司西酞普兰组(23例)。其中度洛西汀组男8例,女14例;年龄(38.32±13.19)岁;病程(4.67±5.11)年;文化程度小学5例,初中4例,高中/中专3例,大学及以上10例。艾司西酞普兰组男13例,女10例;年龄(34.35±9.49)岁;病程(2.75±4.03)年;文化程度小学1例,初中7例,高中/中专5例,大学及以上10例。两组在性别、年龄、病程、受教育程度等一般资料方面比较差异无统计学意义(P>0.05)。入组被试均征得患者或法定监护人或直系亲属的知情同意,并签署知情同意书。
1.2 方法
1.2.1 治疗方法 研究组随机分为度洛西汀组(全部使用度洛西汀治疗,剂量60 mg/d)和艾司西酞普兰组(全部使用艾司西酞普兰治疗,剂量20 mg/d),治疗期间可辅助使用劳拉西泮(最大剂量2 mg/d)、阿普唑仑(最大剂量0.8 mg/d)改善睡眠及焦虑,使用周期不超过2周。
1.2.2 血清GFAP检测 研究组于入组时和治疗后第2、4周末,早晨6:00空腹采肘静脉血5 ml置于非抗凝真空采血管中,离心后抽取血清于-20℃低温保存,待所有标本采集完成后统一采用酶联免疫吸附(ELISA)方法测定血清GFAP浓度。对照组采用相同方法,仅在入组时采血1次。
1.2.3 量表评定 采血后24 h内完成相关量表的评定,包括:HAMD-24以及汉密尔顿焦虑量表(HAMA)。HAMD-24:包括焦虑/躯体化、体重、认识障碍、日夜变化、阻滞、睡眠障碍、绝望感等7项因子;HAMA:包括躯体化焦虑、精神性焦虑。

2 结果
2.1 研究组与对照组血清GFAP浓度比较 入组时,研究组与对照组血清GFAP浓度分别为(1 962.95±2 303.07)ng/L和(930.38±265.14)ng/L,研究组高于对照组(U=493.00,Z=-3.961,P<0.01)。
2.2 研究组治疗前后量表评分和血清GFAP浓度变化 治疗后,研究组HAMD、HAMA评分以及血清GFAP浓度均呈下降趋势(P<0.01)。进一步两两比较发现,治疗后第2、4周末,HAMD、HAMA评分以及血清GFAP浓度均较入组时降低(P<0.01);且治疗后第4周末,HAMD、HAMA评分以及血清GFAP浓度均较治疗后第2周末降低(P<0.01)。见表1。
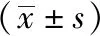
表1 研究组治疗前后量表评分和血清GFAP浓度变化
2.3 不同抗抑郁药物对HAMD、HAMA评分及血清GFAP浓度影响的比较 治疗后第2、4周末,度洛西汀组和艾司西酞普兰组HAMD、HAMA评分以及血清GFAP浓度均较入组时降低(P<0.01),且治疗后第4周末,两组HAMD、HAMA评分以及血清GFAP浓度均较治疗后第2周末降低(P<0.01)。见表2。
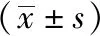
表2 不同抗抑郁药物对HAMD、HAMA评分及血清GFAP浓度影响的比较
2.4 研究组治疗前后一般资料及HAMD、HAMA评分与血清GFAP浓度的关系 研究组在入组时,血清GFAP浓度与HAMD评分呈正相关(P<0.05)。其他各时点,其余各项与血清GFAP浓度均无相关性(P>0.05)。见表3。

表3 研究组治疗前后一般资料及HAMD、HAMA评分与血清GFAP浓度的关系
3 讨论
研究组入组时血清GFAP浓度高于对照组(P<0.01),此结论和此前的研究结果一致。郭彦祥等[7]、李涛等[8]的研究均提示抑郁症患者血清GFAP浓度高于健康对照组。动物实验显示,急性全身热刺激(38℃,4 h)和跑轮运动(running-wheel)可以增加多个脑区的GFAP的免疫活性,海马区反应性Ast的活化尤其明显[9]。但是动物实验的结果并不一致,比如慢性社会打击(心理应激的一种)降低了雄性树鼩相应脑区的GFAP免疫活性[10]。抑郁症患者的尸检结果也是相反的,在年轻抑郁症患者的前额叶和前扣带回,GFAP的免疫活性下降[11,12]。目前尚不能很好地解释上述研究结果的差异,可能是试验入组的对象不同所致,也和动物、人类实验的不同有关,最有可能是外周血清GFAP浓度和相应脑区的GFAP的免疫活性并不能简单类比,或者正因为中枢胶质细胞功能的障碍表现为GFAP的免疫活性下降,导致了外周血清GFAP浓度的升高。

本研究共使用了两种抗抑郁药物:度洛西汀和艾司西酞普兰,将入组患者随机分为度洛西汀组和艾司西酞普兰组,试图找到两者对血清GFAP浓度的影响是否存在不同。度洛西汀和艾司西酞普兰具有不同的药理作用,度洛西汀对5-羟色胺(5-HT)和去甲肾上腺素(NA)再摄取具有很强的抑制作用,能使大脑和脊髓中的5-HT和NA浓度升高,可改善抑郁障碍患者的病情,并提高5-HT和NA两种神经递质在调控情感和对疼痛敏感程度方面的作用,提高机体对疼痛的耐受[16]。艾司西酞普兰(S-西酞普兰)是西酞普兰的对映异构体,是对5-HT转运体(SERT)选择性最强的抗抑郁药[17]。两组患者入组时HAMD、HAMA评分差异没有统计学意义,经过治疗后两组HAMD、HAMA评分均较入组时改善,但两组之间比较差异不存在统计学意义(P>0.05),且两组治疗后血清GFAP浓度的对比差异也不具有统计学意义(P>0.05),说明两类药物对胶质细胞和血清GFAP浓度具有相同或类似影响,他们对抑郁症状的影响除了前面所述的途径还存在通过影响胶质细胞来改善症状的可能。本研究进一步提高了胶质细胞在抑郁症发病及治疗方面的价值。
研究组在治疗前,血清GFAP浓度与HAMD评分呈正相关(P<0.05),治疗后,血清GFAP浓度与HAMD、HAMA评分之间没有相关性(P>0.05),说明患者抑郁障碍的严重程度难以通过血清GFAP浓度来准确预测分析。研究组性别、年龄、病程、使用抗抑郁药物与血清GFAP浓度均不存在相关性(P>0.05)。郭彦祥等[7]之前的研究提示,抑郁症患者血清GFAP浓度与HAMD、HAMA总分及HAMD各因子分之间均无相关性(P>0.05),血清GFAP浓度与病程之间无相关性(P>0.05),与本次研究结果是一致的。
本研究进一步阐明了抑郁症和血清GFAP浓度的关系,初步揭示了抗抑郁药物治疗后血清GFAP浓度的变化,为丰富抑郁症发病机制的研究更新了材料。同时,由于样本量较小,入组患者可能缺乏代表性,和既往的动物、尸检研究结果还有不一致的地方,其解释还需要进一步的研究验证。

