木薯渣基质化发酵微生物分离及复合菌配制
王 战,冷雨茜,郭世荣,孙 锦,夏彭飞,束 胜
木薯渣基质化发酵微生物分离及复合菌配制
王战1,冷雨茜1,郭世荣1,孙锦1,夏彭飞2,束胜1※
(1. 南京农业大学园艺学院,南京 210095;2. 南京新创蔬菜分子育种研究院有限公司,南京 211800)
为缩短木薯渣发酵周期,提升木薯渣基质产品质量,该研究以木薯渣为试验材料,对其自然发酵的4个关键时期微生物进行分离、鉴定,并探讨复合微生物菌对木薯渣的发酵效果。结果表明,从木薯渣发酵初始期、升温期、高温期和腐熟期,分别分离出30株、54株、25株和32株菌株。将分离出的菌株接种到刚果红培养基上,筛选出具有降解木质纤维素功能的菌株54株。采用16S rDNA与内转录间隔区ITS测序比对的方法,鉴定出与木薯渣发酵密切相关的微生物37株,其中细菌类主要以高地芽孢杆菌和地衣芽孢杆菌发酵效果最佳,放线菌类、真菌类分别以灰略红链霉菌、绿色木霉菌的效果较好。将上述菌株按比例复配形成微生物菌,发现3种微生物混合后的发酵效果最好,可使木薯渣纤维素质量分数降低到24.4%,且失重率显著高于商业菌剂。这些结果说明微生物之间通过相互协同作用,进一步促进木薯渣的发酵进程,其中以高地芽孢杆菌、地衣芽孢杆菌、灰略红链霉菌、绿色木霉菌复合发酵效果最好。
发酵;微生物;木薯渣基质;鉴定;复合菌
0 引 言
木薯渣是木薯工业的副产物,含有大量的木质纤维素,自然条件下降解较慢。如不能进行及时处理,会严重污染生态环境,成为木薯加工副产物亟需要解决的问题之一。目前,木薯渣的主要用于生产动物饲料、园艺栽培基质、工业原料等方面。虽然木薯渣的处理有很多方法,但这些途径都存在一定的弊端,如木薯渣制成家禽饲料营养成分难以稳定,而能源化利用时,生产成本又较高等问题,导致生产上还存在大量的木薯渣得不到有效利用。
木质纤维素是影响有机废弃物发酵进程的关键因素。近年来,醋糟、枸杞枝条等有机废弃物基质化的发酵微生物研究主要集中在纤维素高效降解菌方面[1]。目前,许多具有木质纤维素降解能力的真菌、放线菌和细菌被国内外学者陆续分离筛选出来,并进行堆体发酵试验。真菌类主要有木霉属、青霉属、根霉属和毛壳菌属等,放线菌主要有链霉菌属、诺卡氏菌属和纤维放线菌等,细菌类主要是芽孢杆菌属、纤维素单胞菌属和类芽孢杆菌属等,这些微生物通过分泌大量游离的胞外纤维素酶来实现纤维素的有效水解;同时,形成的纤维素酶和其他非酶因子之间协同作用,将纤维素分子降解成可溶性的葡萄糖、纤维二糖或纤维寡糖等物质[2-6]。
复合微生物菌剂是目前加快工农业有机废弃物发酵腐熟最便捷、无害、稳定的一种生物转化技术,其应用前景非常广阔[7]。接种外源微生物复合菌剂可以快速提高堆体温度、调节微生物群落结构、降低氮素损失,提高发酵效率与发酵质量,促进腐熟[8-9]。这是由于微生物多样性的提高可以保证整个复合微生物群落结构的安全性与稳定性。研究表明,多种微生物复合菌剂可以加快猪粪发酵效率,提高发酵温度,缩短发酵周期[10]。接种腐秆菌剂改善了稻草育秧基质的理化性状,可降低基质有机质含量,提高速效养分浓度及减小碳氮比,进而促进秧苗生长[11]。微生物之间也是有关联的,有的之间表现为协同共生作用,有的表现为拮抗作用,在实际堆体发酵系统中,不同的微生物之间协同作用会有差异[12]。
木薯渣富含植物生长的大量元素和木质纤维素,是制备育苗和栽培基质的理想原料之一。而目前有关木薯渣基质化利用的发酵微生物菌剂研究较少。为此,本研究以自然发酵的木薯渣为原材料,筛选木薯渣发酵过程起关键作用的微生物,并将筛选出的单一菌株进行复配,进一步研究复合菌对木薯渣基质发酵进程及效果的影响,以期研发出木薯渣基质发酵的微生物菌剂,为有机固体废弃物基质化利用奠定基础。
1 材料与方法
1.1 试验材料
试验用的新鲜木薯渣来自江苏省兴化市新土源基质肥料有限公司。新鲜木薯渣含水率为65%,pH值6.1,EC值为5.63 mS/cm;总碳、总氮、全磷和全钾含量分别为199.9、29.95、10.2和6.5 g/kg;纤维素、半纤维素和木质素分别占木薯渣质量分数的39%、20%和18%。
牛肉膏蛋白胨固体培养基:5 g/L牛肉膏,10 g/L蛋白胨,5 g/L NaCl,1 000 mL蒸馏水,18 g/L琼脂粉,pH值7.4~7.6。改良高氏一号固体培养基:KNO31 g/L,20 g/L可溶性淀粉,0.5 g/L K2HPO4,0.5 g/L MgSO4·7H2O,0.5 g/L NaCl,0.01 g/L FeSO4,18 g/L琼脂粉,1 000 mL蒸馏水,pH值7.4~7.6,每1 000 mL培养基中加入3%重铬酸钾3.3 mL。马丁氏培养基:5 g/L蛋白胨,10 g/L葡萄糖,1 g/L K2HPO4,0.5 g/L MgSO4·7H2O,0.1 g/L链霉素,0.033 g/L孟加拉红,18 g/L琼脂粉,1 000 mL蒸馏水。高氏一号固体培养基:1 g/L KNO3,20 g/L可溶性淀粉,0.5 g/L K2HPO4,0.5 g/L MgSO4·7H2O,0.5 g/L NaCl,0.01 g/L FeSO4,18 g/L琼脂粉,1 000 mL蒸馏水,pH 值7.4~7.6。马铃薯葡萄糖琼脂培养基:200 g/L马铃薯,20 g/L葡萄糖,18 g/L琼脂粉,1 000 mL蒸馏水,自然pH值。刚果红培养基:2 g/L羧甲基纤维素,2 g/L (NH4)2SO4,0.5 g/L MgSO4·7H2O,1 g/L K2HPO4,0.5 g/L NaCl,18 g/L琼脂粉,1 000 mL蒸馏水,pH值7.0。
以上培养基在灭菌锅中121 ℃灭菌20 min。
1.2 测定方法
1.2.1 微生物分离与纯化
木薯渣堆体温度分别在10:00和16:00时测量,把温度计插到堆体的前、后、左、右和中心5个位置30 cm处测量,取5个点的均值作为堆体发酵温度。
根据木薯渣发酵进程,分为4个关键阶段,当堆体温度达到27 ℃时为初始期,温度达到35~45 ℃时为升温期;高温期为堆体温度达到55~60 ℃时,腐熟期为堆体温度降至27 ℃时。每个时期取样时,取样点与堆体温度测量处相同,均采用5点取样法,在堆体深30 cm处取样,之后储存在4 ℃冰箱中备用。
分离方法:细菌分离用牛肉膏蛋白胨固体培养基,放线菌用改良高氏一号培养基,真菌分离用马丁氏培养基,3类微生物都运用平板涂布法:1)分批制备样品的菌悬液:称取木薯渣样品10 g,放入含有90 mL无菌水的锥形瓶中,放入摇床震荡(温度设置与取样温度一致,200 r/min,持续40 min),然后用无菌纱布过滤,吸取1 mL滤液进行梯度稀释(菌液稀释度为10-1),加入盛有9 mL无菌水充分混匀,此时菌液稀释度为10-2,以此类推制成10-2~10-4几种稀释度的悬浮菌液。2)涂布:在超净工作台中,将培养皿标号,选取10-2、10-3、10-4浓度梯度,每个浓度设置3个重复,然后每个皿放入0.1 mL相应稀释度的菌悬液,然后用无菌涂布棒将菌液涂开,室温下静置8 min。3)培养:在生化培养箱中倒置培养,温度设置与样品取样时标记的温度一致,细菌培养2~3 d,放线菌与真菌培养6~7 d。
纯化方法:采用划线方法纯化,先用接种针挑取生长在涂布平板上清晰完整,且形态颜色特征不同的单菌落,然后涂在新的培养基平板上,用画Z字形的方法纯化。在纯化时细菌用牛肉膏蛋白胨固体培养基,放线菌用高氏一号固体培养基,真菌采用马铃薯葡萄糖固体培养基。细菌在生化培养箱中倒置培养2~3 d,放线菌和真菌培养5~6 d,连续纯化2~3次,最后采用培养基固体斜面法,4 ℃保存。
1.2.2 纤维素分解微生物的筛选
采用纤维素刚果红培养基筛选具有纤维素分解能力的菌株。1)先将纯化的菌种接种到刚果红培养基中,然后在生化培养箱中倒置培养,培养温度设置与样品取样温度一致。2)培养6 d后,在长有菌落的刚果红培养皿中滴加0.3%的刚果红溶液,摇匀之后静置染色30 min,用1 mol/L NaCl溶液冲洗刚果红培养基,来回冲洗5~6次。3)根据培养基中透明圈的有无筛选出目的菌株。
1.2.3 微生物鉴定
采用16SrDNA对筛选出的细菌和放线菌进行序列比对,真菌运用内转录间隔区ITS测序比对的方法。
细菌和放线菌基因组提取:挑取待测菌液接种于牛肉膏蛋白胨液体培养基,37 ℃振摇培养过夜,之后运用Springen MagBead Bacteria DNA Kit提取基因组DNA。真菌基因组DNA的提取:挑取待检菌株接种于马铃薯葡萄糖液体培养基,37 ℃振荡过夜,之后运用Springen MagBead Fungal DNA Kit提取真菌基因组DNA。
细菌和放线菌用合成的16S通用引物,27F:5-AGAGTTTGATCCTGGCTCAG-3;1492R:5-CTACGGCTACCTTGTTACGA-3。真菌采用合成的18S通用引物:NS1:5-GTAGTCATATGCTTGTCTC-3;NS8:5-TCCGCAGGTTCACCTACGGA-3。
PCR扩增反应体系:在0.2 mL离心管中加入以下成分:1L基因组DNA、25L 2倍Mix Buffer、1L 27F引物(10M)、1L 1492R引物(10M)、22L双蒸水。混匀后进行PCR反应,先95 ℃预变性5 min,接着95 ℃保持30 s使模板变性,然后将温度降到55 ℃,保持30 s使引物与模板充分退火;在72 ℃保持90 s,然后72 ℃使引物在模板上延伸7 min,合成DNA,完成1个循环。重复这样的循环35次。
PCR扩增序列测定与比对:将菌株16SrDNA扩增产物进行测序,得到的序列在NCBI数据库中进行比对,选择相似性在98%以上菌株的相关序列进行分析。
1.2.4 复合菌发酵效果试验
通过前期分别对细菌类、放线菌类、真菌类单一菌进行木薯渣发酵试验,筛选出细菌类以高地芽孢杆菌和地衣芽孢杆菌,放线菌主要为灰略红链霉菌,真菌类以绿色木霉菌对木薯渣发酵的效果最好。因此,复合菌发酵效果试验主要以高地芽孢杆菌、地衣芽孢杆菌、灰略红链霉菌和绿色木霉菌为对象。细菌类、放线菌类、真菌类分别在牛肉膏蛋白胨液体培养基、高氏一号液体培养基、马铃薯葡萄糖液体培养基中,28 ℃、200 r/min振荡培养5~6 d后,高地芽孢杆菌和地衣芽孢杆菌在600 nm下测OD值,用无菌水将OD值稀释到1.0后,混合成细菌类菌液;灰略红链霉菌和绿色木霉菌先通过测量菌液中的孢子浓度,分别稀释到1×107cfu/mL的菌液。根据表1处理进行菌株组合,全部按照1:1等体积混合成菌液,CK采用无菌水替代,取2 mL菌液接种到木薯渣固体培养基中,商业菌剂的添加按照说明书上进行,在28 ℃生化培养箱中静置培养15 d,然后测量发酵后木薯渣的失质量率、纤维素和半纤维素。
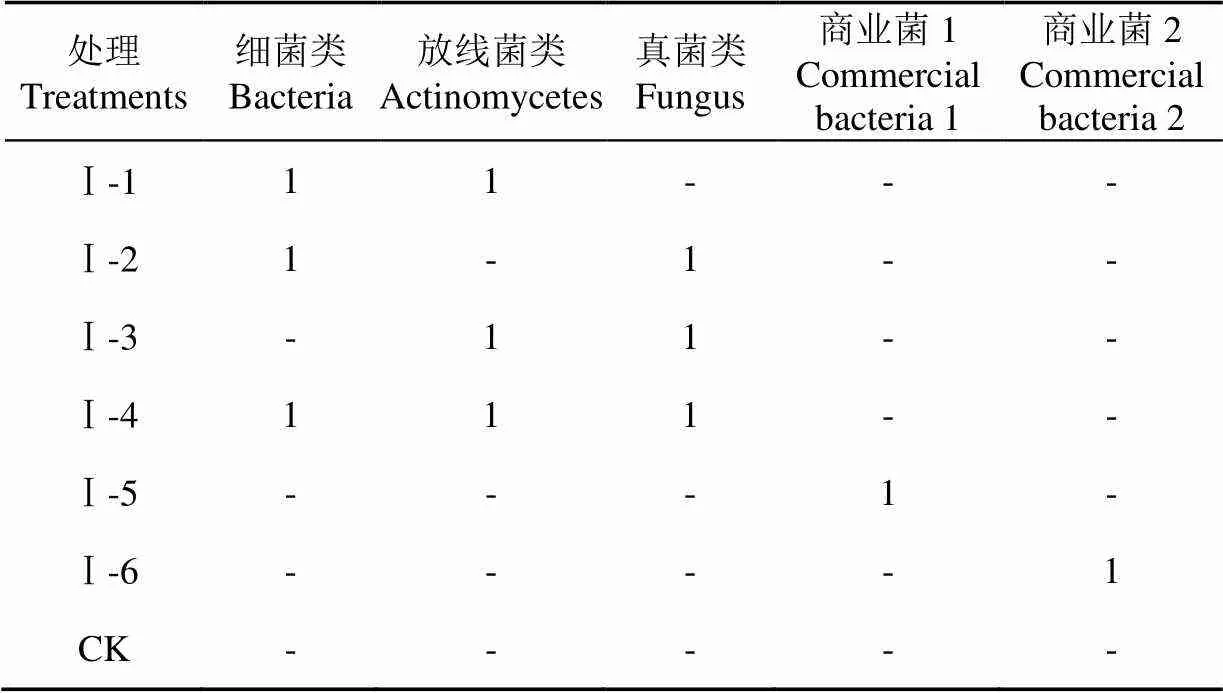
表1 木薯渣发酵复合微生物菌组合配比
注:“1”表示有一份,细菌类1份包括高地芽孢杆菌和地衣芽孢杆菌2种菌,放线菌类1份仅为灰略红链霉菌,真菌类1份仅为绿色木霉。“-”表示没有,下同。
Note: “1” means there is one copy. One copy of bacteria includes two species ofand. One copy of actinomycetes is only, and one copy of fungi is only. “-“ means no have, the same as the below.
1.2.5 失质量率、纤维素和半纤维素测定
失质量率采用烘干称重法,先将发酵的木薯渣转移到100 mL的离心管中,在28 ℃、270 r/min摇床中振荡30 min后,28 ℃条件下,9 000 r/min离心10 min,弃上清液,加蒸馏水,重复洗涤3次;弃上清液,将离心管中的木薯渣全部移到玻璃培养皿中,在95 ℃烘箱中烘干2~3 d,烘干至恒质量并称质量(1),按以下公式计算:
失质量率=((10-1)/10)×100% (1)
纤维素含量采用72%浓硫酸水解法,半纤维素含量采用2 mol/L盐酸水解法。
2 结果与分析
2.1 木薯渣发酵微生物分离
依据木薯渣发酵过程的4个关键阶段(初始期、升温期、高温期、腐熟期)为时间点进行3大类微生物(细菌、放线菌、真菌)分离,部分分离结果见图1。细菌菌落特征表现为隆起,且透明规整,表面光滑,但颜色大小各异。放线菌菌落特征为扁平,表面光亮有白色的菌丝。真菌菌落一般为圆形隆起的丝状,但大小与菌丝颜色、形状不同。在微生物分离过程中,依据菌落这些大小、颜色、形态特征不同,初始期一共分离30株菌、升温期54株、高温期25株、腐熟期32株,具体见表2。
2.2 分离微生物的筛选
将分离的微生物接种到纤维素刚果红培养基上,依据刚果红透明圈的有无,筛选具有分解纤维素能力的菌株(图2)。能分解纤维素能力的菌株,菌株周围都形成了一个透明圈,其透明圈的大小与分解能力成正相关,而没有分解能力的菌株,其周围没有出现透明圈。经筛选、判断,共选出具有纤维素降解能力的菌株54株,其中初始期9株、升温期25株、高温期9株、腐熟期11株,具体分离的微生物数量见表3所示。纯化这些菌株,进一步鉴定分析。
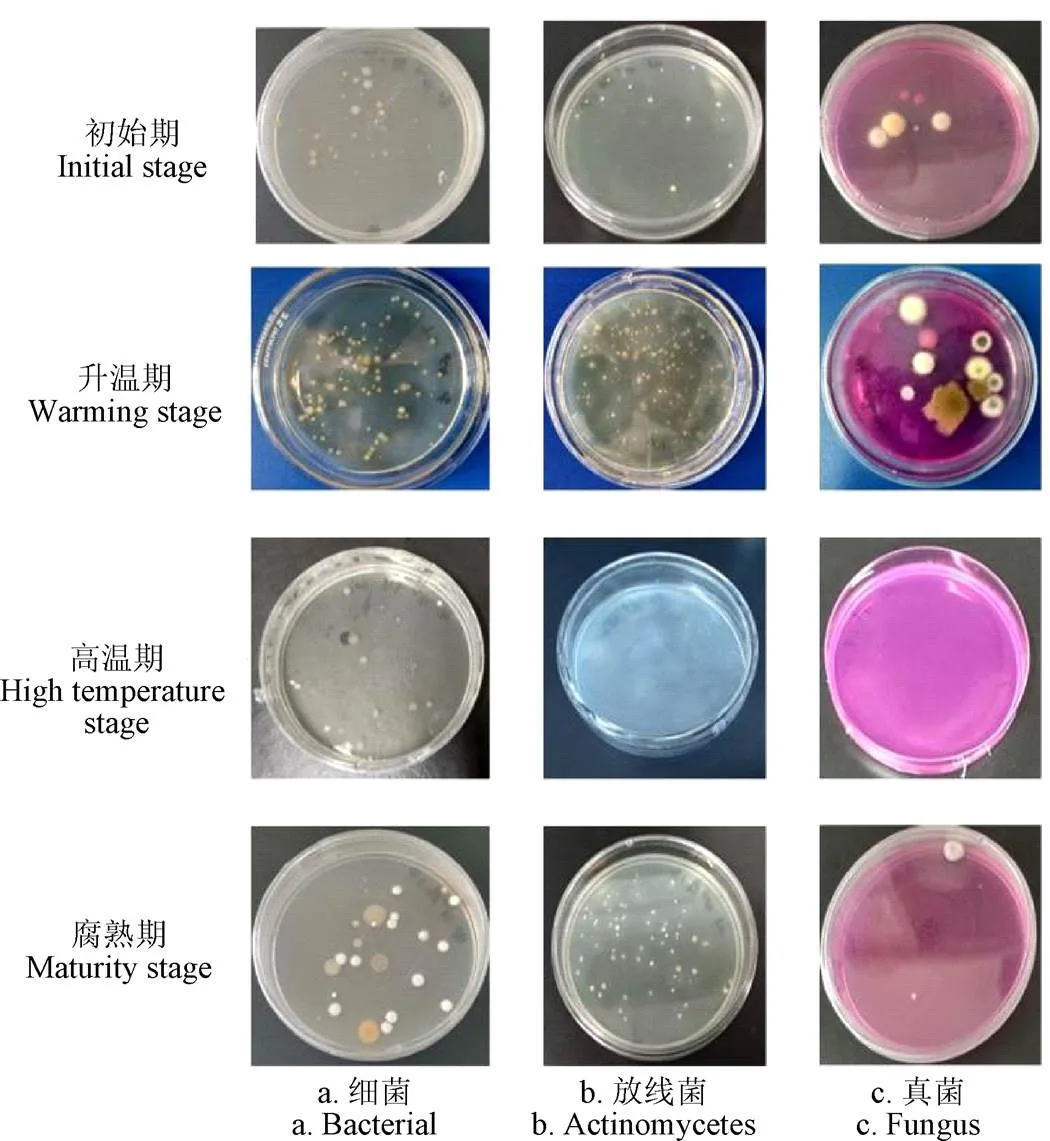
图1 木薯渣发酵关键阶段的微生物培养

表2 木薯渣发酵不同阶段微生物分离数量

图2 刚果红培养基筛选具有分解纤维素能力的微生物

表3 木薯渣发酵不同阶段具有分解纤维素能力的微生物数量
2.3 微生物鉴定
经过基因组提取、扩增、测序以及NCBI数据库比对后,一共鉴定出37株菌,另有标号为AX6、AZ3、BX4、CF3、CF4、CF6、CF7、CF9、CF12、DX2、EF1、EF2、EF3、EF4、FX12、FX13、FF的菌株,没有鉴定出来。从表4中可以看出鉴定出的37株菌中,细菌大多是芽孢杆菌类,放线菌多为链霉菌类,真菌为木霉菌类。
2.4 复合菌发酵效果
如图3所示,3类微生物菌混合的处理(I-4),木薯渣纤维素含量最低,为24.4%,显著低于对照处理,其余处理组合纤维素含量之间没有显著差异。复合菌处理条件下,木薯渣半纤维素含量显著低于对照,其中I-1、I-2、I-4和I-6复合菌处理下半纤维素含量均较低,但它们之间没有显著差异。I-4处理下木薯渣失重率显著高于其他处理,与对照相比,增加34.8%。综上,3类菌制成的混合菌(I-4)处理,对木薯渣发酵效果最好,并好于2种商业菌剂(I-5和I-6)。

表4 微生物鉴定结果

注:每个值都是由3个重复的平均值±标准误差,柱上不同字母表示处理间差异显著(P <0.05)。
3 讨 论
工农业有机固体废弃物基质化发酵过程是在微生物的作用下,将难降解的有机物分解成可被植物利用的小分子物质,而参与发酵微生物主要种类有细菌、放线菌和真菌,其中细菌占主导地位,其次是放线菌和真菌[13]。本试验结果表明,在分离的木薯渣发酵微生物中,细菌数量最多。有机物基质发酵过程中微生物的数量和群落是随着发酵进程变化而不同,升温期一般嗜温微生物非常活跃,它们旺盛的代谢可产生许多热量,使堆体温度不断升高;达到高温期时,嗜热微生物开始活跃,主要为耐高温细菌与放线菌,真菌极少[14-16]。本试验中,木薯渣发酵在高温期,分离出的放线菌和真菌数量较少,其中真菌未发现。细菌类主要以耐高温的菌为主,如高地芽孢杆菌和苍白气芽孢杆菌。
对于有机木质固体废弃物,影响发酵周期长短的关键因素是木质纤维的降解。因此,添加木质纤维素降解菌至有机废弃物中,是缩短发酵周期最经济、最有效的措施之一,也是当前废弃物基质化利用研究的热点[17]。目前,已从自然界中分离筛选出许多具有纤维素降解能力的优良菌株,包括细菌、放线菌和真菌等。本研究将木薯渣4个发酵关键时期分离出的微生物,运用纤维素刚果红培养基平板法,筛选具有纤维素降解能力的菌株,结果发现能降解纤维素的,大多为细菌类,包括芽孢杆菌属、类芽孢杆菌属、小双孢菌属、高温单胞菌属等,放线菌类一般有链霉菌属、诺卡氏菌属、高温放线菌属、纤维放线菌属等,真菌类主要有木霉属、青霉属、曲霉属、毛壳菌属等。
在工农业有机废弃物基质化发酵过程中,添加外源微生物菌剂可以提高发酵质量,缩短发酵时间。通常情况下,微生物菌剂分为单一微生物菌剂和复合微生物菌剂,目前,国内外研究与使用最多的是复合微生物菌剂,主要是由于复合微生物菌剂之间的互利共生作用,以及它们的对发酵环境的适应能力比较强。而单一微生物菌剂主要是一些链霉菌属和芽孢杆菌属等,它们对发酵环境适应能力比较低[18-19]。本研究中,通过将筛选出的微生物菌株按比例混配形成复合菌,发现发酵微生物之间存在相互协同促进作用,其中4种菌复配形成的微生物菌剂对木薯渣发酵的效果好于其他菌的组合。细菌、放线菌和真菌的混合菌液可以提高发酵降解的效率,这可能是由于每种菌的分解代谢的酶系组分不同,它们之间正好起到互补协同的作用,促进了降解发酵效果[20-21]。
4 结 论
考虑后期混合菌操作的简便性、有效性,以及用最少的菌种发挥最大的效果,通过将细菌类、放线菌类与真菌类菌株进行复配,发现复合菌发酵效果优于单一菌,其中以I-4处理(高地芽孢杆菌、地衣芽孢杆菌、灰略红链霉菌和绿色木霉)后,木薯渣失质量率较对照(CK)显著提高了34.8%,而纤维素和半纤维素含量分别下降,对木薯渣发酵效果最好,可用于今后木薯渣基质发酵商业微生物菌剂的制备和生产。
[1] 冯海萍,杨志刚,杨冬艳,等. 枸杞枝条基质化发酵工艺及参数优化[J]. 农业工程学报,2015,31(5):252-260.
Feng Haiping, Yang Zhigang, Yang Dongyan, et al. Parameter optimization of fermented substrate from wolfberry shoots[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(5): 252-260. (in Chinese with English abstract)
[2] Ventorino V, Ionata E, Birolo L, et al. Lignocellulose- adapted endo-cellulase producing streptomyces strains for bioconversion of cellulose-based materials[J]. Front Microbiology, 2016, 22(7): 2061.
[3] Hu H, Jiang C, Wu Y, et al. Bacterial and fungal communities and contribution of physicochemical factors during cattle farm waste composting[J]. Microbiologyopen, 2017, 6(6): 1-11.
[4] Wang Y, Xu W, Bai Y, et al. Identification of an-(1, 4)-glucan-synthesizing amylosucrase from cellulomonas carbonis T26[J]. Journal Aagricultural and Food Chemistry, 2017, 65(10): 2110-2119.
[5] Awasthi M K, Zhang Z, Wang Q, et al. New insight with the effects of biochar amendment on bacterial diversity asindicators of biomarkers support the thermophilic phase during sewage sludge composting[J]. Bioresource Technology, 2017, 238: 589-601.
[6] Antonov E, Schlembach I, Regestein L, et al. Process relevant screening of cellulolytic organisms for consolidated bioprocessing[J]. Biotechnology for Biofuels, 2017, 10(1): 106-120.
[7] 周群. 微生物菌株的筛选及其在农村生活有机废弃物堆肥中的应用[D]. 泰安:山东农业大学,2017.
Zhou Qun. Microbial Strains Screening and Their Application in Rural Life Organic Waste Composting[D]. Tai’an: Shandong Agricultural University, 2017. (in Chinese with English abstract)
[8] Richard T L, Hamelers H V M, Veeken A H M, et al. Moisture relationships in composting processes[J]. Compost Science and Utilization, 2012, 10: 286-302.
[9] Ridha N, Bharti A, Kumar S. Effect of bulking agents and cow dung as inoculant on vegetable waste compost quality[J]. Bioresource Technology, 2017, 252(2): 83-96.
[10] 王佳宁. 猪粪堆肥复合菌剂制备及其效果评价[D]. 大连:大连理工大学,2017.
Wang Jianing. The Preparation and Evaluation of the Mixed Microbial Agents for Pig Manure Composting[D]. Dalian: Dalian University of Technology, 2017. (in Chinese with English abstract)
[11] 吕伟生,黄国强,邵正英,等. 接种菌剂腐熟稻草育秧基质提高机插稻秧苗素质及产量[J]. 农业工程学报,2017,33(11):195-202.
Lu Weisheng, Huang Guoqiang, Shao Zhengying, et al. Straw substrate with decomposition agent improving seedling quality and yield of machine-transplanted rice[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(11): 195-202. (in Chinese with English abstract)
[12] 王亮. 牛粪好氧堆肥中微生物多样性及生产应用研究[D].北京:北京林业大学,2012.
Wang Liang. Manufacture and Application of Microbial Diversity in Aerobic Composting of Cattle Manure[D]. Beijing: Beijing Forestry University, 2012. (in Chinese with English abstract)
[13] 李国学,李玉春,李彦富. 固体废物堆肥化及堆肥添加剂研究进展[J]. 农业环境科学学报,2003,2:252-256.
Li Guoxue, Li Yuchun, Li Yanfu. Advance on composting of waste an utilization of additives[J]. Journal of Agro-Environment Science, 2003, 2: 252-256. (in Chinese with English abstract)
[14] 廖宗文. 工业废物的农用资源化:理论、技术和实践[M]. 北京:中国环境科学出版社,1996.
[15] 李国学,张福锁. 固体废物堆肥化与有机复混肥生产[M]. 北京:化学工业出版社,2000.
[16] 李吉进. 畜禽粪便高温堆肥机理与应用研究[D]. 北京:中国农业大学,2004.
Li Jijin. Study on Mechanism of High Temperature Composting of Livestock Manure and Its Application[D]. Beijing: China Agricultural University, 2004. (in Chinese with English abstract)
[17] 席北斗,刘鸿亮,白庆中,等. 堆肥中纤维素和木质素的生物降解研究现状[J]. 环境污染治理技术与设备,2002,3:19-23.
Xi Beidou, Liu Hongliang, Bai Qingzhong, et al. Study on current status of lignin and cellulose biodegradation in composting process[J]. Techniques and Equipment for Environmental Pollution Control, 2002, 3: 19-23. (in Chinese with English abstract)
[18] Lashermes G, Barriuso E, Le V R M, et al. Composting in small laboratory pilots[J]. Waste Management, 2012, 32(2): 271-277.
[19] 周营,朱能武,刘博文,等. 微生物菌剂复配及强化厨余垃圾好氧堆肥效果分析[J]. 环境工程学报,2018,12(1):294-303.
Zou Ying, Zhu Nengwu, Liu Bowen, et al. Effect analysis of compound microbial agents and enhancement on kitchen waste aerobic composting[J]. Chinese Journal of Environmental Engineering, 2018, 12(1): 294-303. (in Chinese with English abstract)
[20] 陈耀宁. 堆肥化中协同降解木质纤维素的混合菌筛选及其养[D]. 长沙:湖南大学,2007.
Chen Yaoning. Screening and Co-culture of Mixed Strains for Synergistic Decomposing of Lignocellulose From Compost[D]. Changsha: Hunan University, 2007. (in Chinese with English abstract)
[21] 方亚曼. 复合微生物菌剂的研制及其在堆肥上的应用研究[D]. 上海:上海师范大学,2011.
Fang Yaman. Study on the Development of Compound Microbial Agent and Its Application in Composting[D]. Shanghai: Shanghai Normal University, 2011. (in Chinese with English abstract)
Isolation and identification of cassava residue substrate fermentation microorganisms and compound bacteria preparation
Wang Zhan1, Leng Yuqian1, Guo Shirong1, Sun Jin1, Xia Pengfei2, Shu Sheng1※
(1.,,210095,;2..,211800,)
Cassava residue is a typical byproduct inacassava industry, containing a large amount of lignocellulose.However, if not treated timely, the cassava residuecanseriously pollute the ecological environment, due toits relatively slow degradationunder natural conditions. It is urgent to properly treatthe byproductsof cassava processingin time. At present, the cassava residue is mainly used in the production of animal feed, horticultural substrates, and industrial raw materials. Nevertheless, there are certain drawbacks in the processingof cassava residues underthese pathways. The lignocellulose is akey factor that affects the fermentation process of organic wastes. In recent years, most microbial studies on the fermentation of organic waste matrixes, such as vinasse and twigs, have focused on the cellulose-efficient degrading bacteria. This study aims to isolate, screen and identifythe microbial strains related to the fermentation of cassava residue from the natural fermentation process, thereby to obtain a composite microbial agent.An emphasis is put on the fermentation of composite microbial agent in the cassava residue matrix. The main results are as follows:Microorganisms were isolated during the four key periods of natural fermentation,including the initial stage (25℃), warming stage (25-40℃), high temperature stage (55-60℃), and decaying stage (25℃). A plate coating method was used to isolate microorganisms at different fermentation stages, where the 30 strains of bacteria were isolated in the initial stage, 54 strains in the warming stage, 25 strains in the high temperature stage, and 32 strains in the rotting stage. Further inoculation of isolated microorganisms onto Congo red medium can contribute to the selection of 54 strains with lignocellulose-degrading functions. 37 microorganisms closely related to cassava residue fermentation were identifiedusing the 16S rDNA and ITS sequencing of inner transcribed spacer region. The combination ofandwas the best fermenting bacterium, while the actinomycetes were the best fermenting bacterium. The red streptomyceteswere the most effective, where thefungi were best with. The strains were further compounded in proportion to form microbial agents.It was found that the mixture of three types of microorganisms had the best fermentation effect,wherethe residue cellulose content was reduced by 24.4%,while,the weight loss was significantly higher than that of commercial agents. These results demonstratedthat there was a certain synergy between microorganisms, and this synergy can contribute to promote the fermentation process of cassava pomace.The compound microbial agents can be recommendedduring this time to achievethe most efficient fermentation,including the,,, and.
fermentation; microorganisms; cassava residue substrate; identification; compound microorganism
王战,冷雨茜,郭世荣,等. 木薯渣基质化发酵微生物分离及复合菌配制[J]. 农业工程学报,2020,36(21):266-271. doi:10.11975/j.issn.1002-6819.2020.21.032 http://www.tcsae.org
Wang Zhan, Leng Yuqian, Guo Shirong, et al. Isolation and identification of cassava residue substrate fermentation microorganisms and compound bacteria preparation[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(21): 266-271. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.21.032 http://www.tcsae.org
2020-07-08
2020-10-12
国家重点研发计划项目(2019YFD1001900);中央高校基本科研业务费专项资金资助(KYLH202005);国家大宗蔬菜产业体系建设专项资金(CARS-23-B12)
王战,研究方向为设施园艺。Email:1024273853@qq.com
束胜,博士,副教授,研究方向为设施园艺与无土栽培。Email:shusheng@njau.edu.cn
10.11975/j.issn.1002-6819.2020.21.032
TS210
A
1002-6819(2020)-21-0266-06

