结直肠癌肝转移患者癌细胞白细胞介素-13受体α2的表达及其与骨髓源性抑制细胞的关系
余姝彦, 杨 逸, 胡 婷, 曹艳佩
(复旦大学附属华山医院, 1. 普外科, 2. 护理部, 上海, 200041)
肝脏是结直肠癌血行转移最常见的部位,发生肝转移后的治疗效果是非常有限的[1]。肝脏切除术联合射频消融术(RFA)是目前根治结直肠癌肝转移的唯一选择[2-3], 但仅有30%的患者术后可存活4~5年。考虑到与肝切除术相关的严重并发症和较高死亡风险[4-5], 若能预先辨别有发生肝转移倾向的患者并给予针对性的干预,将会使其获得巨大的收益。白细胞介素-13(IL-13)是一种由活化的T细胞、自然杀伤T细胞(NKT细胞)、人气道平滑肌细胞、肾细胞癌和Hodgkin-Reed-Sternberg肿瘤细胞分泌的分子量17 kDa的细胞因子,参与过敏性炎症、纤维化、杯状细胞增生和肿瘤细胞生长等过程[6]。目前研究[7-9]已发现3种类型的IL-13受体(IL-13R), 包括IL-4R、IL-13Rα1、IL-13Rα2, IL-13Rα2只在正常人的睾丸组织中表达,而其他部位发现IL-13Rα2表达都与癌症有关,提示IL-13Rα2的高表达与肿瘤肝转移有关。
骨髓源性抑制细胞(MDSCs)是由骨髓祖细胞产生,其最终未能分化为成熟的粒细胞和巨噬细胞。MDSCs表达CD33、CD11b、IL-4Rα和低水平的CD15, 并含有高水平的精氨酸酶[10]。近年来,研究[11-13]报道MDSCs在肿瘤的发生和转移中发挥关键作用。胰腺癌、食管癌和胃癌中发现MDSCs升高,并与IL-13的显著升高有关[14-15]。本研究中,作者检测了结直肠癌肝转移病例IL-13Rα2的表达情况,阐明了IL-13Rα2与MDSCs的关系,分析了IL-13Rα2水平对患者预后的影响,现将结果报告如下。
1 材料与方法
1.1 一般资料
回顾性收集2000—2013年在复旦大学华山医院手术的68例结直肠癌患者的肿瘤石蜡切片标本,行转移切除术或根治术时的年龄为41~87岁,中位年龄为61岁,男32例,女36例; 病灶部位包括原发灶20例(T4NxM0结直肠癌),脑转移20例,肝转移11例,其他远处转移17例,均为单一部位转移灶; 肝转移患者原发肿瘤部位包括结肠癌9例,直肠癌2例; 肝转移灶部位包括右半肝5例,左半肝6例。所有患者均获得知情同意,妥善处理患者的隐私信息,本研究方案得到了医院医学伦理委员会的批准。
1.2 免疫组化
所有病例均使用常规免疫染色方案,切片厚度为4.0 μm, 组织切片经二甲苯浸泡、一系列酒精中再水化脱蜡,在900 W条件下微波5 min, 1次,而后在600 W条件下微波3次, 5 min/次,采用0.5%H2O2处理以抑制内源性过氧化物酶活性。将载玻片用适当的一级抗体稀释液培养并在4 ℃冰箱中过夜。切片进行抗原回收程序,然后与小鼠抗人IL-13Rα2单克隆抗体(抗人IL-13Rα2抗体ab55275, Abcam)在37 ℃孵育1 h, 采用enVision Plus系统试剂盒(丹麦达科)短暂处理后,观察IL-13Rα2表达。采用抗CD11B抗体(克隆EP1345Y; Abcam)和抗CD33抗体(克隆WM53; EMD微孔)进行双重染色。每次试验均包括阳性和阴性对照; 采用荧光抗体、山羊抗兔免疫球蛋白(H+L)抗体和山羊抗鼠免疫球蛋白(H+L)抗体对CD33进行显示。由3位经验丰富的病理专家在不了解患者临床病理信息的情况下,进行双盲独立评估IL-13Rα2染色载玻片。
IL-13Rα2的免疫反应强度和百分比以半定量的方式进行评分,评定结果分为0、+、、, 其中0、+定义为阴性,、定义为阳性。采用图像分析系统对免疫组化结果进行定量分析,仪器包括松下MV-CP410摄像机、奥林巴斯BH2显微镜、尼康4500摄像机。图像采集输入计算机后,选择正负区,测量吸光度值(OD值)。
1.3 统计学分析
采用SPSS 17.0统计学软件进行数据分析,定性变量的频率以(%)表示,比较采用χ2检验和分类变量线性回归,P<0.05为差异有统计学意义。
2 结 果
2.1 IL-13Rα2与结直肠癌转移的关系
结果显示, 68例患者IL-13Rα2的免疫反应强度和百分比为3例0(4.4%), 21例+(30.8%), 13例(19.1%), 31例(45.6%)。见图1。IL-13Rα2的免疫反应强度在肝转移与原发灶、脑转移和其他转移比较,差异有统计学意义(P<0.05)。见表1。肝转移的IL-13Rα2阳性率高于原发灶、脑转移及其他转移,差异有统计学意义(P<0.05)。见表2。
2.2 转移性结直肠癌中MDSCs与IL-13Rα2的关系
通过测量OD值分析IL-13Rα2的表达水平与MDSCs数量的关系,结果显示, IL-13Rα2的表达与MDSCs数量呈线性相关(r=0.740,P<0.05), 见图2。

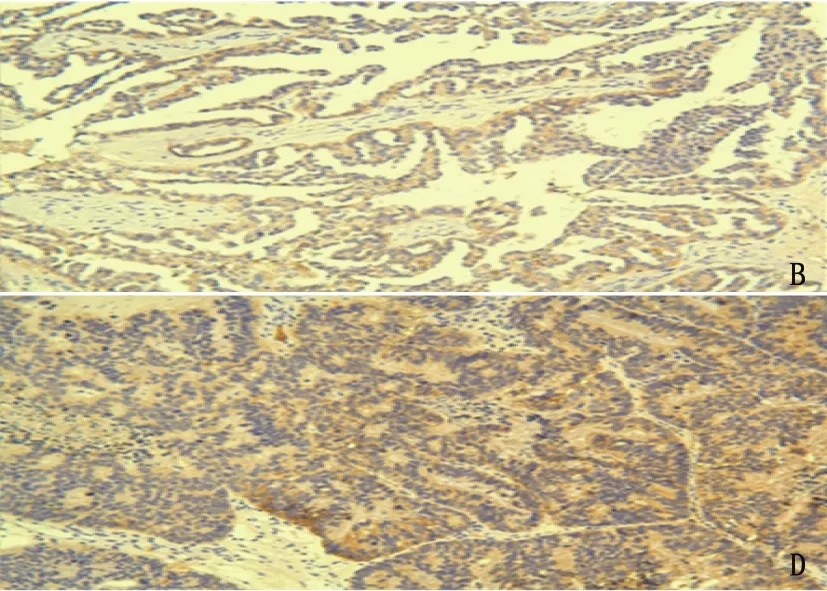
A: IL-13Rα2染色得分为0; B: IL-13Rα2染色得分为+; C: IL-13Rα2染色得分为; D: IL-13Rα2染色得分为。

表1 IL-13Rα2的免疫反应强度与病灶转移的关系[n(%)]

表2 不同病灶转移的IL-13Rα2阳性率与阴性率比较[n(%)]

图2 转移性结直肠癌MDSCs与IL-13Rα2的线性回归图
2.3 IL-13Rα2不同表达水平患者的预后
本研究包括了48例结直肠癌远处转移患者,均接受了转移灶切除术,其中男23例,女25例,年龄44~87岁,平均(64.5±10.7)岁,生存期4~25个月,平均生存期为(12.6±5.2)个月。本研究结束时, 46例患者死亡(95.8%), 1年存活率为47.9%。将48例患者分为IL-13Rα2阳性组、IL-13 Rα2阴性组。2组患者生存曲线见图3。

图3 IL-13Rα2阳性组与阴性组的生存曲线
3 讨 论
结直肠癌是男性常见的癌症类型,有20%以上患者可诊断为转移性结直肠癌(Ⅳ期),高达25%的患者会有孤立的肝转移[16-17], 但仅有30%的患者在手术后存活4~5年。因此,结直肠癌的潜在发病机制和治疗已成为基础研究的重要方向。
3.1 结直肠癌肝转移与IL-13Rα2的关系
IL-13Rα2高亲和力结合IL-13并内化,推测IL-13Rα2的细胞外结构域可以作为Ⅱ型IL-13R复合物的诱导受体[18], 其信号传导与信号传导及转录激活蛋白6(STAT6)无关,并涉及激活蛋白-1(AP-1)途径来诱导转化生长因子β1活性的激活[19]。IL-13Rα2在某些类型的人类癌症如胶质母细胞瘤、头颈癌、肾癌、卵巢癌中都过表达[20-22]。研究[23-24]报道, IL-13Rα2基因的表达与乳腺癌、胰腺癌和结直肠癌的转移、浸润有关。BARDERAS R等[25]研究发现, IL-13Rα2的表达促进了结直肠癌细胞的转移、侵袭和黏附,同时IL-13Rα2也导致了小鼠肝脏归巢的减少。然而, IL-13Rα2在原发性或转移性癌症中的临床意义尚不清楚。本研究中,结直肠癌肝转移灶的IL-13Rα2阳性率为90.8%, 肝转移的IL-13Rα2阳性率高于原发灶、脑转移及其他转移,差异有统计学意义(P<0.05), 提示IL-13Rα2的过表达与结直肠癌肝转移的发生具有相关性[26-27]。
3.2 IL-13Rα2与MDSCs的关系
很多癌细胞具有刺激一系列免疫和细胞因子过度表达的特征。MDSCs通过多种机制引发免疫抑制和肿瘤免疫逃逸: ① 精氨酸的消耗, MDSCs表达高水平的精氨酸酶Ⅰ, 将L-精氨酸水解为鸟氨酸、精氨酸和尿素,同时有两种不同基因编码的精氨酸酶亚型。MDSCs表达精氨酸酶I,其消耗L-精氨酸抑制T细胞功能[28]。② 活性氧产物过氧亚硝酸盐硝酸盐氧化TCR-CD8, 从而阻止CD8+T细胞结合主要组织相容性复合体(MHC)[29-30]。③ 诱导调节性T细胞。HOECHST B[31]发现肝细胞癌中的MDSCs直接抑制肿瘤特异性CD4+T细胞,在体外也可间接诱导CD4+CD25+Foxp3+Treg。KO JS[31]研究发现,使用舒尼替尼治疗的肾细胞癌患者MDSCs数量减少,同时T调节细胞也减少。HALL B[32]发现,当IL-13Rα2的表达下降时,在体内头颈部鳞状细胞癌中MDSCs的数量也显著减少。本研究发现,结直肠癌肝转移患者IL-13Rα2的表达与MDSCs数量呈线性关系, MDSCs数量较多,则IL-13Rα2的表达较高。
3.3 IL-13Rα2与结直肠癌存活率的关系
高表达IL-13Rα2的样本有更多的MDSCs, 而MDSCs具有免疫抑制作用,结直肠癌肝转移中IL-13Rα2的最高阳性率可能与MDSCs诱导的肿瘤免疫逃逸有关。IL-13Rα2表达增高可导致患者术后生存时间缩短,预后较差,因此IL-13Rα2可作为术前预测结直肠癌远处转移的新标志物。
(致谢:在此感谢上海华山医院病理科许祖德医师在提供病理样品方面的合作!)

