非洲猪瘟病毒p17蛋白单克隆抗体的制备与鉴定
白晶晶,宋欢欢,白晨雨,郝丽影,颜世君,杜萌萌,李向东,邓均华,田克恭,
(1.洛阳普泰生物技术有限公司,河南 洛阳 471000;2.国家兽用药品工程技术研究中心,河南 洛阳 471000)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起猪的一种急性、热性、高度传染性疾病[1-3]。该病病程短,死亡率高,对于养猪业是一种毁灭性疫病。世界动物卫生组织(OIE)将其列为A类动物疫病,我国将此病归为一类动物传染病[4-5],并将其作为重点防范的外来动物疫病。
我国于2018年8月在辽宁省沈阳市发现首例非洲猪瘟病例,随后快速蔓延至全国,对我国养猪业构成巨大的威胁。自ASFV发现以来,虽然在DNA疫苗、减毒疫苗、亚单位疫苗及病毒活载体疫苗方面的研究中取得了一定进展,但是这些疫苗仅对ASFV的感染产生有限的保护。此外,针对该病尚无有效的治疗方法,一旦发病,死亡率可达100%。非洲猪瘟的防控主要依靠快速确诊,及时隔离、扑杀、消毒、限制流通等手段来阻止疫情的传播。因此,ASFV诊断检测方法的研究刻不容缓。ASFV为有囊膜的二十面体对称的双股DNA病毒,平均直径200 nm,结构复杂。基因组约179~193 kb,含有150~167个开放阅读框(Open reading frames,ORFs),编码150~200种蛋白质,其中约50多种是病毒的结构蛋白[6-8]。同时ASFV基因组还编码DNA复制、基因转录和RNA修饰相关酶类,以及调节宿主细胞功能和参与病毒免疫逃逸的相关蛋白质。p17蛋白是ASFV表达的晚期膜蛋白,由基因D117L编码,该基因序列在病毒所有毒株中高度保守。p17蛋白与细胞内质网有着固有的亲和力,作为内质网的膜池蛋白,参与了病毒颗粒形态的构成。抑制p17蛋白的表达,对结构蛋白例如p72、p54或者多聚蛋白pp220的合成无明显影响,但能阻碍pp220蛋白和pp62蛋白的酶解,从而影响病毒结构的形成。通过电子显微镜观察病毒感染后的细胞,在感染早期,病毒的衣壳蛋白和内膜蛋白之间相互作用,会形成1个螺旋面的结构,类似于1个不成熟的病毒颗粒,随后在不同前体膜蛋白的作用下进而形成病毒成熟的二十面体结构。p17蛋白不参与内质网驱动的膜池的募集和修饰,但是p17蛋白的缺失,会影响前体膜的螺旋面的形成,并且阻碍病毒二十面体结构形成的进程,进而使病毒变得不稳定,并失去感染作用[9-11]。
单克隆抗体因具有特异性强、敏感性高的特点而被广泛应用于各种病原的免疫学检测。p17蛋白是ASFV主要的编码蛋白,鉴于此,利用杆状病毒表达系统表达重组ASFV p17蛋白并制备单克隆抗体,以期为ASFV免疫类诊断试剂产品的开发提供重要的生物材料。
1 材料和方法
1.1 材料
1.1.1 菌株和质粒 大肠杆菌(E.coli)Trans 5α感受态细胞购自北京全式金生物技术有限公司;DH10Bac感受态细胞、pFastbac1杆状病毒转移载体等均由国家兽用药品工程技术研究中心提供。
1.1.2 细胞及供试动物 昆虫细胞sf9由国家兽用药品工程技术研究中心保存;SP2/0骨髓瘤细胞由洛阳普泰生物技术有限公司保存;SPF级4周龄BALB/c小鼠、8~10周龄BALB/c经产母鼠均购自北京维通利华实验动物技术有限公司。
1.1.3 主要试剂BamHⅠ和HindⅢ限制性内切酶及T4 DNA连接酶均购自赛默飞世尔科技公司;CellfectinⅡ转染试剂盒、SF-900Ⅱ无血清培养基均购自上海Invitrogen公司;质粒提取试剂盒和胶回收试剂盒均购自Omega公司;HisTrap 1 mL预装柱、HiLoad 16/600 Superdex 200 pg分子筛预装柱购自美国GE公司;Ni2+亲和层析填料购自美国GE Healthcare公司;DNA分子量标准(DL5000)购自TAKARA公司;预染蛋白质分子质量标准物购自麦约尔生物技术有限公司;BCA法蛋白质浓度测定试剂盒购自碧云天公司;ASFV标准阳性血清、ASFV抗原板购自欧盟ASFV参考实验室(EU Reference Laboratory for ASF,INIA-CISA);RPMI-1640培养基购自Life Technologies公司;HRP标记的羊抗猪IgG、HRP标记的羊抗鼠IgG、弗氏完全佐剂、弗氏不完全佐剂、HAT混合盐、HT混合盐等均购自Sigma公司;FITC标记的羊抗鼠IgG购自Thermo公司;无菌石蜡购自北京陆桥生物技术公司;小鼠单克隆抗体Ig类/亚类/亚型鉴定用ELISA试剂盒购自洛阳佰奥通实验材料中心。
1.2 方法
1.2.1 p17重组蛋白的真核表达及鉴定
1.2.1.1p17基因合成 根据GenBank 中ASFV-SY18株基因组序列(登录号:MH766894.1),由上海生工生物工程有限公司合成p17基因序列,该基因编码区全长354 bp,编码117个氨基酸。
1.2.1.2p17基因引物设计及合成 根据合成的p17基因序列,用Primer Premier 5.0软件设计引物,并在上下游引物5′端引入酶切位点BamHⅠ和HindⅢ(下划线),同时通过下游引物在目的基因 C端引入6个His标签。利用引物Bac13F/Bac13R,对重组杆状病毒质粒进行PCR鉴定。引物由金唯智生物科技有限公司合成,序列如下:
p17-F:5′-CGCGGATCCATGGACACTGAAACATCTCCTCTGCTGTCACAC-3′;p17-R:5′-CCC-AAGCTTTTAGTGGTGGTGGTGGTGATGGTTGTTGGAGTGGGCCAGTTC-3′;Bac13-F:5′-GTTTTCCCAGTCACGAC-3′;Bac13-R:5′-CAGGAAACAGCTATGAC-3′。
1.2.1.3 重组质粒pFastBac-p17的构建 分别用BamHⅠ和HindⅢ限制性内切酶酶切pFastbac1和p17基因片段,经胶回收纯化后用T4 DNA连接酶进行连接,转化Trans 5α感受态细胞,涂布含有100 μg/mL的氨苄青霉素筛选平板,37 ℃培养过夜,挑取单克隆菌落,接种至含100 μg/ml氮苄青毒素的LB培养液中培养过夜。用质粒提取试剂盒提取质粒,经酶切鉴定筛选阳性重组质粒,由金唯智生物科技有限公司测序,将测序正确的重组质粒命名为pFastBac-p17。
1.2.1.4 重组杆粒rBacmid-p17的构建 根据Bac-to-Bac操作说明,将5 μL重组质粒pFastBac-p17转化到DH10Bac感受态细胞中。37 ℃条件下220 r/min扩大培养4 h。取出适量培养菌液涂布在含有卡那霉素、庆大霉素、四环素和X-Gal的LB筛选平板上。经2次筛选,挑取确定白斑菌落接种至5 mL含卡那霉素、庆大霉素和四环素抗性的LB培养液中,37 ℃条件下220 r/min振荡培养过夜,按Bac-to-Bac操作说明上的方法提取重组杆粒Bacmid,并用引物Bac13F/R进行PCR鉴定,将转座成功的重组杆粒命名为rBacmid-p17。
1.2.1.5 重组杆状病毒的制备 按照Cellfectin Ⅱ转染试剂盒操作说明将重组杆粒rBacmid-p17转染sf9昆虫细胞,同时设置正常细胞作为阴性对照及感染野毒的sf9昆虫细胞作为阳性对照。将细胞置于28 ℃恒温培养箱培养大约72 h,80%细胞出现病变后,收集细胞培养液上清,即为P1重组杆状病毒。
1.2.1.6 重组蛋白ASFV p17的表达及检测 用重组杆状病毒感染sf9细胞,72 h出现80%细胞病变时,收集病变细胞和感染野毒sf9细胞,1 000×g离心10 min后弃去上清,留取细胞用细胞裂解液(25 mmol/L NaHCO3,pH值8.3)进行裂解,10 000×g离心 5 min后取上清,加入5×Loading Buffer,100 ℃加热10 min制备样品,用预制胶进行SDS-PAGE,Bio-Rad半干转膜仪将胶上的蛋白质转至硝酸纤维素膜上。用含5%脱脂奶粉的PBST溶液,37 ℃封闭1 h,加入1∶500稀释的ASFV标准阳性血清,37 ℃摇床孵育1 h,PBST溶液洗3次后,将羊抗猪IgG-HRP用PBST稀释2 500倍,37 ℃孵育1 h,PBST溶液洗3次后,避光条件下进行显色,观察结果。
1.2.1.7 重组蛋白ASFV p17的纯化 大量培养接种重组杆状病毒的sf9昆虫细胞,收集感染细胞,1 000×g离心10 min,弃上清,用细胞裂解液裂解细胞,4 ℃条件下10 000×g离心10 min获得裂解上清,用Ni2+亲和层析填料进行亲和层析,最终目的产物以含500 mmol/L咪唑的洗脱液进行洗脱,将粗纯获得的重组蛋白用AKTA purifier全自动蛋白纯化仪进行分子筛进一步纯化,按峰收取蛋白质,并进行SDS-PAGE鉴定[12]。
1.2.2 单克隆抗体制备与鉴定
1.2.2.1 小鼠免疫 选取4周龄BALB/c雌性小鼠,免疫p17蛋白,采用背部皮下多点注射方法,100 μg/只,第1次免疫使用弗氏完全佐剂与纯化p17蛋白等体积混合乳化;第2次和第3次免疫用弗氏不完全佐剂与纯化p17蛋白等体积混合乳化。每次免疫间隔21 d,共免疫3次。从第2次免疫开始,每次免疫后14 d采血,用间接ELISA方法检测血清抗体效价。选择抗体效价高的小鼠,在融合前3 d背部皮下多点注射不加佐剂的纯化p17蛋白100 μg/只,进行加强免疫。
1.2.2.2 检测p17抗体的间接ELISA方法 将纯化的p17蛋白稀释至0.5 μg/mL,加至酶标板,100 μL/孔,2~8 ℃孵育20~24 h。洗板,按150 μL/孔加入封闭液,2~8 ℃孵育20~24 h。洗板后按100 μL/孔加入稀释后的样品,同时设置加PBS(0.01 mol/L,pH值7.4)的孔为阴性对照,37 ℃孵育1 h。洗板5次,按100 μL/孔加入1∶20 000倍稀释的HRP标记的羊抗鼠IgG,37 ℃孵育30 min。洗板5次,依次按50 μL/孔加入显色剂A、B液,37 ℃显色15 min;每孔50 μL加入2 mol/L 的H2SO4终止反应,10 min内用酶标仪测定各孔OD450值。阴性对照OD450<0.2时,试验成立;S/N(待检样品OD450/阴性对照OD450)≥2.1,判为阳性;S/N<2.1,判为阴性;以阳性孔对应的样品最高稀释度,作为待检样品的效价[7]。
1.2.2.3 细胞融合及筛选 融合前1 d,收取健康小鼠的腹腔巨噬细胞铺10块96孔细胞板制备饲养层细胞。将SP2/0细胞和免疫后小鼠脾细胞按1∶10比例混合,用经典PEG融合法制备杂交瘤细胞。采用间接ELISA方法来确定能够产生抗体的杂交瘤细胞株。对筛选出的阳性杂交瘤细胞株用有限稀释法进行亚克隆,直至阳性率为100%。将获得的能够稳定分泌针对p17的特异性抗体的杂交瘤细胞株扩大培养并冻存。
1.2.2.4 单克隆抗体腹水的制备 取8~10周龄BALB/c经产母鼠,每只腹腔注射0.5 mL液体石蜡,于10 d后每只小鼠腹腔注射浓度为30万/mL的杂交瘤细胞0.5 mL,待小鼠腹部明显膨大后,抽取腹水,10 000 r/min离心10 min,收集上清,-70 ℃以下冻存备用。
1.2.2.5 单克隆抗体效价测定 将腹水作为一抗,HRP标记的羊抗鼠IgG作为二抗,参照1.2.2.2中间接ELISA方法测定单克隆抗体的效价[13-14]。
1.2.2.6 单克隆抗体亚类鉴定 按照小鼠单克隆抗体Ig类/亚类/亚型鉴定用ELISA试剂盒说明书进行鉴定。
1.2.2.7 单克隆抗体间接免疫荧光(IFA)鉴定 将腹水作为一抗,FITC标记的羊抗鼠IgG作为二抗,使用商品化的ASFV抗原板对16株单克隆抗体进行IFA鉴定,以加PBS(0.01 mol/L,pH值7.4)的孔作为阴性对照。
2 结果与分析
2.1 p17基因的扩增及重组质粒的构建
用p17F/R引物以合成的p17基因为模板扩增出含酶切位点及His标签的p17基因,获得大小约380 bp的目的片段(图1A)。将目的片段通过BamHⅠ和HindⅢ酶切位点插入到pFastbac1中,用BamHⅠ和HindⅢ进行酶切鉴定。结果显示,酶切出大约380 bp的目的基因带和大约4 800 bp的载体条带(图1B)。可见,目的基因与载体的连接正确。经测序鉴定分析,p17基因编码框无误,与载体连接正确。
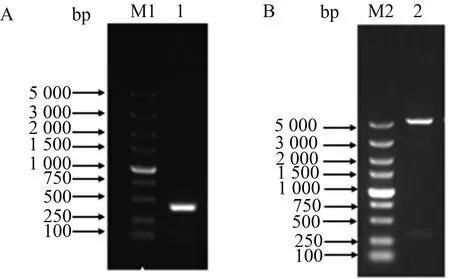
M1、M2:DNA分子质量标准(DL5000);1:p17基因的PCR产物;2:pFastBac-p17双酶切产物
2.2 重组杆粒Bacmid-p17的构建和鉴定
根据Bac-to-Bac表达手册,用Bac13F/R引物对重组杆粒rBacmid-p17进行PCR鉴定,出现大小约2 700 bp的扩增产物(图2),说明p17基因已经转座到杆状病毒载体上。
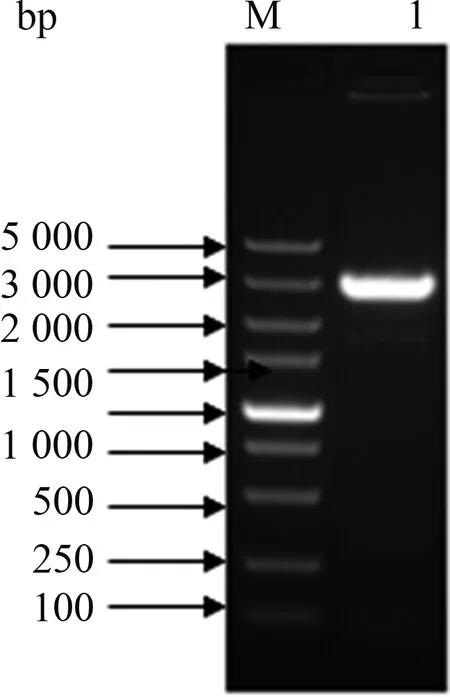
M:DNA分子质量标准(DL5000);1:用Bac13F/R引物鉴定rBacmid-P17的PCR产物
2.3 p17重组杆状病毒的获得
将重组杆粒rBacmid-p17转染sf9细胞,72 h后观察到细胞病变大于80%,表现为细胞直径增加,生长停滞,细胞内部出现颗粒体,收集细胞培养上清,即获得重组杆状病毒Ac-NPV-p17。
2.4 p17重组蛋白的表达鉴定
分别取感染野毒72 h的sf9细胞和感染Ac-NPV-p17 72 h的sf9细胞用细胞裂解液裂解,取上清用预制胶进行SDS-PAGE,转至硝酸纤维素膜进行Western blot分析。经ASFV阳性血清检测,在22 ku处出现特异性条带,与预期分子质量大小一致(图3),表明重组蛋白呈可溶性胞内表达。
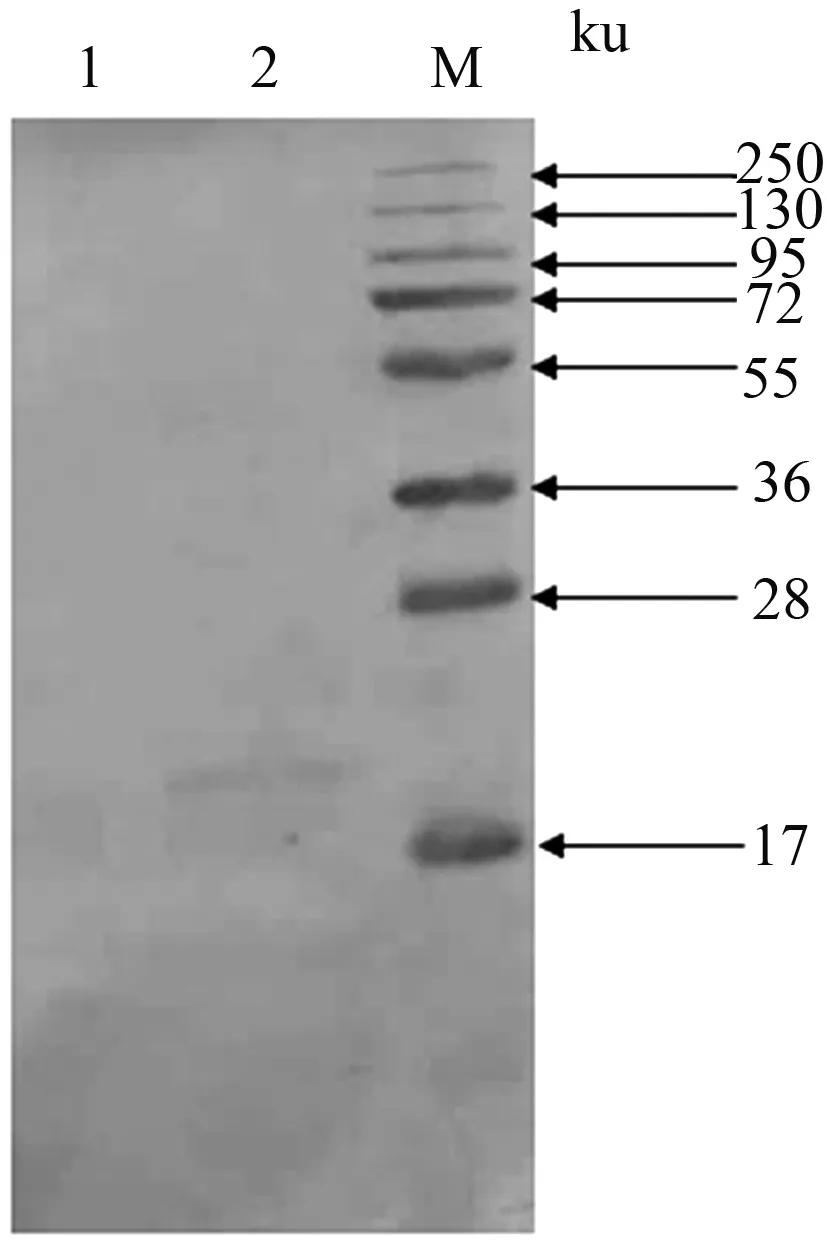
M:预染蛋白质分子质量标准;1:sf9感染野毒细胞裂解液上清; 2:sf9感染Ac-NPV-p17重组病毒细胞裂解液上清
2.5 p17重组蛋白的纯化
用镍柱对可溶性蛋白进行粗纯后,用分子筛对从镍柱上洗脱下来的蛋白质开展进一步纯化,最终获得大小约22 ku的目的蛋白(图4)。
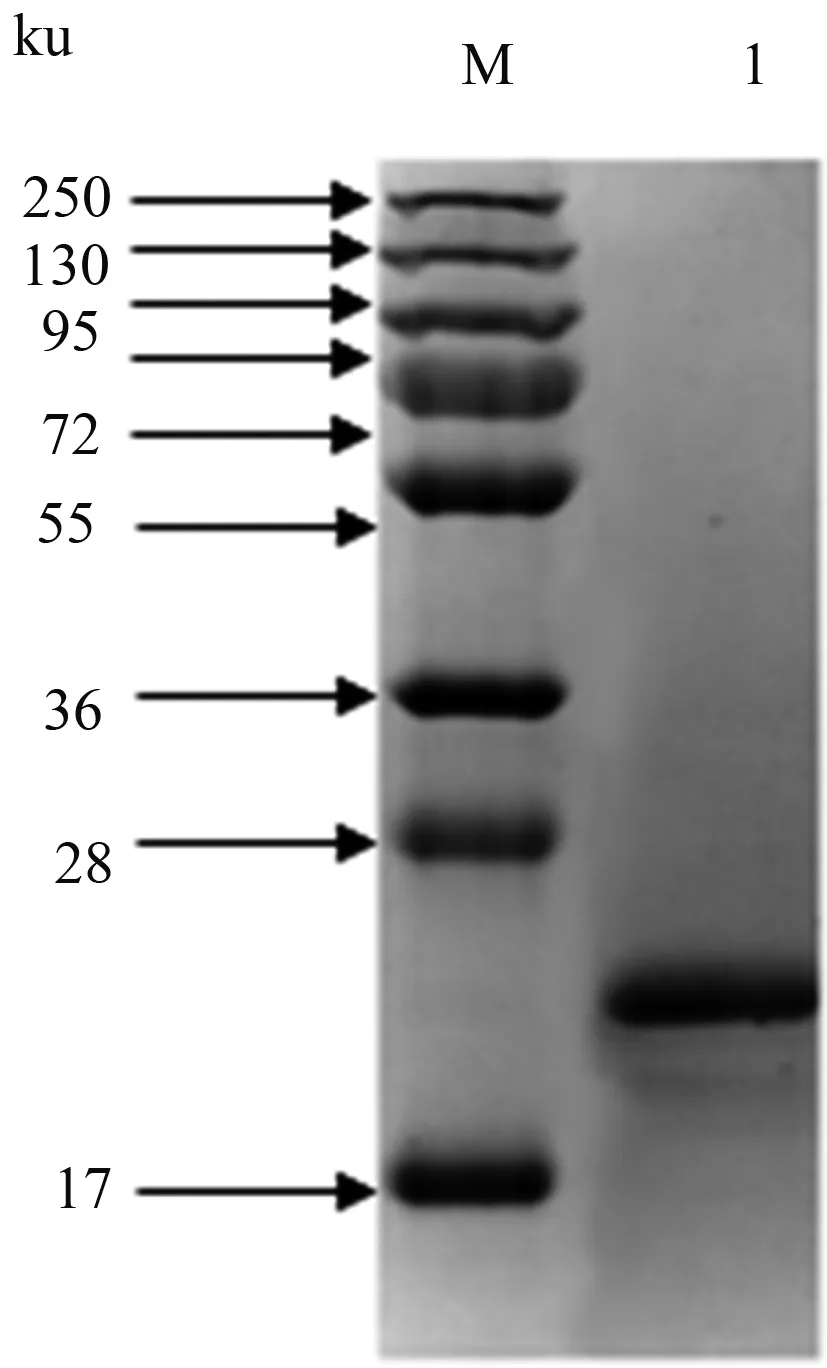
M:预染蛋白质分子质量标准;1:p17重组蛋白
2.6 p17蛋白免疫动物血清ELISA效价测定
采用1.2.2.1中所述免疫方法免疫6只BALB/c小鼠,三免后小鼠血清的ELISA效价最高为1∶2.048×106。
2.7 细胞融合及阳性克隆筛选
细胞融合后9~11 d,用1.2.2.2所述ELISA方法筛选出抗体阳性孔,阳性杂交瘤细胞株经4次筛选和3次亚克隆后,获得16株能够稳定分泌抗体的杂交瘤细胞株,分别命名为6H6、4D1、7E8、7H12、10H6、10F3、6E11、3D1、2F4、2B4、4B3、5F7、7H9、6C4、2F1、4H7,冻存后于液氮中保存。
2.8 ASFV p17单克隆抗体腹水的制备及效价测定
制备16株分泌p17蛋白单克隆抗体的杂交瘤细胞株的小鼠腹水,经间接ELISA方法检测,ELISA效价介于1∶2.560×106~1∶1.024×107。
2.9 ASFV p17单克隆抗体亚类鉴定
对16株ASFV p17单克隆抗体进行亚类鉴定,结果显示,其中有6株单克隆抗体(6H6、4D1、7E8、3D1、2F4、2B4)的重链亚类均为IgG1,其余10株单克隆抗体(7H12、10H6、10F3、6E11、4B3、5F7、7H9、6C4、2F1、4H7)的重链亚类均为IgG2a,所有轻链亚类均为κ。
2.10 ASFV p17单克隆抗体IFA鉴定
用ASFV抗原对筛选出的16株单克隆抗体进行IFA检测,结果显示,有8株单克隆抗体能与ASFV发生特异性反应。6E11与感染ASFV的细胞反应,与正常细胞无反应(图5)。单克隆抗体6H6、4D1、7H12、10H6、10F3、4B3、5F7的IFA鉴定结果均与6E11呈现相同的特点。
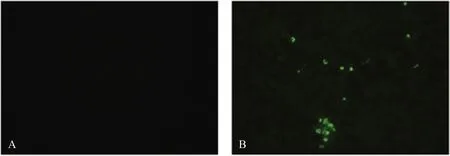
A:阴性对照;B:单克隆抗体6E11与ASFV的IFA检测结果
3 结论与讨论
ASFV编码蛋白的数量众多,其中结构蛋白作为病毒颗粒的主要组分,参与病毒的吸附、进入和复制等感染阶段[15-18]。p17蛋白作为ASFV重要的内囊膜蛋白,是病毒内囊膜上的跨膜蛋白,该蛋白可促进病毒膜前体进一步组装为二十面体中间体,以及增强病毒活力。当p17蛋白表达受阻,将抑制pp220和pp62蛋白的水解[19-24]。研究表明,p17蛋白是重要的抗原蛋白,能够用于ASFV的疫苗研究[9-10]。本研究以真核表达技术成功表达了可溶性的重组蛋白p17,通过Western blot方法检测,p17蛋白与ASFV阳性血清具有反应性,说明表达的p17蛋白具有良好的反应原性。因此,利用重组蛋白p17免疫小鼠共制备了16株针对p17蛋白的单克隆抗体,以p17蛋白为抗原的间接ELISA方法检测,效价均不低于1∶2.560×106。单克隆抗体亚型鉴定结果表明,16株单克隆抗体的重链亚型分别为IgG1、IgG2a,轻链亚型均为κ。IFA鉴定结果显示,有8株单克隆抗体能特异性地识别ASFV。以p17蛋白为抗原的间接ELISA结果表明,制备的单克隆抗体是针对p17蛋白的特异性抗体,且效价较高。
综上,本研究制备的ASFV p17蛋白单克隆抗体具有良好的反应性,可以为ASFV p17蛋白结构与功能等基础研究,以及ASFV免疫类诊断试剂产品的开发提供重要的生物材料。

