不同施氮水平对小麦根际土壤氨氧化微生物的影响
栗笑阳,郭夏丽
(郑州大学 化工学院生态与环境研究所,河南 郑州 450000)
氮素循环是土壤生态系统元素循环之一,包括4个主要过程,均由微生物驱动[1]。其中,硝化作用是连接氧化态和还原态无机氮库的重要环节,在土壤的氮素形态转化过程中起着至关重要的作用[2]。氨氧化作用是硝化作用的限速步骤,主要由氨氧化细菌(AOB)和氨氧化古菌(AOA)驱动[3-4]。AOA和AOB的数量和群落结构受多种环境因子和农业管理措施的影响[5-6]。研究表明,酸性土壤中长期施肥可改变AOA的丰度和群落结构,而在中性或碱性土壤中AOB比AOA更敏感[7]。WU等[8]研究小麦中性土壤发现,长期施肥(22 a)显著改变AOB的群落结构,而AOA则保持不变。在一些恶劣的环境条件下,例如低pH值、低温或高温、高盐度、低氧和低氨含量,土壤AOA可能是氮循环的主要参与者[9]。由于氨氧化作用与氮肥利用率、氮素淋失和N2O排放等问题直接相关[10],为此,作为氨氧化作用的主要承担者,AOA和AOB群落对施肥方式的响应机制一直是农业生态系统研究中的热点问题。
在我国小麦粮食生产中,化肥尤其是氮肥发挥了重要作用。但是随着施用量的不断提高,氮肥对粮食产量的贡献率逐渐降低,同时出现了过量施用带来的一系列农田面源污染问题[11-12]。鉴于此,为进一步了解减施氮肥措施对农田氨氧化微生物的影响,采用Illumina Miseq高通量测序技术,以河南省许昌市小麦季土壤为研究对象,比较小麦不同生长阶段不同施肥水平下小麦根际AOA和AOB群落结构的差异,同时结合土壤理化性质的分析,探讨小麦根际AOA和AOB对减施氮肥方式的响应机制,为科学施肥、维护土壤生物肥力和提高土壤质量提供理论依据。
1 材料和方法
1.1 试验设计与土壤样品采集
试验区位于河南省许昌市建安区苏桥镇石梁河北岸,该区属于大陆性暖温带季风型气候,年平均气温14.6 ℃,年平均降水量728.9 mm,土壤类型为褐土中壤,土壤基本理化性质如表1所示。小麦播种时间为2017年11月5日,施肥水平分别为不施氮肥(CK)、常规施肥N(210 kg/hm2,TN)和减氮施肥30%(氮肥减少30%,N 147 kg/hm2,NR)。本研究在玉米秸杆还田的基础上进行,磷肥施加量均为 127.5 kg/hm2(P2O5),钾肥施加量均为60 kg/hm2(K2O),小区面积为42 m2,每个处理重复3次,试验小区随机排列。
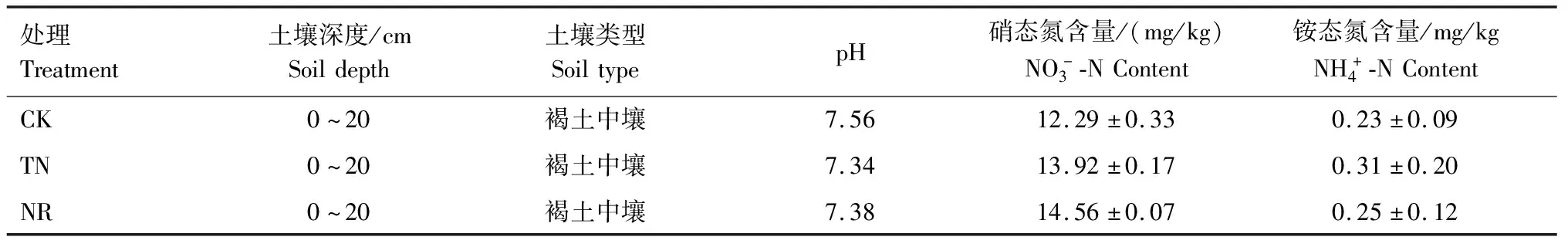
表1 土壤基本理化性质
于2018年3月2日(起身期)、2018年4月22日(拔节期)和2018年5月29日(成熟期)分别采集3个处理的小麦根际土壤。在每个小区对角线5点采样混合为1个土样,每点选取5株。采集时先将小麦根系从土壤中挖出,弃去秸秆等杂质和大颗粒土块,抖掉与根系结合松散的土壤,收集与根系结合紧密的土壤作为根际土壤。将采集土壤及时放置于含有冰袋的泡沫箱中,带回实验室分为两部分,一部分保存于4 ℃,用于测定潜在硝化速率及铵态氮和硝态氮含量。另一部分保存于-80 ℃,用于分析氨氧化微生物的多样性。
1.2 土壤理化指标测定
采用电位法测定土壤的pH值(水∶土=2.5∶1);用含量为2 mol/L的氯化钾溶液浸提鲜土样后,采用分光光度法测定土壤的铵态氮、硝态氮含量[13];潜在硝化速率采用氯酸盐抑制法[14]进行测定。
1.3 土壤微生物多样性测定
根际土样交由上海美吉生物医药科技有限公司进行氨氧化微生物多样性分析。氨氧化细菌amoA基因的引物序列:bamoA1-F:5′-GGGGTTTCTACTGGTGGT-3′和bamoA2-R:5′-CCCCTCKGSAAAGCCTTCTTC-3′[15];氨氧化古菌amoA基因的引物序列:amoA-F:5′-STAATGGTCTGGCTTAGACG-3′和amoA-R:5′-GCGGCCATCCATCTGTATGT-3′[16]。
1.4 数据处理
原始测序序列使用Trimmomatic 软件质控,使用Flash软件进行拼接,使用Uparse软件,根据97%的相似度对序列进行OTU聚类;使用Uchime软件剔除嵌合体。利用RDP classifier对每条序列进行物种分类注释,比对fgr/amoA数据库,设置比对阈值为70%。通过冗余分析(RDA)评估环境变量与AOA和AOB群落的相关性。
采用SPSS 19.0软件对土壤理化性质、AOA和AOB 群落多样性指数(Shannon和Chao)进行多重比较分析(ANOVN LSD,P<0.05)。
2 结果与分析
2.1 小麦根际土壤pH值及无机氮含量的变化
在小麦起身期和拔节期,根际土壤硝态氮含量随着施氮水平增加而逐渐增加。在所有样品中,起身期常规施肥的硝态氮含量最高。在成熟期,减氮施肥处理的硝态氮含量低于常规施肥处理,与不施氮肥处理差异不显著(表2)。减氮施肥处理的铵态氮含量在小麦的起身期和拔节期低于常规施肥和不施氮肥处理,成熟期与不施氮肥处理接近,而高于常规施肥处理。减氮施肥处理的硝态氮含量在起身期和拔节期均低于常规施肥处理且高于不施氮肥处理,而铵态氮含量在起身期和拔节期均低于常规施肥处理和不施氮肥处理,在成熟期3个处理无显著差异。
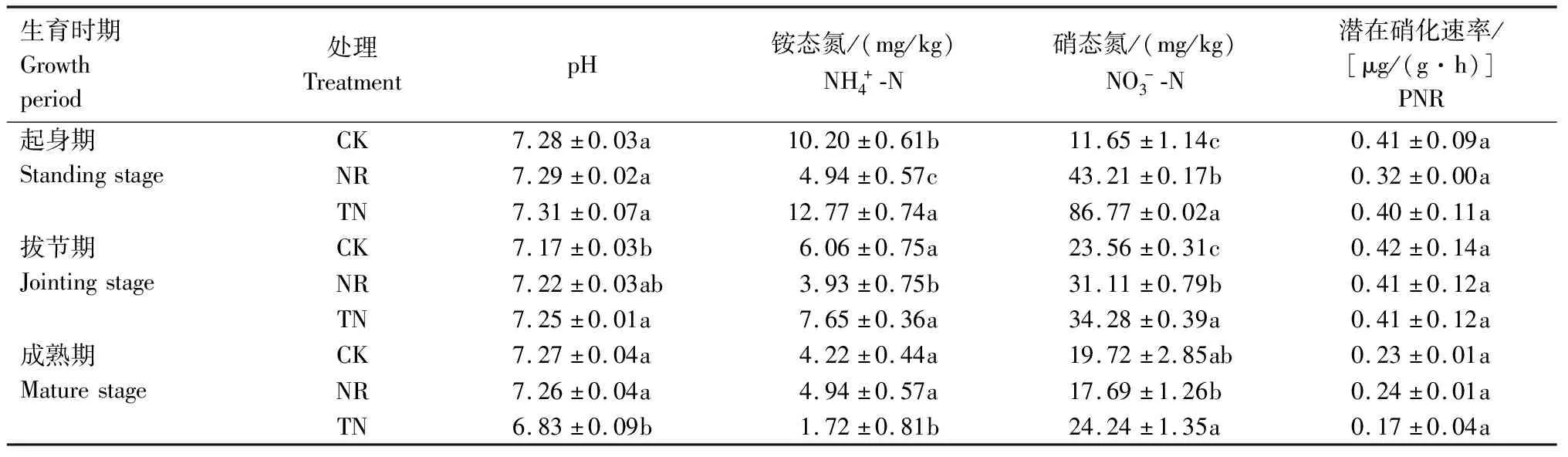
表2 小麦根际土壤pH值及无机氮的变化
2.2 AOA和AOB群落多样性分析
经过最小序列数抽平后,每个土样的AOA OTU数(26 633)高于AOB(20 510),再者,小麦不同生育时期的不同施肥处理的AOA的Chao指数均高于AOB(表3),表明小麦根际土壤中,AOA的数量高于AOB。在小麦起身期,减氮施肥处理的AOA的Chao指数高于其他2个处理,在其他生育时期,不同施肥水平对AOA的Chao指数没有显著影响。同样,不同施肥水平对AOB的Chao指数也没有显著影响。
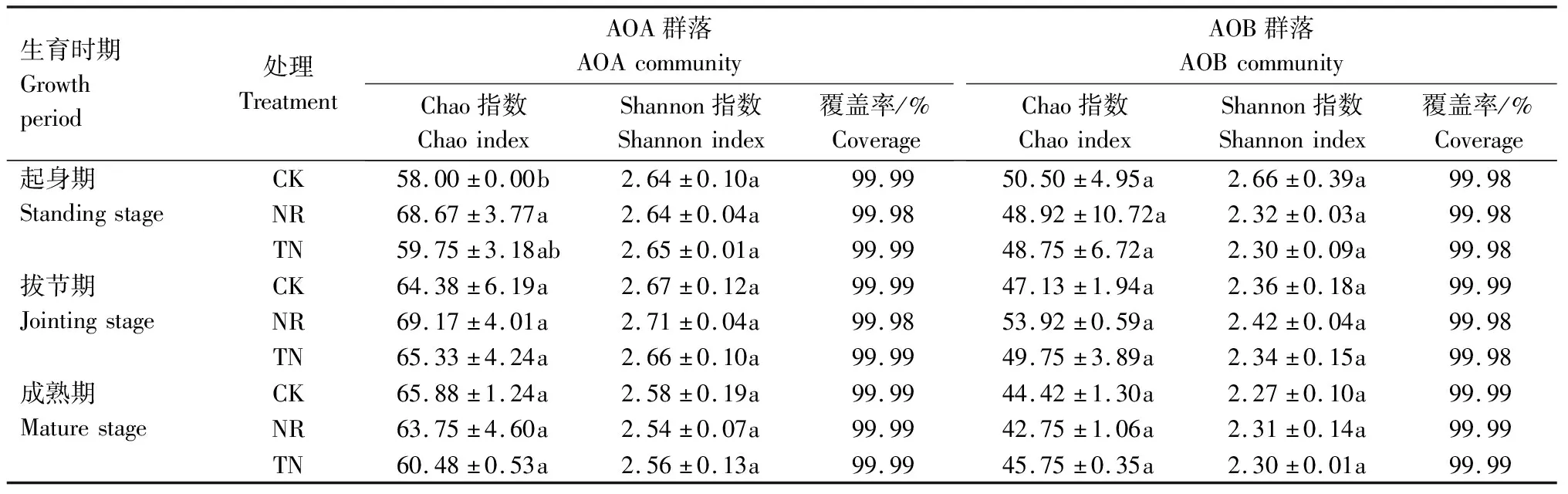
表3 土壤AOB和AOA群落的多样性分析
除了起身期不施氮肥处理的AOB和AOA的Shannon指数类似外,其余处理的AOA Shannon指数均高于AOB。不同施氮量对AOA和AOB的Shannon指数没有显著影响。
2.3 AOA和AOB群落组成分析
土壤样品中所有的AOA OTU归属于4门、5纲、5目、5科、5属。在门水平上,不同处理的未知类群(Unclassified group)占优势,占总OTU的21.17%~23.52%。其次为泉古菌门(Crenarchaeota),占总OTU的8.62%~10.68%。奇古菌门(Thaumarchaeota)数量最低,占总OTU的0.11%~0.12%。在减氮施肥处理中,未知类群的相对丰度和不施氮肥相似,但相对于常规施肥处理有所减少;泉古菌门类群相对丰度在减氮施肥处理中和不施氮肥处理相似,略高于常规施肥处理。奇古菌门类群相对丰度在3个处理变化不大。在属水平,所有处理只检测出1个已知属为亚硝化球菌属(Nitrososphaera)(归属于奇古菌门),其相对丰度为0.07%~0.08%,不同施氮水平对亚硝化球菌属(Nitrososphaera)相对丰度没有显著影响。
所有处理的AOB OTU归属于4门、5纲、6目、8科、12属。在门水平上,变形杆菌门(Proteobacteria)为优势门,占总OTU的17.12%~17.57%。其次为未知类群(Unclassified group),占总OTU的15.53%~16.00%。不同处理对变形杆菌门和未知类群的相对丰度没有显著影响。在属水平,所有处理中检测出的已知属为亚硝化弧菌属(Nitrosovibrio)和亚硝化螺菌属(Nitrosospira)(归属于变形杆菌门),亚硝化螺菌属的相对丰度(2.78%~3.06%)远高于亚硝化弧菌属(0.05%~0.07%)。亚硝化螺菌属的相对丰度在减氮施肥处理中低于常规施肥处理,但差别不明显。亚硝化弧菌属的相对丰度在减氮施肥处理中最高,但差别也不明显。
2.4 在门和属水平上AOA和AOB群落结构的变化
如图1所示,在门水平上,随着小麦生长,各处理AOA的未知类群相对丰度逐渐增加。而泉古菌门和奇古菌门的相对丰度在成熟期处于较低水平。在减氮施肥处理中,Nitrososphaera属的相对丰度随着小麦生长逐渐下降,与不施氮肥处理中Nitrososphaera属变化一致;而常规施肥处理中,Nitrososphaera属的相对丰度在拔节期达到最高。
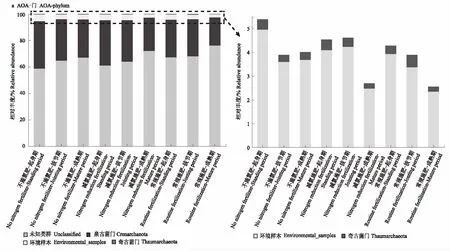
图1 不同生育时期的不同处理AOA(a、b)及AOB(c、d)在门和属上的群落组成
对于AOB,变形菌门的相对丰度在拔节期达到较高水平。而未知类群的相对丰度在拔节期处于最低水平。亚硝化螺菌属的相对丰度随着小麦生长逐渐增大,在小麦成熟期达到最大,在不同的施氮水平下,亚硝化螺菌属的相对丰度无明显的差别。
2.5 AOA和AOB群落结构与土壤理化性质的相关性分析
选择土壤的硝态氮含量、铵态氮含量、pH值和潜在硝化速率为环境变量,通过冗余分析(RDA)评估这些环境变量与AOA和AOB群落的相关性(图2)。对于AOA,第一轴(RDA1)和第二轴(RDA2)分别占环境变量和AOA群落之间总变异的6.70%和4.97%。常规施肥、减氮施肥处理和不施氮肥处理之间有明显的分离,表明常规施肥处理改变了AOA的群落分布。常规施肥处理AOA的OTU分布与土壤pH值、硝态氮含量和铵态氮含量呈正相关,而减氮施肥处理的AOA分布与土壤潜在硝化速率呈正相关。对于AOB,RDA1和RDA2分别占环境变量和AOB群落之间总变异的11.01%和5.52%。成熟期与其他2个生育时期有分离,表明小麦的不同生长阶段对AOB群落分布有一定影响。而土壤潜在硝化速率与成熟期的AOB呈正相关关系。
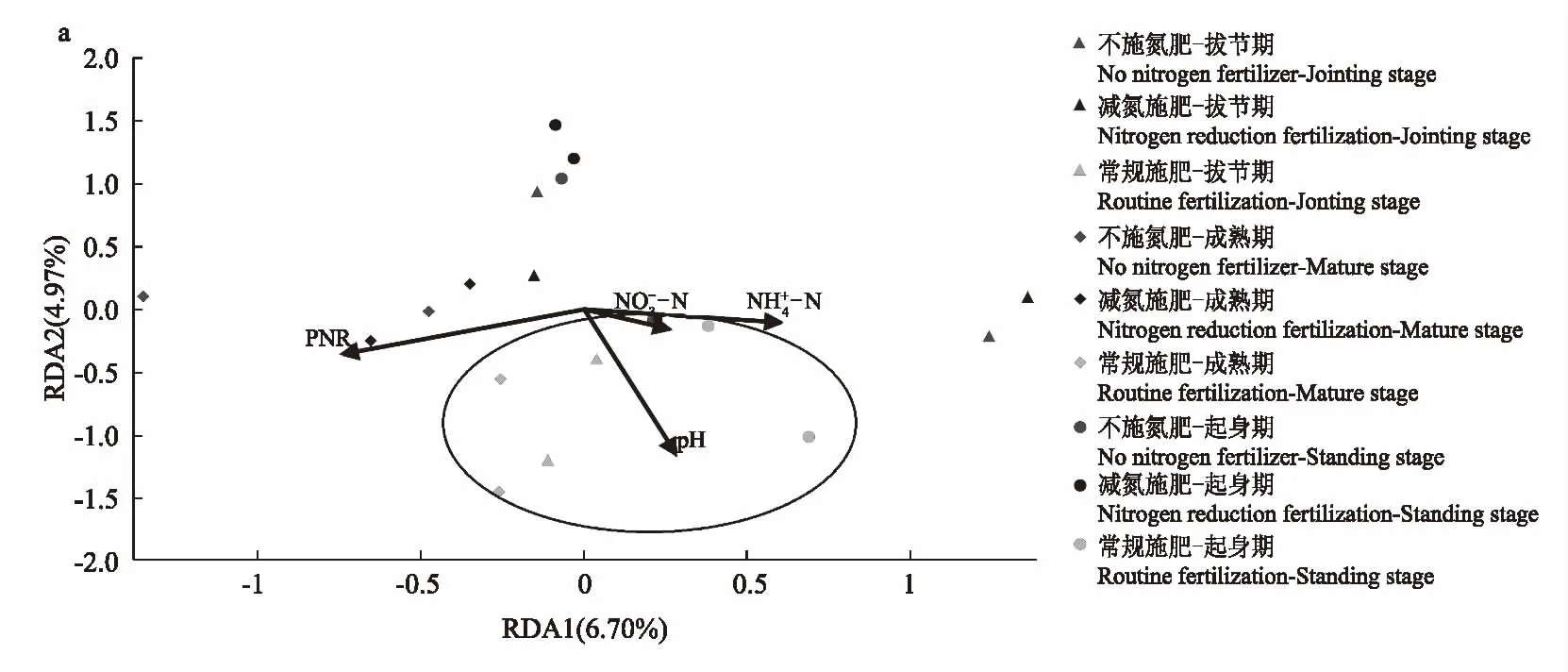
图2 AOA(a)及AOB(b)群落结构与土壤性质的相关性
3 结论与讨论
在不同采样阶段,不同施氮量处理的AOA Chao指数均高于AOB。AOA OTU高于AOB,这与LEININGER等[17]和CHEN等[14]的研究结果一致。不同施氮水平对AOB 的Chao指数没有显著影响。除了减氮施肥处理在小麦起身期AOA的Chao指数高于其他2个处理,其余时期不同施氮水平对AOA的Chao指数也没有显著影响。杨亚东等[18]在研究施氮肥对华北平原土壤AOB和AOA数量及群落结构的影响时发现,与增施氮肥相比,不施氮肥和减施氮肥水平下,AOB数量显著降低,但对AOA数量影响不显著,可能因为是该团队进行了为期6 a的试验,而本研究只进行了小麦一季的试验。另外,杨亚东等[18]试验土壤的碱性(pH>8)强于本试验土壤(pH<7.4)。有研究表明,碱性有助于增强AOB对氮肥的敏感性[19]。为此,试验周期短及土壤碱性不高可能导致AOB对不同施氮水平反应不敏感。各处理AOB的Chao指数在成熟期最低,潜在硝化速率在成熟期也最低,两者趋势相同,由此推测AOB可能主导着小麦土壤根际氨氧化作用。
在小麦不同生长阶段,不同施氮水平对AOB的优势门—变形菌门的相对丰度没有明显影响。在拔节期,变形菌门相对丰度较高于其他采样阶段。在属水平上,亚硝化螺菌属相对丰度为亚硝化弧菌属的30倍以上。亚硝化螺菌属在起身期和拔节期,相对丰度的变化趋势与潜在硝化速率相似,在成熟期,两者变化趋势相反,可能受较低铵态氮含量限制导致潜在硝化速率降低,硝化速率通常受底物利用率的限制,这与BOOTH等[20]研究结果相似。而亚硝化螺菌属相对丰度及硝化速率的降低,也表明亚硝化螺菌属在小麦根际硝化作用中起着重要作用。
在门水平上,AOA的优势类群为未知类群,减氮施肥处理中未知类群的相对丰度与不施氮肥处理无明显差别,而低于常规施肥处理,未知类群的相对丰度随着小麦生长和施氮水平的增加而增加,在成熟期时各处理相对丰度达到最大,与潜在硝化速率变化趋势不同。氨氧化作用中主要的微生物一直被认为是AOB,但有研究发现AOA中泉古菌门和奇古菌门也是氨氧化过程的重要参与者[21]。由微生物群落组成分析可知,泉古菌门与奇古菌门在成熟期相对丰度最低,与潜在硝化速率变化趋势相似,可推测AOA的泉古菌门与奇古菌门参与了氨的氧化。
综上所述,减氮施肥处理的硝态氮含量在起身期和拔节期均低于常规施肥处理且高于不施氮肥处理,而铵态氮含量在起身期和拔节期均低于常规施肥处理和不施氮肥处理,但并没有明显降低潜在硝化速率。小麦根际中AOA的Chao指数显著高于AOB,表明AOA大量存在于农田中,而且AOA也参与了小麦根际的氨氧化作用。冗余分析表明,AOB在氨氧化作用中可能起主导作用。在整个小麦生长过程中,与常规施肥处理相比,减氮施肥处理没有对根际土壤中氨氧化微生物的群落组成和丰度产生显著的削弱影响。

