COPD性高血压患者肾素-血管紧张素-醛固酮水平的临床研究
任芳 郝同琴 牛丽丹 张江波
慢性阻塞性肺病(chronic obstructive pulmonary diseases,COPD)是临床常见且多发的呼吸系统疾病,主要以持续的气流受限为主要特征,并伴随广泛肺外效应,是一种具有较高复发率和致死率的气道受阻且不完全可逆的肺部异常性炎症疾病[1]。COPD 患者由于肺通气功能障碍、肺血管内皮功能障碍、呼吸系统炎症反应等多种因素,可导致伴发高血压疾病,表现为血压升高、心功能障碍、头晕、恶心等[2]。COPD 性高血压在临床上比较少见,多发于老年人群,伴发高血压后无疑增加了COPD 疾病治疗的难度,还容易引起心脑血管疾病、慢性肾衰竭等严重并发症的发生,严重影响患者的身体健康和生活质量[3]。肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)是由一系列激素及相应的酶组成,能通过控制血容量和外周阻力对人体血压、水和电解质平衡进行调节,并维持机体内环境的恒定[4-5],其水平与高血压的发生具有紧密的联系。目前国内关于COPD 性高血压患者肾素-血管紧张素-醛固酮水平的研究鲜有见报道,基于此,本研究对COPD 性高血压患者的肾素-血管紧张素-醛固酮水平水平进行检测,尝试探讨其与高血压之间的相关性,以期为临床诊断提供一些理论参考,现报告如下。
1 资料与方法
1.1 临床资料
选取2018年3月至2019年9月期间于本院收治的COPD 性高血压患者80 例作为研究对象,作为研究组,其中男性39 例,女性41 例,平均年龄(65.93±6.44)岁;COPD 病情为轻度20 例,中度35例,重度25 例;急性加重期24 例,稳定期56 例。同时收集本院的COPD 未伴发高血压患者80 例,其中男性42 例,女性38 例,平均年龄(66.49±5.93)岁;COPD 病情为轻度23 例,中度31 例,重度26 例;急性加重期29 例,稳定期51 例;以及在本院进行健康体检的人群35 例作为对照,男性16 例,女性19 例,平均年龄(65.70±6.52)岁。三组性别、年龄等比较差异无统计学意义(P>0.05),具有可比性。
纳入标准:①患者均具有咳嗽、咳痰、呼吸困难等症状,经实验室检查、影像学检查,符合COPD的诊断标准[6];②符合2005年我国高血压的诊断标准[7]:收缩压≥140 mmHg(1 mmHg=0.133 kpa),舒张压≥90 mmHg;③年龄35 岁以上,且病历资料完整、具备血浆检测标本者。排除标准:①精神异常、沟通障碍患者;②存在严重性肝肾疾病、恶性肿瘤、严重出血性疾病患者;③内分泌性高血压、继发性高血压、颅内并所致高血压患者;④妊娠及哺乳期妇女;⑤近两周内未服用血管紧张素转换酶抑制剂等影响。本研究通过医学伦理委员会审批,所有患者均签署知情同意书。
1.2 方法
1.2.1 一般资料收集
现场测量患者的体重、身高、COPD 病程、收缩压、舒张压,是否发生脑卒中以及合并冠心病、糖尿病、高脂血症情况等一般资料,记录患者。
1.2.2 血浆肾素、血管紧张素Ⅱ、醛固酮水平检测
分别于清晨卧位采集三组肘静脉血5 mL,经冰水浴中冷却、2 500 r/min 离心后,分离血浆,放入-20℃冻存待测。采用放射免疫法对三组患者的肾素活性(plasma renin activity,PRA)、血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)、血醛固酮(aldosterone,ALD)进行测定,试剂盒均购自北京北方生物技术研究所,并严格按试剂盒操作方法进行实验操作。普通饮食,卧位的PRA 参考值为0.07~1.51 ng/mL/h,AngⅡ参考值为19~115 pg/mL,ALD的参考值为60~174 pg/mL。
1.3 统计学处理
采用SPSS 22.0 软件进行数据分析,计数资料用n(%)表示,采用χ2检验;计量资料采用(±s)表示,两组间采用独立样本t检验,多组间采用方差分析,多组数据的组间比较采用LSD-t 检验进行多重比较;PRA、AngⅡ、ALD 之间的相关性分析采用Pearson进行相关分析,多因素影响分析采用多元线性回归分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 3 组患者一般情况比较
3 组在体重、身高方面的差异无统计学意义(P>0.05),研究组和COPD 组患者在COPD病程、合并糖尿病方面的差异无统计学意义(P>0.05),COPD 组和健康组在收缩压和舒张压方面比较差异无统计学意义(P>0.05)。研究组的收缩压、舒张压、脑卒中发生率、合并冠心病和高脂血症的占比均明显高于COPD 组和健康组,差异均有统计学意义(P<0.05),见表1。
表1 3 组患者一般资料比较[n(%),(±s)]Table 1 Comparison of general data among the three groups[n(%),(±s)]
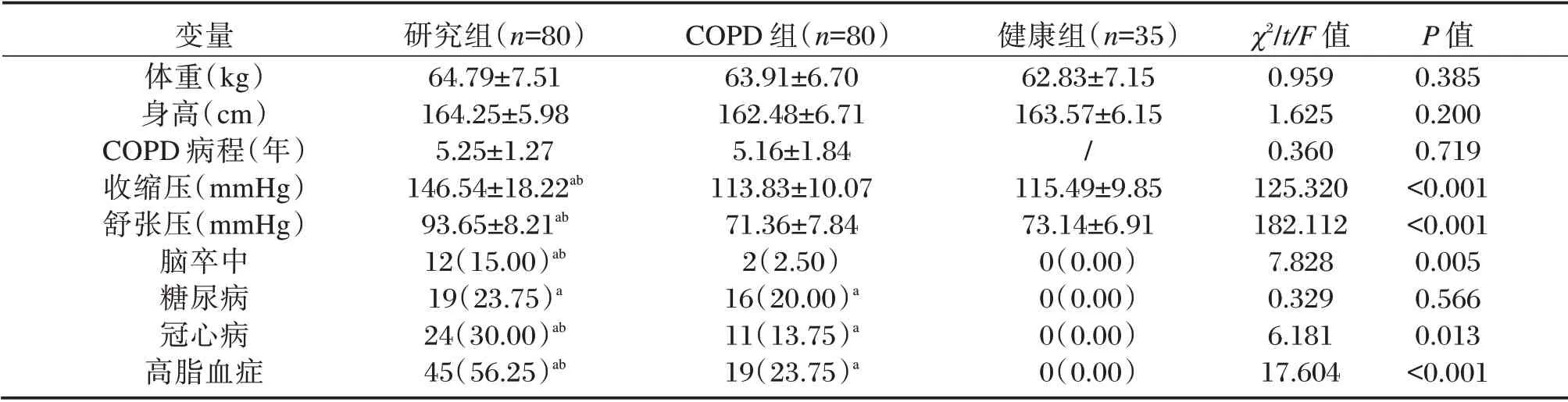
表1 3 组患者一般资料比较[n(%),(±s)]Table 1 Comparison of general data among the three groups[n(%),(±s)]
注:与健康组比较,aP<0.05;与COPD 组比较,bP<0.05。
变量体重(kg)身高(cm)COPD 病程(年)收缩压(mmHg)舒张压(mmHg)脑卒中糖尿病冠心病高脂血症研究组(n=80)64.79±7.51 164.25±5.98 5.25±1.27 146.54±18.22ab 93.65±8.21ab 12(15.00)ab 19(23.75)a 24(30.00)ab 45(56.25)ab COPD 组(n=80)63.91±6.70 162.48±6.71 5.16±1.84 113.83±10.07 71.36±7.84 2(2.50)16(20.00)a 11(13.75)a 19(23.75)a健康组(n=35)62.83±7.15 163.57±6.15/115.49±9.85 73.14±6.91 0(0.00)0(0.00)0(0.00)0(0.00)χ2/t/F 值0.959 1.625 0.360 125.320 182.112 7.828 0.329 6.181 17.604 P 值0.385 0.200 0.719<0.001<0.001 0.005 0.566 0.013<0.001
2.2 3 组患者PRA、AngⅡ和ALD 水平比较
研究组PRA、AngⅡ和ALD 水平均明显高于COPD 组和健康组,差异有统计学意义(P<0.05),3 组PRA、AngⅡ和ALD 水平比较,差异有统计学意义(P<0.05),见表2。
2.3 研究组中不同COPD 患者血压情况与PRA、AngⅡ和ALD 水平比较
研究组中不同病情COPD 患者血压、RAAS 系统水平比较差异有统计学意义(P<0.05);其中重度组收缩压、舒张压、PRA、AngⅡ和ALD 水平均明显高于轻度组和中度组,差异有统计学意义(P<0.05),COPD 急性加重期患者血压、RAAS 系统水平明显高于稳定期患者(P<0.05)。见表3、表4。
2.4 PRA、AngⅡ和ALD 水平与高血压之间的关系
相关性分析结果显示,血浆PRA、AngⅡ和ALD 水平分别与收缩压、舒张压、呈正相关性,差异有统计学意义(P<0.05);且三指标水平之间互为正相关关系,差异有统计学意义(P<0.05),见表5。
表2 3 组患者PRA、AngⅡ和ALD 水平比较(±s)Table 2 Comparison of PRA,AngⅡand ALD levels among the three groups(±s)

表2 3 组患者PRA、AngⅡ和ALD 水平比较(±s)Table 2 Comparison of PRA,AngⅡand ALD levels among the three groups(±s)
注:与健康组比较,aP<0.05;与COPD 组比较,bP<0.05。
组别研究组COPD 组健康组F 值P 值n 80 80 35 PRA(ng/mL/h)4.16±1.46ab 1.67±0.39a 0.55±0.06 217.290<0.001 AngⅡ(pg/mL)128.37±20.31ab 113.81±18.45a 51.61±10.12 224.313<0.001 ALD(pg/mL)214.41±23.08ab 183.59±22.15a 68.29±12.45 589.350<0.001
3 讨论
高血压是一种常见的慢性疾病,据调查显示,我国高血压的患病人数易超过2 亿人,其发病率在我国呈现为逐年增加的趋势[8]。高血压的发生与生活方式、饮食等因素明显相关,患者可表现为头晕、头痛、血压升高等症状,若不能得到较好的控制,极易引发心脑血管疾病的发生以及脑卒中等并发症,不利于患者的身体健康[9]。COPD 亦是一种多发的慢性疾病,具有较高的病死率,且发病后极易伴发各种并发症。研究表明,RAAS 系统的激活是COPD 患者伴发高血压的发病原因之一,患者血浆AngⅡ水平升高还是各种心血管疾病的独立危险因素[10]。本研究探讨COPD 性高血压患者的RAAS 系统水平,及其与高血压的相关性,对于进一步探讨RAAS 系统水平与COPD 性高血压发病机制与疾病发生发展的关系具有重要的指导意义。
表3 研究组中不同病情程度COPD 患者的血压及PRA、AngⅡ和ALD 水平比较(±s)Table 3 Comparison of blood pressure,PRA,AngⅡand ALD levels among COPD patients with different severity in study group(±s)
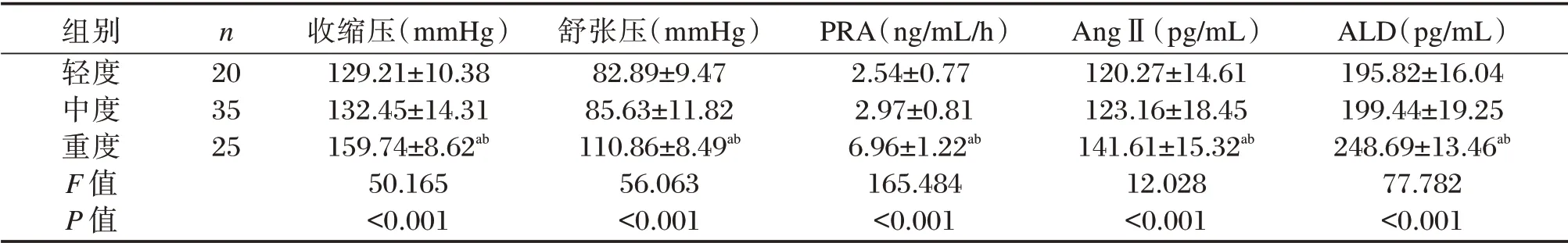
表3 研究组中不同病情程度COPD 患者的血压及PRA、AngⅡ和ALD 水平比较(±s)Table 3 Comparison of blood pressure,PRA,AngⅡand ALD levels among COPD patients with different severity in study group(±s)
注:与轻度组比较,aP<0.05;与中度组比较,bP<0.05。
组别轻度中度重度F 值P 值n 20 35 25收缩压(mmHg)129.21±10.38 132.45±14.31 159.74±8.62ab 50.165<0.001舒张压(mmHg)82.89±9.47 85.63±11.82 110.86±8.49ab 56.063<0.001 PRA(ng/mL/h)2.54±0.77 2.97±0.81 6.96±1.22ab 165.484<0.001 AngⅡ(pg/mL)120.27±14.61 123.16±18.45 141.61±15.32ab 12.028<0.001 ALD(pg/mL)195.82±16.04 199.44±19.25 248.69±13.46ab 77.782<0.001
表4 研究组中不同时期COPD 患者患者的血压及PRA、AngⅡ和ALD 水平比较Table 4 Comparison of blood pressure,PRA,AngⅡand ALD levels among COPD patients during different periods in study group(±s)
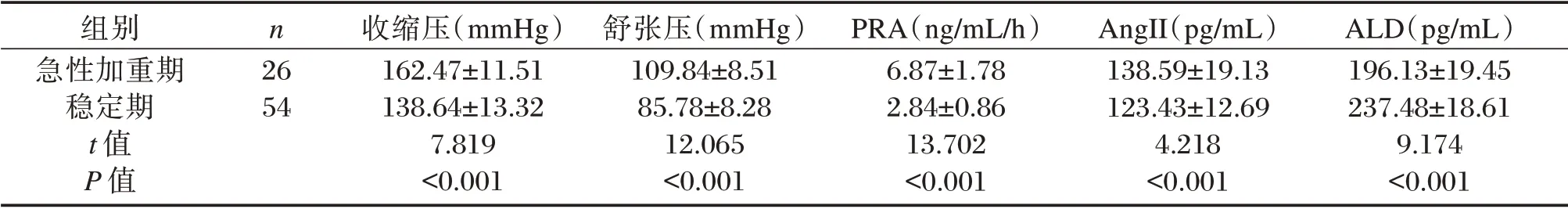
表4 研究组中不同时期COPD 患者患者的血压及PRA、AngⅡ和ALD 水平比较Table 4 Comparison of blood pressure,PRA,AngⅡand ALD levels among COPD patients during different periods in study group(±s)
组别急性加重期稳定期t 值P 值n 26 54收缩压(mmHg)162.47±11.51 138.64±13.32 7.819<0.001舒张压(mmHg)109.84±8.51 85.78±8.28 12.065<0.001 PRA(ng/mL/h)6.87±1.78 2.84±0.86 13.702<0.001 AngII(pg/mL)138.59±19.13 123.43±12.69 4.218<0.001 ALD(pg/mL)196.13±19.45 237.48±18.61 9.174<0.001

表5 PRA、AngⅡ和ALD 水平与收缩压、舒张压之间的相关性Table 5 Correlation between PRA,AngⅡ,ALD levels and systolic blood pressure,diastolic blood pressure
本研究结果与国内学者蒋灵霓等[11]的研究结果较为一致。有学者在研究报告中指出,在COPD前期,即慢性支气管炎阶段患者出现肺通气功能障碍时,其血浆PRA 和AngⅡ水平处于高水平,特别是AngⅡ水平升高最为显著[12]。AngⅡ能通过直接收缩小动脉使血压升高,并能通过参与血管壁的氧化应激、炎症反应等过程,引起血管内皮功能障碍,减少血管扩张因子的生成,引起肺血管过度收缩,导致血管重构和高血压的形成[13]。高血压发生后,由于血管长期处于高压状态,可导致心脏、肾脏、脑等重要部位发生病理异常,引发冠心病等心脑血管疾病,这可能是本研究的研究组患者合并冠心病、高脂血症比例较高的主要原因。大量研究证实,RAAS 能在生理条件下发挥重要的正常血压调节作用,当机体受到病理因素影响后,能够增加RAAS 活性,进而引发高血压[14]。RAAS系统对机体血管功能、血压、水盐代谢的调节发挥着重要作用,直接参与高血压的发病机制。研究表明,COPD 患者与原发性高血压和心血管疾病的发生有关,COPD 患者的肺功能越差,患者伴发高血压的几率越高[15]。国外研究指出,COPD 患者中有50%以上的患者可伴发高血压,其高血压的伴发率明显高于同龄健康人群[16]。COPD 患者发病后,其RAAS 系统被激活,球旁细胞释放大量PRA,引起AngⅡ活性增高,全身小动脉管壁收缩产生高血压。由此可见COPD 患者RAAS 系统水平与高血压发生的明显相关性,同时,可以看出PRA、AngⅡ和ALD 三者之间存在互相的促进作用,存在明显正相关关系。COPD 性高血压患者血浆PRA、AngⅡ和ALD 水平不仅与高血压的关系密切,还可能成为COPD 性高血压发生发展过程中的重要标志物,对于早期发现和预防COPD 性高血压具有一定的指导作用。
综上所述,COPD 性高血压患者体内存在RAAS 过度激活,表现为RAAS 系统处于较高水平,并与患者血压存在明显正相关性,RAAS 水平的检测对于COPD 性高血压的发生和发展及患者病情的评估具有一定的指导价值。

