西藏巴松错浮游植物功能群垂直分布特征及其与环境因子的关系*
安瑞志,潘成梅,塔巴拉珍,杨欣兰,巴 桑
(1:西藏大学理学院青藏高原湿地与流域生态实验室,拉萨 850000) (2:西藏自治区昌都市卡若区约巴乡乃通村教学点,昌都 854000) (3:西藏农牧科学院水产科学研究所,拉萨 850032)
浮游植物作为湖泊生态系统中初级生产者的重要组成部分和生态指示性类群,其生物量、物种组成、优势种以及多样性能直接反映湖泊水质的状况[1]. 但常规传统的系统分类学难以体现浮游植物在湖泊生态系统中的生态特征和生境类型,国内外学者便将具有相同或相近的生态位的优势种组合定义为功能群,以生理生长特征和生态适应性为基础,把生理、形态和生存策略相似或相同的浮游植物归为一个功能群,作为浮游植物对生境变化的响应的基本单元[2]. Reynolds等[3]第一次划分出31个浮游植物功能群,Padisák等[4]基于此修正,至今共鉴定划分了39个功能群. 迄今国内外研究功能群在湖泊浮游植物生态学方面应用的报道日益增多[5-7]. 然而有关青藏高原湖泊浮游植物功能群方面的相关研究鲜有报道.
青藏高原湖泊分布众多而密集,其面积约为5×104km2,占全球湖泊总面积的1.9%,在维持“亚洲水塔”区域水平衡和水循环中起着重要作用[8]. 西藏受人类活动干扰较小,大部分湖泊生态系统保持着相对原始的自然状态,对气候变化十分敏感,逐步成为研究生物起源、进化、区系和迁徙的理想选择,得到国内外研究学者的广泛关注[9-12]. 巴松错属雅鲁藏布江支流尼洋河水系,在维持该区域生态平衡、调节气候、保持生物多样性和提高居民生产、生活等方面起着重要作用. 至今有关巴松错的生物学研究主要集中在浮游动物和真菌等方面[13-14],有关浮游植物的研究相对较少[15].
为了解青藏高原湖泊浮游植物功能群垂直分布特征与环境因子的关系,本文选取西藏东南部最大的高山冰川堰塞湖之一——巴松错为研究对象,于2017年11月(枯水期)和2018年9月(丰水期)在巴松错进行了定性和定量样品采集,共采集水样84个,利用功能群的方法对巴松错浮游植物进行划分,对该湖泊浮游植物功能群与水环境的相关性进行了研究,旨在探索巴松错浮游植物群落与环境因子的变化规律,为研究巴松错生态系统和管理提供基础资料.
1 材料与方法
1.1 样区概况和样点设置
巴松错位于尼洋河最大支流巴河的宽谷中,是西藏东南部最大的高山冰川堰塞湖之一,湖面海拔3469 m,最大湖深约为120 m,湖泊面积25.9 km2,流域面积1290 km2,年均入湖流量17×108m3[16],蓄水量3.5×108m3[17]. 湖泊所在区域属于典型的高原温带半湿润季风气候,年均降水量646 mm,主要集中在4-10月,年平均气温6.3℃,年无霜期175 d,年日照时数为2016 h[18]. 根据以上资料可以得出,巴松错属于深水湖泊. 相较于浅水湖泊,深水湖泊容易受到季节变化影响而形成稳定的水温分层现象[19]. 基于此,本研究在巴松错湖心区M(30°01′06.04″N,93°55′39.95″E),采用传统挂锤式测得最大水深为108 m,采样时间为2017年11月(枯水期)和2018年9 月(丰水期),依次按水深0.5 m(M1)、2.5 m(M2)、5 m(M3)、15m(M4)、30 m(M5)、60 m(M6)和100 m(M7)共7个分层(图1)进行垂直分层采样.
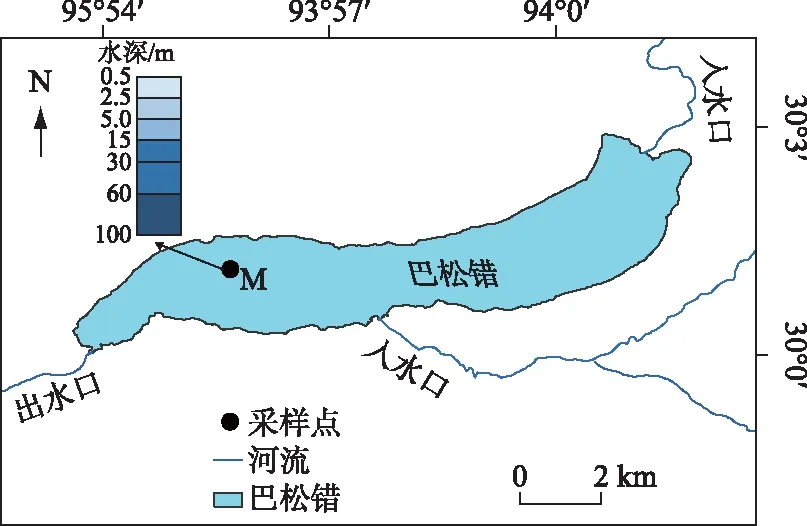
图1 巴松错采样点位置Fig.1 Location of sampling sites in Lake Basomtso
1.2 水样采集、处理及鉴定方法
采用挂锤式深水采样器进行分层采集水样,分别将有机玻璃采水器与卡盖式采水器(QCC15)置于相应水深,静置5~10 min后,采得水样,并设置3个平行;浮游植物的定性和定量样品采集均按照上述方法进行,其中1 L水样用于定性分析,观察活体;1 L水样用于定量样品,现场立即用鲁哥氏碘液固定,静置沉淀48 h后,用虹吸法定容至30 mL,充分摇匀后吸取0.1 mL浓缩匀液于0.1 mL计数框内镜检计数[20]. 在OLYMPUS CX41显微镜下进行物种鉴定,藻类鉴定参考经典文献[21-24]. 浮游植物生物量利用合适的体积公式将浮游植物丰度转化为生物量(鲜重),并假设其比重为1.0,即生物量为浮游植物的丰度乘以各自体积的平均湿重[25-27].
现场采用赛氏盘测量水体透明度(SD),用PCSTestr35防水型多参数笔试测试仪(EUTECH,美国)现场测定水体pH、水温(WT)、电导率(EC)、盐度(Salt)及总溶解盐(TDS)浓度;用HI98193微电脑溶解氧测定仪(HANNA,意大利)测定溶解氧(DO)浓度;用HI98703微电脑多量程浊度测定仪(HANNA,意大利)测得浊度(TUR)等,并进行3次平行检测取其平均值;严格按照国家《地表水环境质量标准》(GB3838-2002)对水样进行采集、保存与运输,送有检测资质公司对水体总磷(TP)、总氮(TN)、氨氮(NH3-N)、五日生物需氧量(BOD5)和重铬酸盐指数(CODCr)等指标进行测定.
1.3 计算
水体相对稳定性(RWCS)是评价水体混合程度及分层状态的参数. 水体稳定性越大,越易发生分层;水体稳定性越小,越易发生混合. 对于分层型湖库, 通过比较底层 (Dh) 和表层 (Ds) 水的密度差异和水体在4℃ (D4) 和5℃ (D5) 时的密度差异,根据Padisák等[28]的公式计算RWCS,为更详细、精确地计算湖库的水体相对稳定性,对公式进行改进,计算公式为:
(1)
(2)
(3)
式中,Dhi和Dsi分别为第im底层温度和表层温度下的水体密度,D4和D5分别代表4和5℃下的水体密度,RWCSi为第im水体稳定性.
水体密度通过Krambeck方程进行计算[29]:
ρ=0.999869+6.67413×10-5WT-8.85556×10-6WT2+8.23031×10-8WT3-5.51577×10-10WT4
(4)
式中,WT表示水温.
本文中以≥0.1℃/m的温度梯度为温跃层深度[30],以透明度的2.7倍所对应的深度作为真光层深度(Zeu)[31],以表层水温改变 ≥0.5℃时所对应的深度作为混合层深度(Zmix)[32],可采用温度曲线进行估计,并以此为温跃层的上界深度,真光层与混合层的比率(Zeu/Zmix) 则作为水体光的可利用性评判标准[33].
为了避免单一多样性指数造成结果偏差,利用Gleason-Margalef丰富度指数(Dm)[34]、Shannon-Wiener多样性指数(H′)[35]和Simpson优势度指数(Ds)[36]这3 个指数来计算巴松错浮游植物的生物多样性. 计算公式为:
(5)
(6)
(7)
式中,S为采样点的物种数;N为采样点所有浮游植物的细胞丰度;Pi为第i种个体所占的比例.
Q指数由Padisák公式确定[4]:
(8)
式中,S为浮游植物功能群的数量,Pi为第i功能群生物量占总生物量的比例,Fi为第i个功能群的赋值.Q指数为0~5时分别表示:0~1差;1~2耐受;2~3中等;3~4好;4~5极好.
1.4 数据处理与分析
采用Excel 2016和OriginPro 2019 软件进行数据分析、统计和绘图,采用ArcGIS软件绘制地图. 用R ×64 3.6.2进行多响应置换过程(multi response permutation procedure, MRPP). 对巴松错浮游植物功能群进行筛选(该功能群的相对生物量至少在一个采样点大于10%,即表明为优势功能群),将优势功能群生物量和环境因子数据均进行lg (x+1)转换. 优势功能群生物量与环境因子用SPSS 26.0软件进行相关性分析,并结合散点图预测对优势功能群生物量在某一环境因子的分布范围进行预测;使用 CANOCO 5.0软件对优势功能群生物量作去趋势对应分析(DCA),排序轴长度为0.8,故采用冗余分析(RDA).
2 结果与分析
2.1 巴松错水体理化因子垂直分布
现场测得巴松错枯水期和丰水期水体透明度均为0.85 m. 巴松错枯水期RWCS为22.13,丰水期RWCS为53.26,表明巴松错水体稳定性强,易发生分层. 枯水期和丰水期Zeu均为2.295 m,枯水期Zmix为23.81 m,Zeu/Zmix为0.10,比值较小,混合深度较高,光的可利用性较好;丰水期Zmix为0.89 m,Zeu/Zmix为2.58,比值较大,混合深度较低,光的可利用性较差.
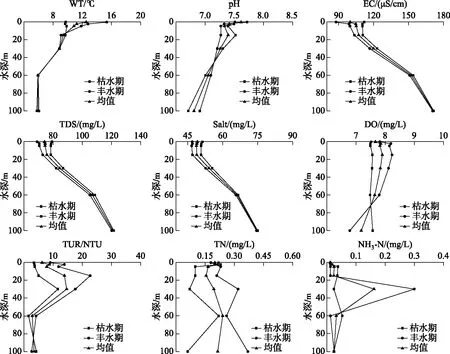
图2 巴松错水体理化因子垂直变化Fig.2 Vertical variation of physical and chemical factors in Lake Basomtso
巴松错水体理化因子垂直变化结果如图2所示. 枯水期水温在水深约30~60 m处呈跃变趋势,从8.9℃降至5.93℃,水温变化梯度为0.1℃/m,形成温跃层,是传统“混合层-温跃层-等温层”单循环分层模式,为典型的3层结构型;丰水期水温在水深约1~15 m和30~60 m处呈跃变趋势,分别从14.73℃降至9.1℃、8.87℃ 降至5.97℃,水温变化梯度分别为0.4和0.1℃/m,形成两个温跃层,这与传统的“混合层-温跃层-等温层”单循环分层模式有所不同,呈现“混合层-温跃层-变温层-温跃层-等温层”双循环分层模式,为典型的主温跃层上位型[37].
巴松错属于弱碱性湖泊,pH范围为6.71~7.72,呈现从枯水期到丰水期逐步上升的趋势. EC范围为87.93~171.63 μS/cm,平均值为122.98 μS/cm, TDS浓度变化范围为69.10~121.67 mg/L,平均值为87.38 mg/L,盐度变化范围为47.03~75.00 mg/L,平均值为55.86 mg/L,EC、TDS和盐度的变化趋于一致,并呈现从枯水期到丰水期逐步下降的趋势;DO平均质量浓度是7.70 mg/L,最小值为6.79 mg/L,最大值为8.24 mg/L,变化幅度较小;TUR、TN、NH3-N浓度呈波浪形分布特点,其中NH3-N浓度在多数样点为下限值. 水体理化因子在温跃层或温跃层附近变化显著,表明巴松错水体呈现出明显的垂直分布特征(图2).
2.2 巴松错浮游植物群落组成
2.2.1 物种组成及群落结构 在巴松错7个全水深样点中共鉴定出浮游植物242种,隶属于7门9纲19目36科76属,其中硅藻门25属120种,占49.59%,为该湖泊最主要的类群;蓝藻门14属57种,占23.55%;绿藻门26属51种,占21.07%;黄藻门5属5种,占2.07%;裸藻门3属4种,占1.65%;金藻门1属3种,占1.24%;甲藻门2属2种,占0.83%. 巴松错枯水期和丰水期浮游植物种类均以硅藻门、蓝藻门和绿藻门为主,黄藻门、裸藻门和金藻门种类较少,甲藻门种类只在丰水期出现. MRPP结果表明,浮游植物群落结构在枯水期和丰水期具有显著的时空差异(P<0.05),垂直样点浮游植物群落结构的空间异质性差异不显著(P>0.05).
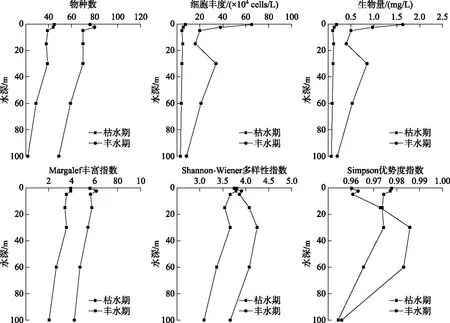
图3 巴松错枯水期和丰水期浮游植物群落参数的垂直变化Fig.3 Vertical variation of phytoplankton community parameters in Lake Basomtso during dry and wet seasons
巴松错枯水期和丰水期浮游植物群落参数的垂直变化结果如图3所示. 枯水期,巴松错各垂直样点浮游植物物种数平均值为36.57,范围为22~45;细胞丰度平均值为4.82×104cells/L,范围为3.1×104~7.4×104cells/L;生物量平均值为0.12 mg/L,范围为0.08~0.19 mg/L;Margalef丰富度指数Dm在2.03~3.93之间,均值为3.3;Shannon-Wiener多样性指数H′在3.09~3.81之间,均值为3.56;Simpson优势度指数Ds的范围为0.95~0.98,均值为0.97. 丰水期,巴松错各垂直样点浮游植物物种数平均值为67.71,范围为49~80;细胞丰度平均值为28.9×104cells/L,范围为8.3×104~65×104cells/L;生物量平均值为0.83 mg/L,范围为0.20~1.63 mg/L;Margalef丰富度指数Dm在4.24~6.15之间,均值为5.36;Shannon-Wiener多样性指数H′在3.66~4.25之间,均值为3.94;Simpson优势度指数Ds在0.96~0.99之间,均值为0.97. 由图4可见,在枯水期和丰水期,巴松错浮游植物物种数、细胞丰度、生物量、Margalef丰富度指数和Shannon-Wiener多样性指数差异显著(P<0.05),Simpson优势度指数差异不显著(P>0.05).
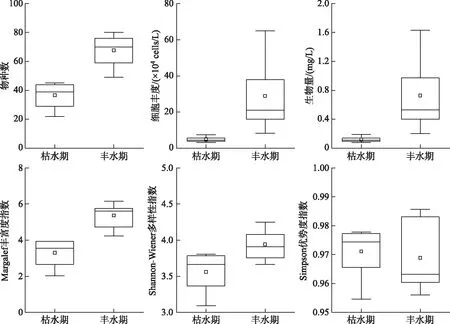
图4 巴松错枯水期和丰水期浮游植物群落参数箱体图Fig.4 Box-plots of phytoplankton community parameters in Lake Basomtso during dry and wet seasons
2.2.2 浮游植物功能群划分 根据功能群分类方法[3-4]对巴松错浮游植物进行分类,可分为25个功能群,包括A、B、C、D、E、F、G、H1、H2、J、LM、LO、M、MP、N、P、S1、S2、T、W1、W2、X1、X2、X3和Y,其中枯水期21个功能群分别为A、B、C、D、E、F、G、H2、J、LO、M、MP、N、P、S1、S2、T、W1、X1、X2、X3,丰水期24个功能群分别为A、B、C、D、E、F、H1、H2、J、LM、LO、M、MP、N、P、S1、S2、T、W1、W2、X1、X2、X3和Y,A、B、C、D、E、F、H2、J、LO、M、MP、N、P、S1、S2、T、W1、X1、X2、X3是两个水情期共有的浮游功能群,枯水期特有的浮游植物功能群为G,丰水期特有的浮游植物功能群为H1、LM、W2和Y,各功能群的代表性种(属)、生境及其C-R-S生长策略见表1,其中C型为竞争者(competitors),R型为杂生者(ruderals),S型为环境胁迫的耐受者(stress-tolerators). 出现频率如图5所示,在巴松错两个水情期中,功能群D、F、LO、MP、N、P、S1、X1、A、J、M、X3、E、S2、T的出现频率均大于50%,出现频率较高,为巴松错浮游植物常见的功能群;功能群B、C、H1、W1的出现频率在20%~50%之间,仅在适宜的生境中出现;功能群G、H2、LM、W2、X2、Y的出现频率在20%以下,出现频率较低,为巴松错的偶见或罕见功能群.

表1 巴松错浮游植物功能群组成
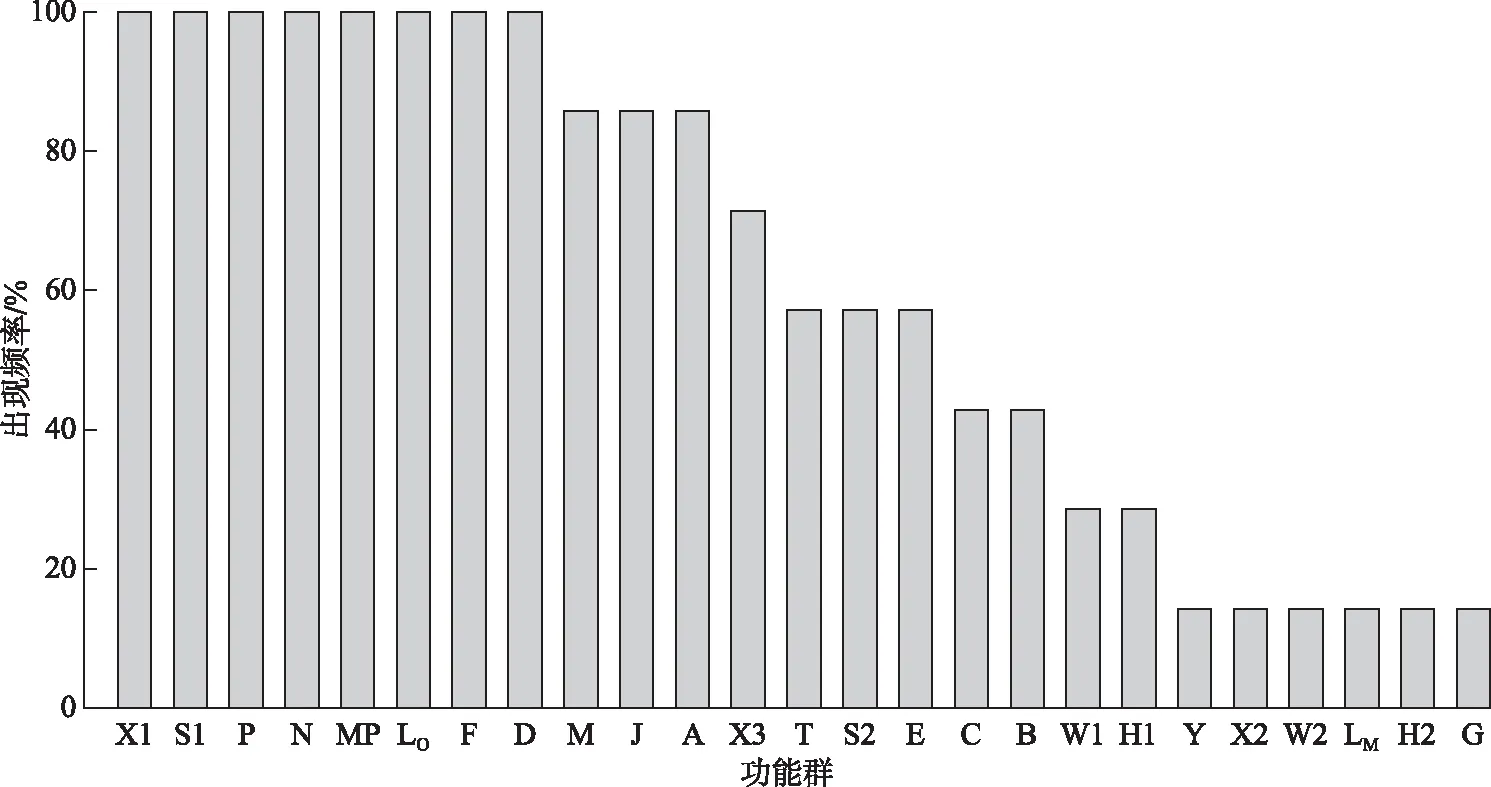
图5 巴松错浮游植物功能群出现频率Fig.5 Frequency of phytoplankton functional groups in Lake Basomtso
将相对生物量至少在一个采样点大于10%的浮游植物功能群定义为该采样点的优势功能群,至少在一个采样点大于50%则该功能类群占据绝对优势[7]. 根据巴松错2个水情期的浮游植物功能群相对生物量(图6)可知,巴松错枯水期以功能群D、LO、MP、P为优势功能群,丰水期以功能群D、F、LO、MP、N、P为优势功能群,优势功能群D、LO、MP、P在两个水情期稳定出现. 功能群MP在两个水情期的优势度均大于50%,成为巴松错浮游植物群落绝对优势群. 巴松错浮游植物功能群在枯水期至丰水期的空间更替明显,M1样点优势功能群从枯水期的MP、D、LO、P转变为丰水期的MP、D;M2样点优势功能群从枯水期的MP、P、LO、D转变为丰水期的MP、P、D、N;M3样点优势功能群从枯水期的MP、P、LO转变为丰水期的MP、LO、N、F;M4样点优势功能群从枯水期的MP、P转变为丰水期的MP、N、P;M5样点优势功能群从枯水期的MP、D、LO、P转变为丰水期的MP、P、D;M6样点优势功能群从枯水期的MP、D转变为丰水期的MP、P、D;M7样点优势功能群从枯水期的MP、D、LO转变为丰水期的MP.
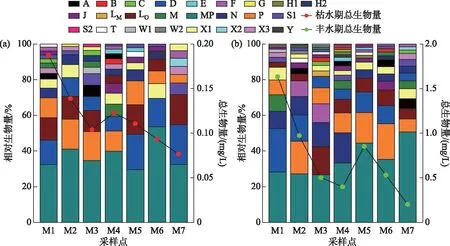
图6 巴松错枯水期(a)和丰水期(b)浮游植物功能群相对生物量和总生物量Fig.6 Relative biomass and total biomass among functional group of phytoplankton in Lake Basomtso during dry season (a) and wet season (b)
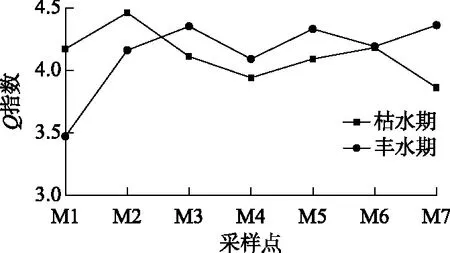
图7 巴松错枯水期和丰水期浮游植物功能群Q指数点线图Fig.7 Point plot of Q index of phytoplankton functional group in Lake Basomtso during dry and wet seasons
2.2.3Q指数 基于浮游植物功能群的Q指数对巴松错的水质进行评价,每个功能类群的代表值见表1,枯水期和丰水期Q指数见图7. 枯水期,巴松错浮游植物功能群的Q指数平均值为4.12,范围为3.86~4.46;丰水期,Q指数平均值为4.13,范围为3.47~4.36. 根据Q指数得出,目前巴松错水质处于极好状态,其中巴松错Q指数最大值出现在枯水期M2分层,即营养状态最低;最小值出现在丰水期的M1分层,即营养状态最高.
2.3 巴松错浮游植物与环境因子的关系
2.3.1 优势功能群与环境因子的Pearson相关性分析 巴松错各环境因子与优势功能群生物量之间的相关性分析结果显示,枯水期,功能群MP生物量与TN浓度呈极显著正相关;功能群LO生物量与NH3-N浓度呈极显著负相关;功能群P生物量与RWCS、pH、水温呈极显著正相关,与水深、EC、TDS、盐度呈极显著负相关. 丰水期,功能群D生物量与pH呈极显著正相关;功能群N生物量与RWCS呈显著正相关,与pH呈极显著正相关,与TDS、盐度、TN呈显著负相关,与水深、EC呈极显著负相关.
根据巴松错浮游植物优势功能群生物量与环境因子的相关性分析结果,对与优势功能群生物量呈显著和极显著相关的环境因子的分布情况进行预测(图8,图9). 由图8可见,枯水期,功能群MP集中出现在TN浓度为0.10~0.23 mg/L的范围内;功能群LO集中出现在NH3-N浓度为0.012~0.036 mg/L的范围内;功能群P集中出现在RWCS为19.46~28.9、pH为7.31~7.52、水温为8.9~9.86℃、水深为0.5~30 m、EC为110.53~123.1 μS/cm、TDS浓度为78.43~86.93 mg/L、盐度为50.73~55.6 mg/L的范围内. 由图9可见,丰水期,功能群D集中出现在pH为7.21~7.72范围内;功能群N集中出现在RWCS为18.08~109.88、pH为7.21~7.72、水温为8.87~15.37℃、TDS浓度为69.1~82.2 mg/L、盐度为46.77~52.7 mg/L、TN浓度为0.18~0.26 mg/L、水深为0.5~30 m、EC为87.93~116.77 μS/cm范围内.
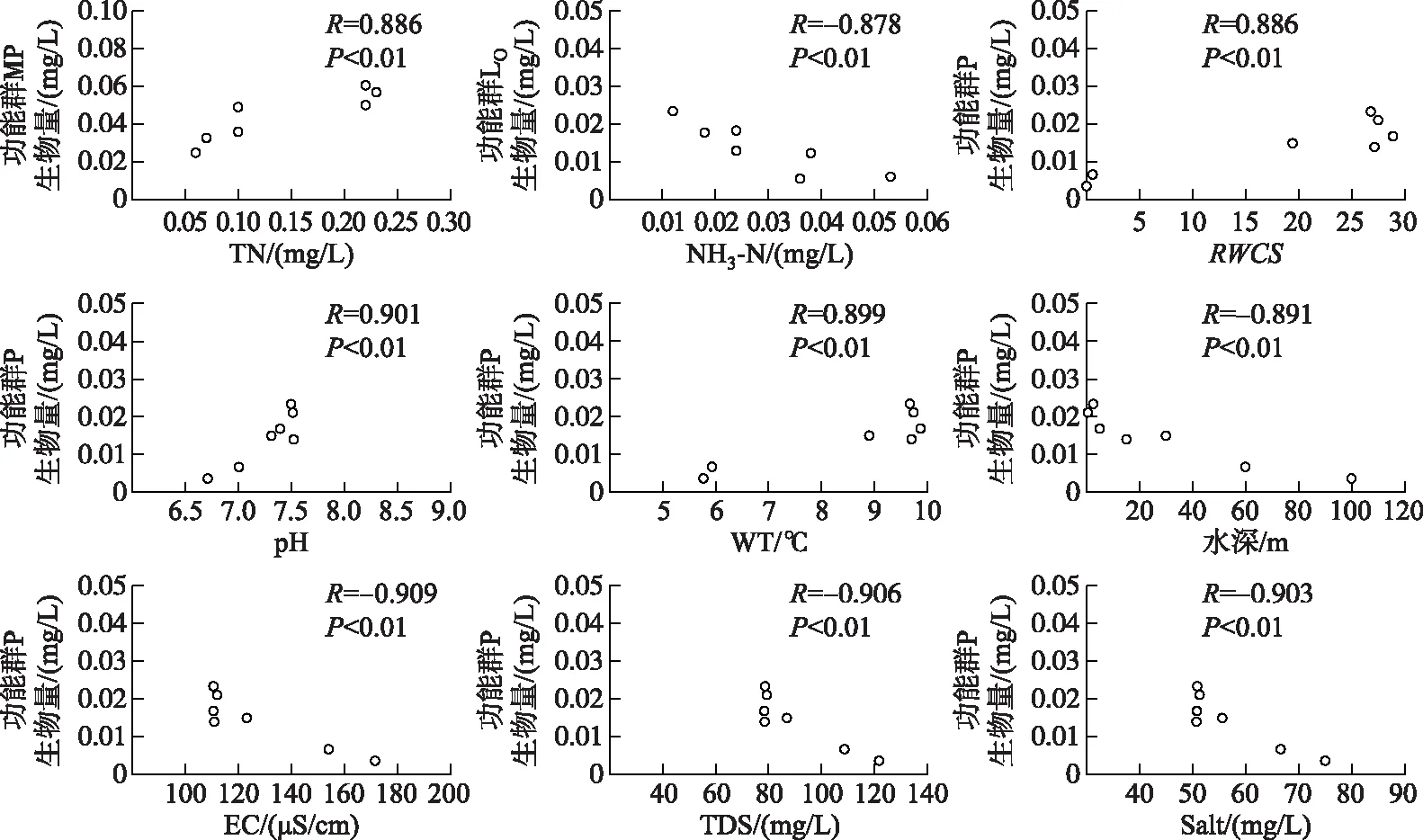
图8 巴松错枯水期浮游植物优势功能群与部分水环境因子的相关性Fig.8 Concordance correlations between several phytoplankton dominant functional groups and environment factors in Lake Basomtso during the dry season
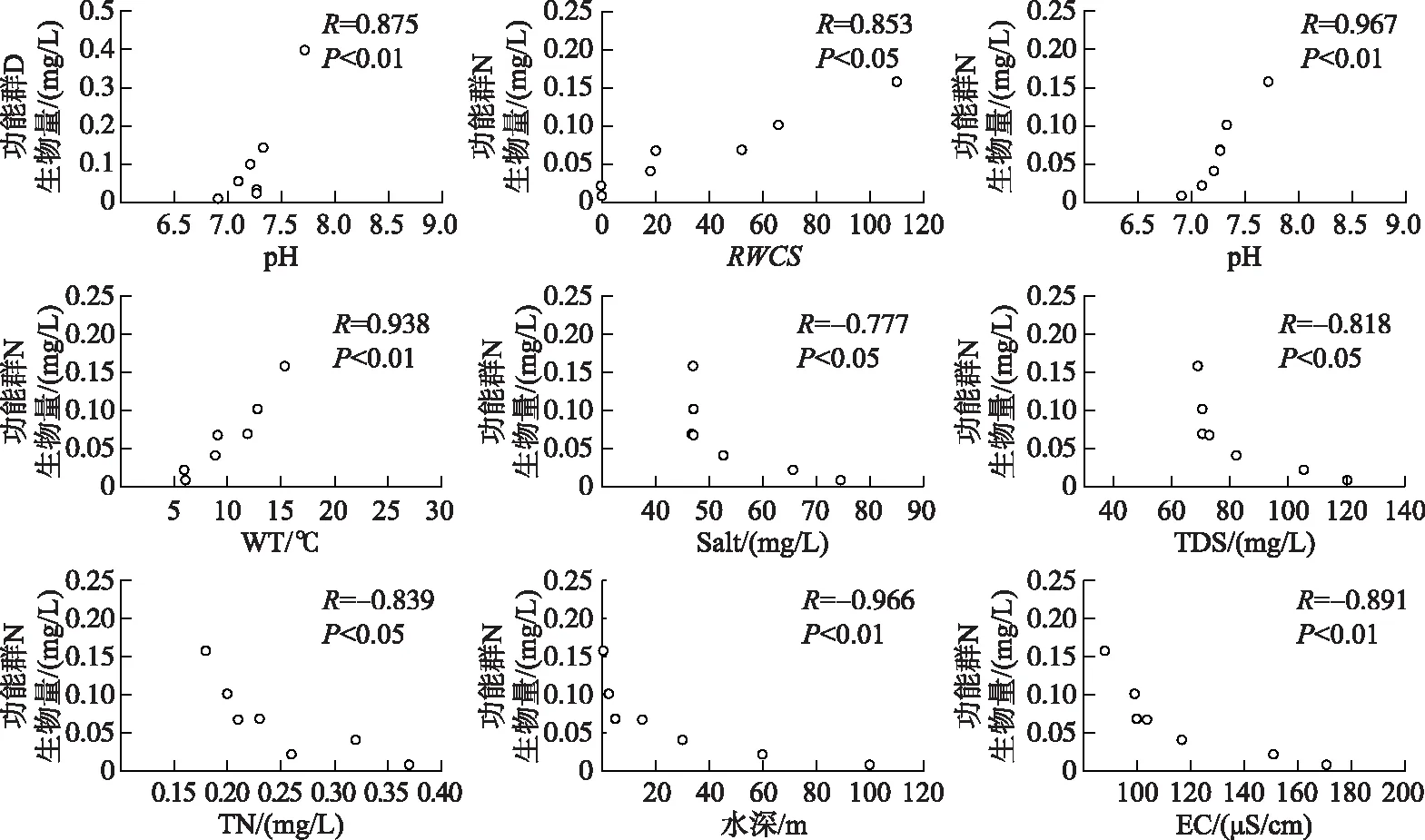
图9 巴松错丰水期浮游植物优势功能群与部分水环境因子的相关性Fig.9 Concordance correlations between several phytoplankton dominant functional groups and environment factors in Lake Basomtso during the wet season
2.3.2 优势功能群与环境因子的冗余分析 为了探究环境因子对巴松错浮游植物群落分布的影响,首先选取巴松错枯水期的优势功能群生物量进行DCA分析,结果排序轴长度小于3,表明优势功能群的分布可使用线性模型,共有11个环境因子RWCS、水深、pH、EC、TDS、盐度、水温、DO、TUR、TN和NH3-N进行RDA分析. 应用蒙特卡拟合方法对环境因子进行显著性检验. 通过筛选,TN(P=0.022,F=4.7)、NH3-N(P=0.046,F=2.7 和pH(P=0.042,F=3.4)是显著解释性变量,对群落变异的解释率分别为48.4%、21.0%和16.3%,是影响巴松错枯水期浮游植物群落变异的主要环境因子,影响并不显著的环境因子用虚线表示,结果如图10所示. 从图10可以看出,第1排序轴与第3排序轴对优势功能群生物量方差的解释率分别为65.81%和22.54%,优势功能群生物量与环境因子的相关性分别为0.9825和0.9488,前两轴累计方差为88.35%,表明前两轴能较好地反映优势功能群生物量与环境因子的关系,且主要是由第1排序轴决定;第1排序轴与NH3-N浓度呈正相关,与TN浓度和pH呈负相关;第2排序轴与pH呈正相关,与TN和NH3-N 浓度呈负相关. 功能群MP、LO、D和P与pH、TN浓度呈显著正相关,与NH3-N浓度呈显著负相关.
将巴松错丰水期的优势功能群生物量进行DCA分析,结果排序轴长度小于3,表明优势功能群的分布可使用线性模型,对同样的11个环境因子应用蒙特卡拟合方法对环境因子进行显著性检验. 通过筛选,仅pH(P=0.02,F=8.0)是显著解释性变量,对群落变异的解释率为61.5%,是影响巴松错丰水期浮游植物群落变异的主要环境因子,影响并不显著的环境因子同样用虚线表示,结果如图10所示. 结果显示,第1排序轴与第2排序轴对优势功能群生物量方差的解释率分别为82.53%和12.13%,优势功能群生物量与环境因子的相关性分别为0.9926和0.9488,前两轴累计方差为99.67%,表明前两轴能较好地反映优势功能群生物量与环境因子的关系,且主要是由第1排序轴决定;第1排序轴与pH呈正相关;第2排序轴与pH呈负相关. 功能群MP、LO、F、D、N和P与pH呈显著正相关.
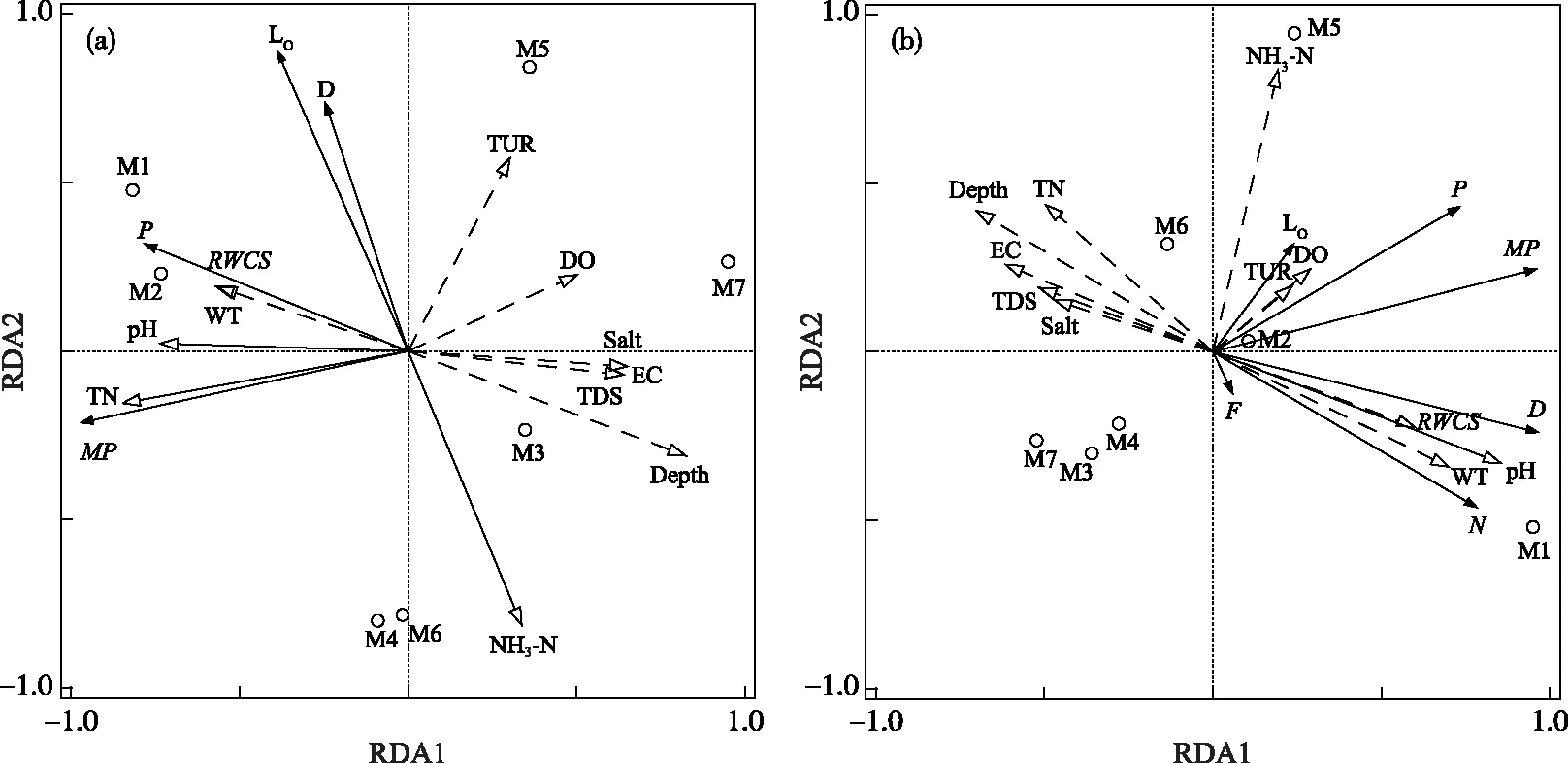
图10 巴松错枯水期(a)和丰水期(b)浮游植物功能群与环境因子的RDA分析Fig.10 RDA analysis of phytoplankton dominant function groups and environment factors in Lake Basomtso during dry season (a) and wet season (b)
3 讨论
3.1 巴松错水质垂直分布特征
大型深水湖库由于夏、秋季太阳辐射强,水体分层温差大、持续时间长,对水体水质分布和浮游植物群落影响较大[38]. 通过对巴松错环境因子的两个水情期的分层研究表明,该湖泊在枯水期和丰水期均出现水温分层现象,呈稳定分层湖泊特征;根据湖库分层公式a=入湖年径流量/总蓄水量[39],巴松错a=4.86<10,水温分布呈稳定分层型,该结果与实际研究结论一致.
本研究显示,巴松错水体透明度较低,其原因可能主要为夏秋季水温较高、日照时间长,从而导致浮游植物大量繁殖,悬浮物质较多,湖水较浑[40]. 巴松错水体相对稳定性从枯水期到丰水期呈升高趋势,而混合层的高度从枯水期到丰水期呈逐渐降低趋势,主要表现为巴松错水体在枯水期和丰水期均出现明显的水温分层现象,枯水期在30~60 m处形成温跃层,丰水期在1~15 m和30~60 m 处产生双温跃层. 枯水期,水温从表层至水深30 m处变化不大,由于逆温的影响,混合层较高,湖底水体受紊流扩散和热量传递的作用很小,恒温层与湖泊混合层之间形成了垂向厚度约30 m的温跃层. 丰水期,巴松错水体形成双温跃层结构,是高温温跃层压迫湖底等温层但难以对其进行充分扰动的结果,这与李嘉等[41]对雅砻江卡拉水库和张士杰等[42]对二滩水库的研究结果基本一致,主要由于太阳辐射较强、气温较高,湖泊表面水体快速升温,在湖泊表层以下出现第一个约14 m厚度的温跃层;湖泊入流和出流产生的纵向水流在温度异重流的作用下, 入流沿温跃层与入流温度接近的水层流动,而且垂向水体受紊流的影响比较强烈,从而在温跃层以下出现一个约15 m厚度的变温层;60 m以下为恒温层,湖底水体受紊流扩散和热量传递的作用很小,因而与湖泊变温层之间形成第2个垂向厚度约30 m的温跃层. 而水体温跃层的出现,上下水层的物质和能量交换受到阻碍,导致下层水体的EC、TDS、盐度显著高于上层水体,卢金锁等[43]对西安黑河水库理化因子分布特征的研究也表明在水温分层情况下,理化因子在不同水层表现出明显的垂直变化特征,主要是由于随着水深的增加,光合作用减弱,在垂向上易于产生生物分层(表层多为自养型生物,底层多为异养型生物),而异养型生物在释放和分解有机物的过程中,代谢排放的产物(硝酸铵、碳酸氢根等)以及碎屑,致使pH降低,水体呈弱酸性,从而导致浊度、盐度、NH3-N、TDS和EC呈逐渐上升趋势[44].
通常湖泊水温分层效应对水体DO浓度有明显的影响,表层水体由于复氧作用和光合作用DO浓度通常较高;而底层水体因不能与DO浓度较高的表层水混合,DO浓度较低,加之底泥有机物分解不断消耗水中的DO,常出现缺氧状态甚至厌氧状态[45],但在枯水期和丰水期,巴松错水体垂向上并未出现较大差异,底部100 m处水体DO浓度分别处于7.49和6.49 mg/L的较饱和状态,DO浓度差值分别为0.08 和1.45 mg/L,主要原因是随着水深增加,微生物活性降低,耗氧量减少,巴松错水体含氧量呈现缓慢下降趋势,特别是枯水期湖水相对静止,降低的趋势更加不明显.
3.2 巴松错浮游植物群落结构及功能群垂直分布特征
MRPP结果显示,巴松错浮游植物群落结构存在明显的时空差异,枯水期和丰水期均以硅藻门、蓝藻门和绿藻门为主,物种组成表现为硅藻-蓝藻-绿藻型,这与孙文秀等[46]对东湖水库和田泽斌等[47]对三峡水库香溪河库湾的研究结果基本一致,表明巴松错浮游植物种群组成具有一般湖库的普遍性特征. 巴松错浮游植物物种数、细胞丰度、生物量、Margalef丰富度指数和Shannon-Wiener多样性指数的时空差异显著,这与刘霞等[48]对密云水库和李秋华等[49]对大镜山水库的研究结果基本一致. 而巴松错枯水期和丰水期浮游植物主要分布在湖体的表层和温跃层,细胞丰度、生物量和多样性最大值出现在表层,深层显著降低,表明巴松错浮游植物群落结构在水体垂直方向上具有一定规律性,与水体热分层现象密切相关,这与牛远等[50]对抚仙湖和曾明正等[51]对周村水库的研究结果基本一致,温跃层的存在致使上下水层的物理化学性质差异明显,形成了不同的生境,生境异质性是影响巴松错浮游植物群落的重要因素,因此对巴松错浮游植物群落结构的探讨和分析应建立在水温分层研究的基础上.
巴松错共划分出25个浮游植物功能群,优势功能群从枯水期的MP、D、LO、P转变为丰水期的D、F、LO、MP、N、P,其中MP为两个水情期的绝对优势功能群,MP、D、LO、P均为两个水情期共有优势功能群,丰水期和枯水期相比多了F和N功能群,表现出明显的时空垂直分布特征,这与杨丽等[6]对淀山湖和陈楠等[52]对泰湖的研究结果基本一致,这主要的原因是巴松错为5A级旅游景区,枯水期旅游活动为淡季,人流量较少,船舶活动量小,雨水较少,入湖流量较小,营养物质匮乏,混合层较高;而进入丰水期,旅游活动转为旺季,人流量增大,船舶活动量大,雨水充足,通过入湖河流带来丰富的营养物质,加上水温升高,形成了双温跃层,混合层较低,适宜功能群F、N等喜温跃层的浮游植物生长,从而导致两个水情期功能群的垂直分布变化.
基于浮游植物功能群的Q指数对巴松错的水质进行评价发现,枯水期和丰水期巴松错水质均处于极好状态. 从浮游植物生境上看,巴松错浮游植物优势功能群中,MP功能群指示经常性扰动、浑浊水体,Lo功能群指示贫到富营养水体,N功能群指示中营养型水体,P、F功能群指示中到富营养型水体,D功能群指示较高的营养盐浓度[4]. 因此,从功能群上推测,巴松错水体处于营养相对较高的状态,这与Q指数判定巴松错水质处于极好状态的结果不一致,可能原因是巴松错周围旅游活动如船舶的频繁活动和人为干扰等,加上雨水淋溶和下游筑坝形成水库的影响[13],水体流速大幅降低,内源有机质在湖内逐渐累积,导致营养盐相对较高,这为浮游植物生长提供了丰富的营养物质.
3.3 巴松错浮游植物与环境因子的关系
环境因子是浮游植物群落分布的主要影响因素,水体透明度、浊度、水温、盐度、DO和pH等环境因子都对浮游植物群落分布产生影响,并且特定功能群对生境的选择与适应性也不同[53]. 本研究中,巴松错浮游植物优势功能群生物量与水环境因子的相关性分析表明,枯水期浮游植物优势功能群中,仅功能群MP生物量与TN浓度呈极显著正相关,功能群LO生物量与NH3-N浓度呈极显著负相关,说明巴松错浮游植物枯水期优势功能群对TN及NH3-N浓度变化有显著影响. 功能群MP能适应经常性扰动、浑浊水体,而LO功能群的适应生境广泛,也常分布于湖库水体,原因是这两种功能群的表面积较大且有较厚的硅壳,能适应频繁扰动的水体[4],本研究结果与其一致,因此还需要进一步研究TN及NH3-N浓度对湖库浮游植物的影响. 功能群P生物量与绝大多数环境因子呈显著相关,可能的原因是功能群P适应生境为栖息在中富营养的温跃层,对水体分层敏感,表明功能群P对理化因子适应性更广. 丰水期,仅功能群D生物量与pH呈极显著正相关,主要原因是硅藻门受pH影响更为显著[54],而功能群D的主要代表中主要为硅藻门,因此可以得知功能群D受pH的影响较大. N功能群生物量与绝大多数环境因子呈显著相关,可能的原因是功能群N适应的生境与功能群P相似,对水体分层敏感,和功能群P一样表现出对理化因子广适性. 对与优势功能群的生物量呈显著相关和极显著相关的环境因子的分布范围进行预测,结果表明,这些环境因子的分布范围均接近于湖心(M)水环境因子的平均值,这可能是浮游植物群落与环境因子相互作用形成的动态适应机制,这与闵文武等[55]对渭河流域的研究结果基本一致.
巴松错浮游植物优势功能群生物量与环境因子的RDA分析表明:枯水期,TN、NH3-N浓度和pH是影响巴松错浮游植物群落变异的主要环境因子;丰水期,pH是影响巴松错浮游植物群落变异的主要环境因子;因此,不同水情期浮游植物功能群垂直分布特征受环境因子影响差异较明显,整体上,pH、TN和NH3-N浓度是影响浮游植物功能群分布格局的主要环境因素,这与葛优等[2]对阳澄西湖和冯喻等[56]对高州水库的研究结果基本一致. 而通常不同的水生态系统会造成不同的生物以及非生物过程, 影响浮游植物生物量分布以及优势功能群组成的环境因子也存在较大的差别[57]. 夏莹霏等[58]研究发现水温、透明度、BOD5、TN、TP和DO浓度是影响太湖浮游植物功能群分布的主要因素;钱奎梅等[5]研究发现水位变化、透明度、悬浮物、水温、亚硝态氮及电导率是鄱阳湖浮游植物功能群分布格局的主要环境影响因子. TN和NH3-N浓度是浮游植物生长代谢不可或缺的营养盐,影响浮游植物的生长和群落结构的演替[6]. 本研究中,TN和NH3-N浓度在枯水期显著高于丰水期,且温跃层差异更显著,这是因为枯水期流量较小,仅为13.4 m3/s,水力滞留时间长,导致巴松错TN和NH3-N浓度升高. 研究表明,藻类适宜在偏碱性的水体中生长,这与本研究结果一致[59],这主要是因为湖泊中水深的增加会使水体与大气接触的表面积相对减少,DO浓度降低,下层水体在产酸细菌的影响下,pH值降低,这不仅仅改变了大多数浮游植物适应的生存环境,降低了物种的耐受性,限制了大多数浮游植物的生存与繁衍,利于对pH值变化敏感的种类的生长. 由此可见,浮游植物垂直分布特征是不同分层浮游植物和多种环境因子共同作用的结果.

