治疗非小细胞肺癌新药
——MET抑制剂capmatinib
王 涛
(江苏护理职业学院 江苏·淮安 223005)
近年来,肺癌已经成为全球最主要的癌症死因之一,严重危害人类生命健康。根据肿瘤组织病理学,肺癌又分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC),其中NSCLC约占85%。相关研究表明,间质上皮细胞转化因子(mesenchymalepithelialtransition factor,MET)基因是NSCLC的一种重要肿瘤驱动基因和治疗靶点,MET基因的异常状态主要包括MET 14外显子跳跃(MET exon14 skipping,METex14)突变、MET基因扩增和蛋白过表达,其中METex14突变是公认的致癌驱动因子,其在新诊断的转移性NSCLC总体发生率为3%~6%,METex14突变晚期NSCLC预后极差,目前尚无明确的治疗方案可针对这种侵袭性肺癌。Capmatinib是一种口服 MET抑制剂,由诺华制药公司研发,于2020年5月获美国食品和药物管理局(FDA)批准用于治疗携带METex14突变的转移性NSCLC成人患者。Capmatinib的分子式为C23H17FN6O,分子量为412.43,结构式如图1所示,推荐剂量为每次400毫克,每日两次,口服给药。本文对capmatinib的作用机制、药动学、临床疗效和安全性进行介绍。
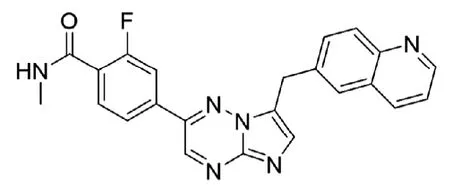
图1:capmatinib的结构式
作用机制。MET基因位于人类7号染色体,含有21个外显子。由MET基因编码的蛋白为c-MET,c-MET能激活众多下游信号通路,从而发挥促进细胞增殖、细胞生长、细胞迁移、侵袭血管及血管生成等效应,c-MET正常表达时促进组织的分化与修复,而调节异常时则促进肿瘤的增殖与转移。MET 14外显子跳跃突变是c-MET通路异常激活的类型之一,其会导致c-MET蛋白调控结构域的缺失,从而降低负调控,继而引起下游信号的持续激活,最终成为肿瘤的驱动基因。Capmatinib为一种靶向MET,包括外显子14跳跃所产生的突变体的激酶抑制剂。Capmatinib能够抑制缺乏外显子14的突变型MET所驱动的癌细胞生长,并在鼠肿瘤异种移植模型中证明了其具有抗肿瘤活性,这一模型来源于存在外显子14跳跃突变的人肺肿瘤。
药动学。在200 mg(建议剂量的0.5倍)至400 mg的剂量范围内,药物的暴露量(AUC0-12h和Cmax)基本上与剂量的增加成正比,且不受饮食的影响。每天两次给药后,到第3天,药物达到稳态血药浓度。在癌症患者口服capmatinib 400 mg后,药物的血浆峰值浓度(Cmax)在大约1-2小时内(Tmax)达到,药物口服后的吸收率估计大于70%。Capmatinib血浆蛋白结合率为96%,稳态时的表观分布容积为164L,消除半衰期为6.5小时,稳态表观清除率为24 L·h-1。Capmatinib主要由CYP3A4和醛脱氢酶代谢。在健康受试者单次口服放射性标记的capmatinib后,粪便中总放射性的78%被回收,其中未改变的为42%,而尿液中的放射性回收率为22%,未改变的可忽略不计。
年龄(26至 90岁),性别,种族,体重(35至131 kg),轻度至中度肾功能不全和轻度,中度或重度肝功能不全对capmatinib的药动学参数无明显影响,目前尚未研究严重肾功能损害对药物药动学的影响。
药物相互作用。与强效CYP3A抑制剂合用会增加capmatinib的暴露,这可能会增加capmatinib不良反应的发生率和严重程度,因此在共同给药期间应密切监测患者的不良反应。与强效或中效CYP3A诱导剂合用会降低capmatinib的暴露量,继而会影响药物的抗肿瘤活性,应避免capmatinib与强或中度CYP3A诱导剂共同给药。与雷贝拉唑(质子泵抑制剂)共同给药可使capmatinib的AUC0-INF降低25%,Cmax降低38%,同样降低药物的暴露量。Capmatinib与CYP1A2底物(如咖啡因)合用时,会提高后者的暴露,这可能会增加这些底物的不良反应。与P-gp底物(如地高辛)联用时,也会增加P-gp底物的暴露量及不良反应。此外,Capmatinib能减轻对乙酰氨基酚的肾毒性。
临床疗效。在一项I期临床研究(NCT01324479)中纳入55例MET异常表达的晚期NSCLC患者,患者接受capmatinib(400 mg tablets or 600 mg capsules bid)治疗。这项研究旨在为capmatinib的II期临床试验确立最大耐受剂量及推荐剂量,和评价药物的疗效和药代动力学。研究显示,所有55例晚期NSCLC患者的中位无进展生存期(PFS)为3.7月。其中11例患者部分缓解,客观缓解率(ORR)为20%,疾病控制率(DCR;完全缓解+部分缓解+疾病稳定)为51%。4例METex14突变的NSCLC患者,均显示出14%-83%的肿瘤缩小。本项研究表明,capmatinib对MET依赖性的晚期NSCLC患者具有较好的治疗效果。
一项多中心、非随机、开放标签、多队列的II期临床研究(GEOMETRYMono-1;NCT02414139)中招募了97例经RNA临床分析确证携带MET外显子14跳跃的NSCLC患者,给予capmatinib(400mg bid)直至疾病进展或出现不可耐受毒性。结果显示,capmatinib针对未接受过治疗的28名患者的客观缓解率(ORR)为68%,其中完全缓解率(CR)为4%,部分缓解率(PR)为64%;缓解持续时间(DOR)超过12个月的患者比例为47%,中位缓解持续时间为12.6月。capmatinib针对既往接受过治疗的69名患者的客观缓解率(ORR)为41%,且全部为部分缓解的病例;缓解持续时间(DOR)超过12个月的患者比例为32%,中位缓解持续时间为9.7月。本研究表明capmatinib在携带MET外显子14跳跃突变的晚期NSCLC患者中表现出了显著的抗肿瘤活性,尤其是在未经治疗的患者中,非常有希望冲击MET异常晚期NSCLC的一线治疗。
安全性。在 NCT02414139临床试验中,334例转移性NSCLC患者接受capmatinib(400mg bid)治疗直至疾病进展或出现不可耐受毒性,对药物的安全性进行评价。最常见的不良反应(≥15%)是外周性水肿(41.6%)、恶心(33.2%)、血肌酐升高(19.5%)和呕吐(18.9%)。有51%的患者出现了严重不良反应,这些严重不良反应包括呼吸困难(7%)、肺炎(4.8%)、胸腔积液(3.6%)、一般身体健康恶化(3%)、呕吐(2.4%)和恶心(2.1%),其中肺炎导致了一位患者的致命性不良反应。
结语
通过MET突变或扩增而激活MET信号通路在NSCLC中是一种重要的致癌机制,MET 14外显子跳跃突变和MET异常表达与NSCLC患者出现的较差预后密切相关,而且目前并没有新的治疗方案针对这种疾病。Capmatinib作为一个小分子MET抑制剂,已显示出在体内或体外对NSCLC都具有较好的抗肿瘤活性。同时,相关研究确立了capmatinib(400mg bid)的推荐剂量,来保证药物的安全性和耐受性。总体而言,capmatinib作为第一个被FDA获准上市的专门针对METex14突变晚期NSCLC的治疗药物,具有广阔的发展前景,其疗效和安全性还有待进一步的临床验证。

