水稻生物硝化抑制剂1,9-癸二醇的定量方法优化①
张晓楠,陆玉芳,杨 婷,施卫明*
水稻生物硝化抑制剂1,9-癸二醇的定量方法优化①
张晓楠1,2,陆玉芳1,杨 婷1,2,施卫明1*
(1 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;2 中国科学院大学,北京 100049)
选取水稻生物硝化抑制剂1,9-癸二醇作为研究对象,对比旋转蒸发法和固相萃取法对该物质的回收率(80.17% 和82.97%)及效率,确定固相萃取法为水稻根系分泌物收集液的前处理方法,且该方法具有高效省时的特点。在气相色谱(GC)分析方法的基础上,对衍生化试剂和衍生化条件进行了优化,结果表明,使用N,O-双(三甲基硅基)三氟乙酰胺(BSTFA)作为1,9-癸二醇的衍生化试剂时,衍生化产物具有较高的响应值;衍生化过程中加入200 µl BSTFA,在60 ℃条件下反应30 min时,1,9-癸二醇经过GC方法得到的分析效果最好;且本方法仪器的日内精密度为2.18%,日间精密度为3.01%,线性方程为= 34.77–0.90,= 0.999 3,最小检出限为0.05 µg/ml,此方法可为水稻根系分泌物中生物硝化抑制剂1,9-癸二醇的定量研究提供参考。
硝化作用;水稻;1,9-癸二醇;生物硝化抑制剂;定量
为了维持和提高农作物的产量和品质,人类在农业生态系统中施入大量氮肥。铵态氮肥是氮肥投入的主要形式,土壤中的NH4+通过硝化作用转化为硝酸盐(NO– 3),易通过淋溶等形式流失进入水体,造成水体富营养化、地下水硝酸盐污染;NO– 3 还可以通过反硝化作用转化为N2、NO和N2O等气体排放,导致农田氮素大量损失,作物氮素利用效率下降[1-3]。为了有效抑制农田土壤硝化过程,农业生产中常使用双氰胺(DCD)、2-氯-6-三氯甲基吡啶(Nitrapyrin)等合成硝化抑制剂[4-6],但该类物质具有价格过高、使用繁琐、易造成地下水污染等局限性[7-8]。
近年来研究发现,植物根系能够分泌抑制土壤亚硝化细菌的物质,统称为生物硝化抑制剂(biological nitrification inhibitors, BNIs)[9-12],此类物质具有成本低、环境友好等优点。本课题组前期从粮食作物水稻的根系分泌物中首次鉴定到脂肪醇类化合物1,9-癸二醇,该物质在亚硝化细菌培养与土壤培养试验中均具有可观的硝化抑制能力,并且研究发现该物质分泌量与水稻的铵吸收效率和铵态氮偏好呈正相关,在提高作物氮素利用效率、控制农田土壤硝化作用过程中具有较强的理论研究意义和实际应用价值[13-15]。
水稻根系分泌BNI 1,9-癸二醇具有品种差异性,其分泌量一般在34 ~ 477 ng/(g·d),根系分泌物收集液中该物质含量较低,因此建立一种高效可靠的物质分离及测定方法对于1,9-癸二醇的定量十分重要,能为今后1,9-癸二醇根系释放特征的研究和1,9-癸二醇根系分泌的遗传位点分析提供理论支撑[13-14]。目前,植物根系BNI研究中常采用水培静置收集体系收集植物的根系分泌物[9-13],并且收集液体积较大(一般每个样品体积为0.5 ~ 1 L),在研究中面临着大量样品前处理的问题。常用的样品前处理技术有旋转蒸发[9-13]和固相萃取(SPE)[16-20],旋转蒸发法能够快速高效地处理有机样品,但对于水样中物质的浓缩耗时较长;而固相萃取法可以高效快速富集水样中目标物质,并且可同时处理多个大量水样。前人的研究中主要采用旋转蒸发法对水稻根系分泌物进行前处理,用于挖掘水稻生物硝化抑制剂及测定小批量样品中1,9-癸二醇的含量,但该方法对于多品种、大批量根系分泌物的前处理而言存在着工作量大、耗时长等局限性,因此本研究对比了两种方法对水样中的1,9-癸二醇的富集效率,以期选择一种快速、可靠的根系分泌物收集液前处理方法。Sun 等[13]采用气相色谱对1,9-癸二醇进行定量分析,但由于1,9-癸二醇挥发性低、难于气化,所以在气相色谱分析之前,一般会对该类物质进行甲基硅烷化处理,从而提高此类物质的挥发性和热稳定性[21-22], 前期试验中1,9-癸二醇的衍生化反应采用了常用的硅烷化试剂BSTFA,添加量为500 µl,在60 ℃条件下反应120 min,然而研究发现衍生化试剂的选择[23-24]、衍生化试剂的添加量[25-26]、衍生化反应的温度和时间[27-29]的不同都会导致衍生化方法在灵敏度和可靠性方面产生较大差异,因此本研究通过对比不同衍生化试剂的效率,选择合适的衍生化试剂,系统优化了衍生化反应的条件,有助于对水稻根系分泌物中1,9-癸二醇的定量分析研究。
1 材料与方法
1.1 主要试剂材料与仪器
化学标准品1,9-癸二醇,定制于公司,常温为黏稠状液态物质;衍生化试剂N,O-双(三甲基硅基)三氟乙酰胺(BSTFA,SUPELCO)和N,O-双(三甲基硅基)三氟乙酰胺(含1% 三甲基氯硅烷)(BSTFA+1% TMCS,SUPELCO);有机试剂甲醇、丙酮、正己烷均为色谱纯,订购于上海安谱实验科技股份有限公司。
供试水稻(L.)为武运粳7,选育于江苏省常州市武进区农业科学研究所。
Agilent7890气相色谱仪(GC,包括HP7890气相色谱、HP7683自动进样器);烘箱(CIMO,DHG- 9053BS-Ⅲ);防腐型12位氮吹仪(EFAA-DC12-RT,ANPEL);旋转蒸发仪(Eyela,N-1100D-WD,Japan);12位固相萃取真空装置(SBEQ-CG1012,CNW,Germany)。
1.2 标准溶液的配制
用HPLC甲醇准确配制10.00 µg/ml 的1,9-癸二醇标准溶液,依次取0.10、0.20、0.50、1.00、2.00、5.00 ml的标准溶液于10 ml容量瓶,最后用HPLC甲醇定容,即为0.10 ~ 5.00 µg/ml的1,9-癸二醇标准使用液。
1.3 1,9-癸二醇浓缩方法的比较
取1 ml 10.00 µg/ml 1,9-癸二醇标准溶液溶解于1 L 含有0.10 mmol/L CaCl2的Milli-Q水中,配制成10.00 µg/L样品溶液6份;将样品分为两组,其中一组采用旋转蒸发仪在40 ℃蒸干,另一组液体样品用大容量采样管连接至12位固相萃取装置,用17% 含碳量的C18固相萃取小柱(1 g/ml,CNW)富集样品中的1,9-癸二醇,将残余物溶解于1 ml HPLC甲醇中,参照Sun等[13]研究中衍生化方法,加入500 µl衍生化试剂BSTFA,烘箱加热60 ℃,反应120 min后,产物用200 µl正己烷溶解,GC测定。
1.4 1,9-癸二醇衍生化试剂的选择及衍生化条件的优化
参照Sun等[13]的方法,依次取1 ml 10.00 µg/ml 1,9-癸二醇标准溶液于不同螺口玻璃试管中,室温下氮吹至干,加入500 µl N,O-双(三甲基硅基)三氟乙酰胺(BSTFA)或者500 µl N,O-双(三甲基硅基)三氟乙酰胺(含1% 三甲基氯硅烷) (BSTFA+1% TMCS),在60 ℃条件下衍生化反应120 min,衍生化产物溶解于200 µl HPLC正己烷中,GC测定。
比较衍生化试剂量、反应时间和反应温度对1,9-癸二醇衍生化效果的影响,在以下不同条件下进行衍生化反应:添加50、100、200、400、500 µl衍生化试剂BSTFA,衍生化时间烘箱加热60 ℃,反应120 min;衍生化试剂BSTFA加入量为200 µl,烘箱加热60 ℃时,衍生化反应时间分别为30、45、60、90、120 min;衍生化试剂BSTFA加入量为200 µl,衍生化时间为30 min时,衍生化反应温度分别为烘箱加热60 ℃和80 ℃。产物溶解于200 µl HPLC正己烷中,GC测定。
1.5 水稻根系分泌物中1,9-癸二醇的测定
参照Sun等[13]的根系分泌物收集方法,将30株6周苗龄的水稻置于装有1 L 0.10 mmol/L CaCl2收集液的玻璃烧杯,将另外30株6周苗龄的水稻置于装有1 L 1 mmol/L NH4Cl 和0.10 mmol/L CaCl2收集液的玻璃烧杯,每个处理3个重复,静置收集24 h后,采用12位固相萃取装置富集根系分泌物收集液中的1,9-癸二醇,将残余物溶解于甲醇中,按照上述优化后的衍生化方法处理根系分泌物的甲醇提取物,GC测定。
1.6 气相色谱仪测定条件
气相色谱仪采用装备FID检测器的Agilent 7890工作站,主要运行参数如下:毛细管色谱柱HP-5 (25 m×0.2 mm×0.33 µm);进样口温度250 ℃,不分流进样;初始柱温为80 ℃,以20 ℃/min的速率升至250 ℃,然后以6 ℃/min的速率升至300 ℃;载气为氦气,流速为1.0 ml/min;进样量为2 µl。
1.7 数据处理
GC数据计算通过Agilent ChemStation B.04.03完成;实验数据通过 Microsoft Excel 2010 和 SPSS 18.0 进行处理和统计分析(<0.05);利用单因素方差分析(One-way ANOVA)对不同处理间差异显著性进行检验,然后用Duncan法进行多重比较(<0.05);使用Origin 8.1绘制图表,图表中数据均为平均值± 标准误。
2 结果与讨论
2.1 1,9-癸二醇浓缩方法的选择
目前常用的植物根系分泌物收集液的前处理方法是旋转蒸发法去除样品中的水分[9-13],为了进一步去除样品中的有可能影响后续GC测定分析的无机盐离子,也有学者将旋转蒸发得到的甲醇样品重新用水稀释,然后用C18固相萃取小柱进行去离子盐处理[30]。本研究将1,9-癸二醇标准溶液稀释至1 L水溶液中,然后按照根系分泌物样品前处理过程进行过滤和浓缩,比较旋转蒸发法和固相萃取法两种前处理方法对1,9-癸二醇富集效率的影响。表1 结果表明,旋转蒸发法和C18小柱固相萃取法都能有效保留目标物质1,9-癸二醇,二者的回收效率分别为80.17% 和82.97%,相对标准偏差分别为3.15% 和4.02%,两种前处理方法对于1,9-癸二醇的富集效果并无显著性差异。然而对于水相收集液而言,旋转蒸发法将样品蒸干耗时较长,而固相萃取法能够同时处理多个大容量液体样品,大大缩短了样品前处理过程,同时能够减少样品长时间储存导致的实验误差[16-20]。以1 L根系分泌物样品为例,旋转蒸发法处理1个样品需要大概6 h,而在同样的时间,用12位固相萃取装置可以同时处理12个样品。因此对于样品中目标物质1,9-癸二醇的纯化浓缩,选用C18固相萃取法替代旋转蒸发法能加快实验的进度,可有效加大实验室检测样品的样品量,提高实验效率[31]。

表1 10 µg/ml 1,9-癸二醇标准溶液在不同预处理方法下的回收率比较(n = 3)
注:SPE:固相萃取,采用C18小柱 (17% 含碳量,1 g/6 ml,CNW)。
2.2 1,9-癸二醇衍生化条件的优化
由于根系分泌物中1,9-癸二醇在测定时影响因素多种多样,故主要从以下几个方面来对其进行优化。
2.2.1 衍生化试剂的选择 水稻源硝化抑制物质1,9-癸二醇是一种脂肪醇类物质,具有两个羟基官能团,直接进行GC分析会导致检测灵敏度和结果的可靠性降低[32-33]。而衍生化反应能够用较少极性的三甲基硅烷(TMS)取代活性羟基中的氢原子,从而降低分析物的极性,提高其挥发性和热稳定性[21-22, 27-28]。在1,9-癸二醇的衍生化过程中,常用的衍生化试剂为N,O-双(三甲基硅基)三氟乙酰胺(BSTFA)[13-14],但有报道指出将BSTFA与TMCS按照99:1混合能够提高反应产率[26-27];因此本试验中采用BSTFA和BSTFA+ 1% TMCS两种衍生化试剂对1,9-癸二醇进行甲基硅烷化处理,GC测定发现该物质在6.92 min出峰,图1结果表明,分别用BSTFA和BSTFA+1% TMCS两种衍生化试剂对1,9-癸二醇进行衍生化后,用BSTFA作为衍生化试剂时的产物峰面积显著高于用BSTFA+1% TMCS作为衍生化试剂时的产物响应值。说明对于1,9-癸二醇的衍生化,TMCS的添加并不能提高其衍生化效率,故在1,9-癸二醇的定量分析时选择BSTFA作为衍生化试剂。

(图中小写字母不同表示不同处理间差异达P<0.05显著水平,下同)
2.2.2 1,9-癸二醇衍生化反应条件的优化 除衍生化试剂的种类,衍生化反应的效果还受到衍生化试剂量、反应时间以及反应温度等方面因素的影响[23-29]。比较加入50、100、200、400、500 μl BSTFA对1,9-癸二醇衍生效果的影响,结果如图2所示,添加不同体积衍生化试剂BSTFA,1,9-癸二醇的衍生化产物的响应值有显著差异。其中添加200 µl BSTFA时,产物的峰面积最大;添加50和100 µl时,响应值较低,可能是由于衍生化试剂量不足导致了衍生化反应不完全;而添加400和500 µl BSTFA时,衍生化产物的响应值反而降低,可能是由于衍生化试剂过多,结束反应后氮吹除去多余衍生化试剂的时间过长,造成了产物部分损失;同时,样品量过大时,成本也是考虑因素之一,降低衍生化试剂的添加量,能够直接降低衍生化成本,并且可以获得较好的衍生化效果,因此,衍生化反应过程中添加200 µl BSTFA较合适。
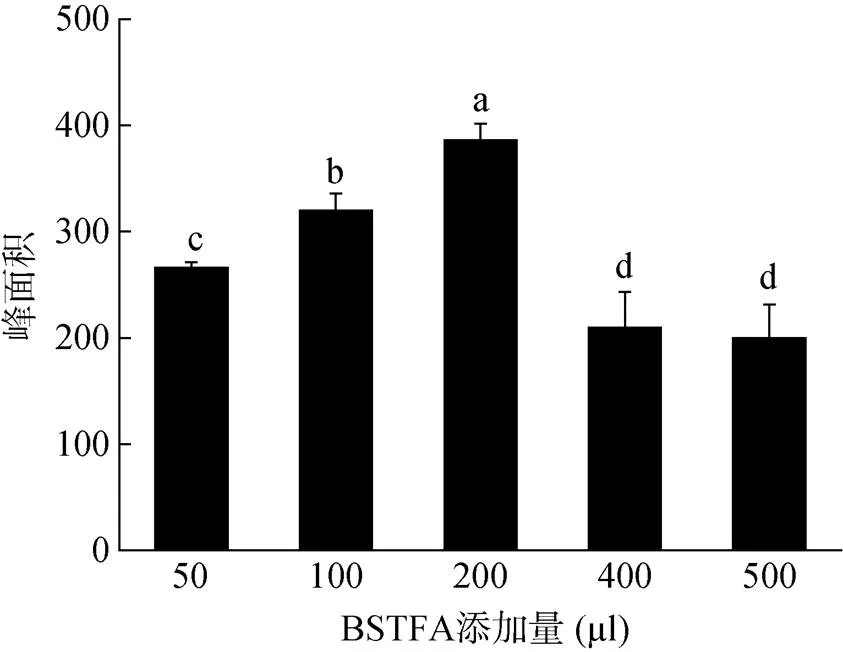
图2 不同衍生化试剂BSTFA添加量对1,9-癸二醇衍生化产物响应值的影响(n = 3)
分别向装有标准物质1,9-癸二醇的螺口试管中加入200 μl BSTFA衍生化反应30、45、60、90、120 min,比较5个不同的衍生时间对衍生效果的影响。结果如图3所示,1,9-癸二醇的衍生化产物在反应30 min 时已经有较高的响应值,而随着反应时间(45、60、90、120 min)的增加,产物的峰面积并无显著变化。该结果与雌激素类物质、烟草中的游离糖类、药用植物长春花中的五环三萜类化合物的衍生化时间一致[21, 27, 34-35],说明衍生化反应进行迅速,在30 min时已经反应完全,增加反应时间并不能提高衍生化产物的响应值。因此,1,9-癸二醇衍生化反应中衍生化时间控制在30 min即可。
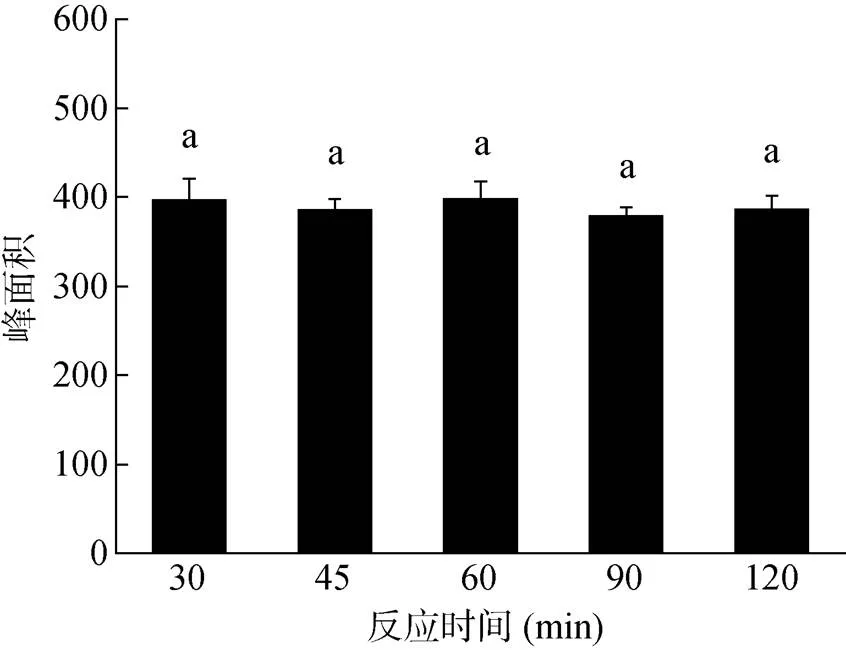
图3 不同衍生化时间对1,9-癸二醇衍生化产物响应值的影响(n = 3)
调节烘箱温度分别至60 ℃、80 ℃,比较两个衍生化温度对1,9-癸二醇标样衍生化效果的影响,图4结果表明当反应温度设定为60 ℃时,1,9-癸二醇衍生化产物的响应值约为390,而升高反应温度至80 ℃时,衍生化产物的响应值显著降低至260左右,这说明80 ℃衍生反应可能不完全,产物响应值低,并且导致柱流失严重,因此过高的温度对于检测效果的提升并没有太大的效果[22],该结论与王欣等[21]的研究一致;此外,值得注意的是本研究中选择烘箱加热的方法,因为硅烷化试剂及其衍生化产物对湿度极其敏感,常需要采取密封措施以防止水蒸气致其失活[36],而相比于传统的水浴方法,采用烘箱加热的方式能够有效避免水蒸气的干扰,同时能够提供稳定的热源,精确调节温度[37]。因此,经过对1,9-癸二醇衍生化过程的优化,最终确定其衍生化条件为200 µl BSTFA,干燥烘箱60 ℃加热30 min。
2.3 仪器的精密度及准确度
校准曲线:依次取0 ~ 10.00 µg/ml 的标准样品,按最优化条件测定,以1,9-癸二醇峰面积为纵坐标(),以1,9-癸二醇浓度为横坐标(),进行线性回归,方程为= 34.77– 0.90,= 0.999 3。说明1,9-癸二醇在所取的浓度范围内其浓度和目标峰面积呈良好线性关系(表2)。
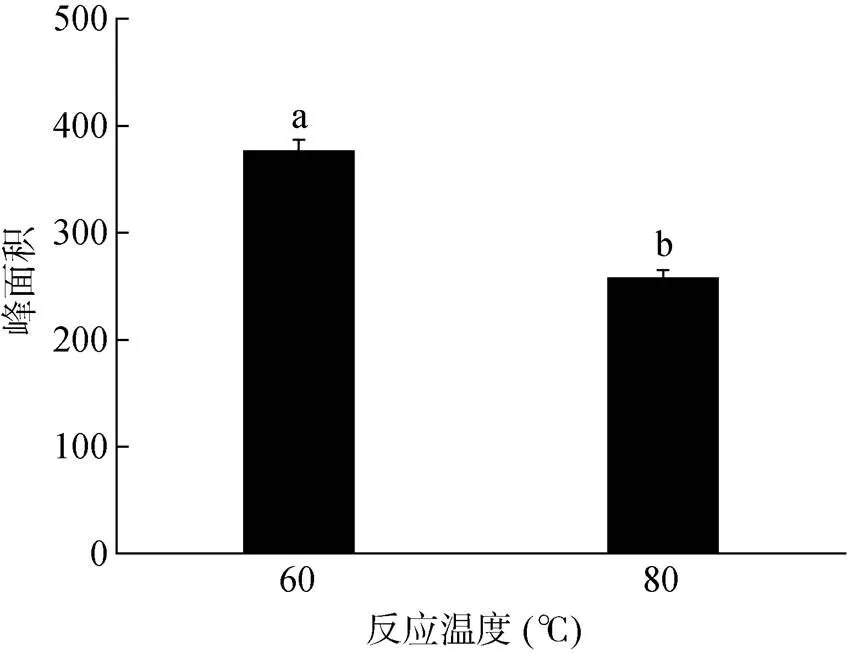
图4 不同衍生化温度对1,9-癸二醇衍生化产物响应值的影响(n = 3)
仪器精密度:加标浓度为10.00 µg/ml,日内和日间平行测定6次加标样[38-39],目标物质1,9-癸二醇响应面积的相对标准偏差(RSD)分别为2.18% 和3.01%,RSD < 5%,结果表明该方法精密度良好(表2)。
仪器检出限:3倍信号噪声比所对应的样品浓度,并与较低的相近浓度的标样信号值相比较,算得仪器的检出限为0.05 µg/ml(表2)。

表2 仪器精密度、检出限及回收率(n = 6)
样品加标回收率:加标量为10.00 µg/ml,连续测定6 个加标样,按上述线性方程算得相应目标物的测定浓度,得回收率为94.42%(表2),符合有机样品的分析要求。
2.4 水稻根系分泌物样品中1,9-癸二醇的测定
采用以上试验中优化后的条件富集和测定水稻根系分泌物中的1,9-癸二醇的含量,C18固相萃取柱可以有效净化和浓缩水稻根系分泌物收集液中的生物硝化抑制剂1,9-癸二醇,并且该物质经过BSTFA衍生化后在6.92 min 出现明显响应峰,通过标准曲线可计算出不加氮处理的样品提取物中1,9-癸二醇的浓度约为0.10 µg/ml,加氮处理的样品提取物中1,9-癸二醇的浓度约为0.32 µg/ml,两者之间差异显著,说明添加1 mmol/L NH4Cl能够显著增强根系1,9-癸二醇的分泌。该测定结果重复性好, RSD < 5%,说明该方法适用于测定水稻根系分泌物样品中1,9-癸二醇的含量。
3 结论
由上述1,9-癸二醇衍生化优化的试验以及样品测定结果,确定使用固相萃取法纯化、富集根系分泌物中的目标物质1,9-癸二醇,并使用BSTFA作为衍生化试剂,在烘箱60 ℃加热30 min进行衍生化反应,样品经过气相色谱法分析得到的分析效果最好。本方法的校准曲线、仪器的精密度及检出限均可达到有机分析的要求,并且该方法操作简便、灵敏度高,为水稻根系分泌物中1,9-癸二醇的定量分析提供了参考。
[1] Vitousek P M, Aber J D, Howarth R W, et al. Human alteration of the global nitrogen cycle: Sources and consequences[J]. Ecological Applications, 1997, 7(3): 737–750.
[2] 朱兆良. 农田中氮肥的损失与对策[J]. 土壤与环境, 2000, 9(1): 1–6.
[3] 胡克林, 李保国, 黄元仿, 等. 农田尺度下土体硝酸盐淋失的随机模拟及其风险性评价[J]. 土壤学报, 2005, 42(6): 909–915.
[4] McCarty G W. Modes of action of nitrification inhibitors[J]. Biology and Fertility of Soils, 1999, 29(1): 1–9.
[5] 武志杰, 史云峰, 陈利军. 硝化抑制作用机理研究进展[J].土壤通报, 2008, 39(4): 962–970.
[6] Lan T, Han Y, Roelcke M, et al. Effects of the nitrification inhibitor dicyandiamide (DCD) on gross N transformation rates and mitigating N2O emission in paddy soils[J]. Soil Biology and Biochemistry, 2013, 67: 174–182.
[7] Cahalan E, Minet E, Ernfors M, et al. The effect of precipitation and application rate on dicyandiamide persistence and efficiency in two Irish grassland soils[J]. Soil Use and Management, 2015, 31(3): 367–374.
[8] Qiu H D, Sun D D, Gunatilake S R, et al. Analysis of trace dicyandiamide in stream water using solid phase extraction and liquid chromatography UV spectrometry[J]. Journal of Environmental Sciences, 2015, 35: 38–42.
[9] Subbarao G V, Ishikawa T, Ito O, et al. A bioluminescence assay to detect nitrification inhibitors released from plant roots: a case study with Brachiaria humidicola[J]. Plant and Soil, 2006, 288(1/2): 101–112.
[10] O’Sullivan C A, Fillery I R P, Roper M M, et al. Identification of several wheat landraces with biological nitrification inhibition capacity[J]. Plant and Soil, 2016, 404(1/2): 61–74.
[11] Zhu Y Y, DI T J, XU G H, et al. Adaptation of plasma membrane H+-ATPase of rice roots to low pH as related to ammonium nutrition[J]. Plant, Cell & Environment, 2009, 32(10): 1428–1440.
[12] Zhu Y Y, Zeng H Q, Shen Q R, et al. Interplay among NH4+uptake, rhizosphere pH and plasma membrane H+-ATPase determine the release of BNIs in sorghum roots - possible mechanisms and underlying hypothesis[J]. Plant and Soil, 2012, 358(1/2): 131–141.
[13] Sun L, Lu Y F, Yu F W, et al. Biological nitrification inhibition by rice root exudates and its relationship with nitrogen-use efficiency[J]. New Phytologist, 2016, 212(3): 646–656.
[14] Zhang X N, Lu Y F, Yang T, et al. Factors influencing the release of the biological nitrification inhibitor 1, 9-decanediol from rice (L.) roots[J]. Plant and Soil, 2019, 436(1/2): 253–265.
[15] Lu Y F, Zhang X N, Jiang J F, et al. Effects of the biological nitrification inhibitor 1,9-decanediol on nitrification and ammonia oxidizers in three agricultural soils[J]. Soil Biology and Biochemistry, 2019, 129: 48–59.
[16] Vidal L, Riekkola M L, Canals A. Ionic liquid-modified materials for solid-phase extraction and separation: A review[J]. Analytica Chimica Acta, 2012, 715: 19–41.
[17] Wen Y Y, Chen L, Li J H, et al. Recent advances in solid-phase sorbents for sample preparation prior to chromatographic analysis[J]. TrAC Trends in Analytical Chemistry, 2014, 59: 26–41.
[18] Muratova A, Dubrovskaya E, Golubev S, et al. The coupling of the plant and microbial catabolisms of phenanthrene in the rhizosphere of Medicago sativa[J]. Journal of Plant Physiology, 2015, 188: 1–8.
[19] 陈宪华. 水中有机物污染物分析的前处理方法及研究进展[J]. 中国公共卫生, 1997, 13(9): 562.
[20] 张月琴, 吴淑琪. 水中有机污染物前处理方法进展[J]. 分析测试学报, 2003, 22(3): 106–109.
[21] 王欣, 顾弘理, 沈剑, 等. 气相色谱—质谱分析5种雌激素类物质的衍生化方法优化[J]. 环境污染与防治, 2018, 40(8): 890–895.
[22] Zuo Y G, Zhang K, Lin Y J. Microwave-accelerated derivatization for the simultaneous gas chromatographic-mass spectrometric analysis of natural and synthetic estrogenic steroids[J]. Journal of Chromatography A, 2007, 1148(2): 211–218.
[23] Liu R, Zhou J L, Wilding A. Simultaneous determination of endocrine disrupting phenolic compounds and steroids in water by solid-phase extraction-gas chromatography-mass spectrometry[J]. Journal of Chromatography A, 2004, 1022(1/2): 179–189.
[24] Zhou Y Q, Wang Z J, Jia N. Formation of multiple trimethylsilyl derivatives in the derivatization of 17α-ethinylestradiol with BSTFA or MSTFA followed by gas chromatography-mass spectrometry determination[J]. Journal of Environmental Sciences, 2007, 19(7): 879–884.
[25] Schummer C, Delhomme O, Appenzeller B M R, et al. Comparison of MTBSTFA and BSTFA in derivatization reactions of polar compounds prior to GC/MS analysis[J]. Talanta, 2009, 77(4): 1473–1482.
[26] Sánchez-Brunete C, Miguel E, Tadeo J L. Determination of tetrabromobisphenol-A, tetrachlorobisphenol-A and bisphenol-A in soil by ultrasonic assisted extraction and gas chromatography-mass spectrometry[J]. Journal of Chromatography A, 2009, 1216(29): 5497–5503.
[27] 周斌, 张承明, 张承聪, 等. 烟草中游离糖类的BSTFA衍生化与气相色谱-质谱联用分析方法研究[J]. 云南民族大学学报(自然科学版), 2007, 16(3): 239–242.
[28] 陈啟荣, 郎爽, 魏岩, 等. 气相色谱-质谱法测定电子产品中四溴双酚-A[J]. 分析试验室, 2011, 30(4): 62–64.
[29] Bowden J A, Ford D A. An examination of pentafluorobenzoyl derivatization strategies for the analysis of fatty alcohols using gas chromatography/electron capture negative ion chemical ionization-mass spectrometry[J]. Journal of Chromatography B, 2011, 879(17/18): 1375–1383.
[30] Gopalakrishnan S, Watanabe T, Pearse S J, et al. Biological nitrification inhibition by Brachiaria humidicola roots varies with soil type and inhibits nitrifying bacteria, but not other major soil microorganisms[J]. Soil Science and Plant Nutrition, 2009, 55(5): 725–733.
[31] 钟仕花, 葛虹, 周娟, 等. 固相萃取——高效液相色谱法测定虾中环丙沙星[J]. 水产科技, 2009(3): 22–24.
[32] 蔡素婷. 酚类内分泌干扰物的气相色谱质谱法研究及应用[D]. 重庆: 重庆大学, 2012.
[33] 王彬, 董发勤, 代群威, 等. BSTFA-GC-MS联用技术分析测定痕量酚类内分泌干扰物[J]. 化学研究与应用, 2016, 28(4): 553–557.
[34] Zhang Z L, Hibberd A, Zhou J L. Optimisation of derivatisation for the analysis of estrogenic compounds in water by solid-phase extraction gas chromatography-mass spectrometry[J]. Analytica Chimica Acta, 2006, 577(1): 52–61.
[35] Huang L L, Li J, Ye H C, et al. Molecular characterization of the pentacyclic triterpenoid biosynthetic pathway in Catharanthus roseus[J]. Planta, 2012, 236(5): 1571–1581.
[36] Shareef A, Angove M J, Wells J D.Optimization of silylation using N-methyl-N-(trimethylsilyl)-trifluoroacetamide,-bis-(trimethylsilyl)-trifluoroacetamide and-(tert-butyldimethylsilyl)--methyltrifluoroacetamide for the determination of the estrogens estrone and 17α- ethinylestradiol by gas chromatography - mass spectrometry[J]. Journal of Chromatography A, 2006, 1108: 121– 128.
[37] 栾忠平, 段加玉, 陈媛媛, 等. 烘箱加热法测定森林土壤有机质的研究[J]. 吉林林业科技, 2017, 46(3): 17–19, 34.
[38] 陈虹, 韩勇, 王曦, 等. 优化顶空-气相色谱/质谱联用法测定水中苯系物[J]. 土壤学报, 2013, 50(5): 991–996.
[39] 许原. 气相色谱法测定白酒中甲醇含量条件优化[J]. 云南民族大学学报, 2015, 24(6): 468–471.
Optimized Determination of Biological Nitrification Inhibitor 1,9-decanediol in Rice Root Exudates
ZHANG Xiaonan1,2, LU Yufang1, YANG Ting1,2, SHI Weiming1*
(1 State key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 2University of Chinese Academy of Sciences, Beijing 100049, China)
The optimized pre-treatment and derivatization methods were developed in this study for the determination of 1,9-decanediol by gas chromatograph in the rice root exudates. Results showed that the C18SPE column could retain 1,9-decanediol efficiently and its relative recovery rate (82.97%) had no significant difference with that of the rotary evaporation (80.17%). This method is time-saving and fit for concentrating the identified hydrophobic BNI-compound, 1,9-decanediol, in large amount of root exudates solutions. In addition, the use of N,O-bis (trimethylsily) trifluoroacetamide (BSTFA, 200 µl) as derivatization reagent, together with 30 min heating in the oven at 60 ℃, was found to be the most efficient method for stable derivatives and high sensitivity. The linear equation was=34.77-0.90 (= 0.999 3); the 1,9-decanediol detection limit of the method was 0.05 µg/ml; and the method exhibited good accuracy (recoveries of 94.42%) and precision (within-day precision of 2.18% and day-to-day precision of 3.01%) which could provide reference for the subsequent analysis of 1,9-decanediol in rice root exudates.
Nitrification; Rice; 1,9-decanediol; Biological nitrification inhibitors; Quantification
S145.9
A
10.13758/j.cnki.tr.2020.06.008
张晓楠, 陆玉芳, 杨婷, 等. 水稻生物硝化抑制剂1,9-癸二醇的定量方法优化. 土壤, 2020, 52(6): 1152–1157.
国家自然科学基金重点项目(31761143015), 江苏省优秀青年基金项目(Bk20190108)和南京土壤研究所“一三五”计划和领域前沿项目(ISSASIP1606)资助。
(wmshi@issas.ac.cn)
张晓楠(1990—),女,河南开封人,博士研究生,主要从事水稻根系分泌物中硝化抑制物质的鉴定和作用机制研究。E-mail: xnzhang@issas.ac.cn

