不同长势古树土壤真菌群落组成和多样性
黎炜彬 严朝东 张 浩 苏纯兰 陈葵仙 刘颂颂
(1.东莞市林业科学研究所,广东 东莞 523000;2.香港园艺专业学会,香港 999077)
珍稀罕有的古树名木,是我国林业资源的瑰宝,也是生物多样性保护的重要组成部分[1]。古树名木易受当地自然环境、风俗人情、历史文化以及社会发展等因素影响。由于古树树龄大,树势较一般植株衰弱,抵抗病原菌侵害能力低下,往往存在空洞或枯木现象,故此,易被有害菌、如木材腐朽菌等侵染[2]。土传性木材腐朽菌是导致木材腐朽病的主要病原菌之一[3]。尽管我国对林木土壤真菌多样性的研究较广泛,但主要集中于森林公园及各种植被比较丰富的自然保护区[4-8],对于古树名木根际土壤真菌群落组成与多样性的报道却极为匮乏。
植物根际真菌是土壤中重要的分解者,参与生态系统中的物质循环、能量流动和信息传递[9-10]。土壤真菌在分解地表枯落物、矿化有机质、提升土壤质量和为植物根系提供营养等方面发挥着重要作用[11]。探究真菌在古树名木根际土壤中的群落构成及其多样性特征,对古树名木保护具有重要指导意义。近年来对古树名木的土壤真菌多样性研究以分离培养法为主,但该方法通常实验周期长、准确率不高、操作难度大,不能实现快速有效检测与评价的目的[12]。古树名木根际土壤真菌总量大,群落组成复杂,且较大部分的真菌难以通过上述方法分离,因此传统的分离培养法并不能全面地反映土壤真菌群落的多样性[13]。目前,关于微生物分类鉴定或系统发育等方面的研究,主要的技术方案是内转录间隔区(ITS)鉴定[14]。第2代基因测序技术具有通量大、时间短、成本低、读取长度适中等优点,与rDNA转录区相比,ITS具有更高的突变率,可以准确地分类具有遗传关系的菌株[15],在环境生态[16-17]、医学医疗等有关研究领域得到广泛应用。
东莞市(22°39′~23°09′N,113°31′~114°15′E)地处广东省中南部,珠江口东岸,东江下游的珠江三角洲,属亚热带季风气候,年均气温为23.1 ℃,年均日照时数为1 873.7 h,年降水量为1 800 mm以上,地带性植被主要为热带季风常绿阔叶林,是森林植物易繁衍的区域。古树名木由于生长环境不同,健康状况各异,可能会导致其土壤真菌的群落组成与多样性有差异。本研究以东莞市3种长势(正常、衰弱和濒危)的古树名木为对象,运用第2代高通量DNA测序技术(Illumina MiSeq平台),探明上述3种长势古树名木根际土壤真菌的群落构成与多样性特点,旨在揭示古树名木长势和土壤真菌群落的关系,为古树名木的健康预警和精准保护提供参考。
1 材料与方法
1.1 古树名木调查与长势评价
2019年初,对东莞全市古树名木进行实地调查。研究对象为广东省古树名木信息管理系统(http://121.33.231.227:8070/)[18]中具有木腐病症状的古树名木及其根际土壤。初步筛选出疑似患病古树名木75株,其中散生54株,群生21株。1级古树5株,2级古树8株,3级古树60株,名木2株,隶属于24科46属54种。疑患木腐病古树名木以细叶榕(Ficus microcarpa)为主,占总株数40%,其余潺槁树(Litsea glutinosa)、刺桐(Erythrina variegata)及土沉香(Aquilaria sinensis)等52种古树名木每种仅有1~2株。据调查显示[19],上述古树名木根际土壤包括赤红壤、山地红壤及山地黄壤等,土壤平均pH值为4.42。
长势评价参考苏纯兰等[20]的古树健康状况评价标准(表1),并根据调查情况作出修改,共设正常(ZC)、衰弱(SR)和濒危(BW)3个长势组,每个调查点采样与评价面积为古树名木的滴水面积。

表1 东莞市古树名木长势评价描述Table 1 Evaluation and description of growth potential of ancient and famous trees in Dongguan City
1.2 土壤样品采集
基于对古树名木的保护,本次取样将采自大树、古树5~20 cm土层侧根或须根系表面0.5~1 cm范围内的土壤视为根际土壤,每株疑似患病古树随机选取3~5个样点,采集时用采样铲除去地表的杂物及洞口的大枝条和树叶,多点采集的根际土壤充分混合后置于无菌自封袋中,合计75份土样,以广东省古树统一编号命名并暂存于干冰泡沫箱内,不设置重复。带回实验室后于4 ℃下保存,长期保存的土壤速冻后于-80 ℃保存。土壤预处理:土壤样品先除去其中的石子和动植物残体等异物、过20目标准筛(≤0.85 mm),储存于4 ℃备用。
1.3 总DNA提取与高通量测序
称取0.5 g新鲜土样,采用E.Z.N.A.®soil试剂盒(Omega Biotek,Norcross,GA,U.S.)提取土壤微生物的总DNA,然后采用 Power Clean®DNA Clean-up Kit(MoBio,CA,USA)对提取的DNA进行纯化,DNA浓度和纯度利用 NanoDrop2000(Thermo,USA)进行检测,再利用1% 琼脂糖凝胶电泳检测DNA提取质量,最后放置–20 ℃冰箱中保存备用。对每份样品,采用引物ITS3F/ITS4R(ITS3F∶5′-GCATCGATGAAGAACGCAGC-3′,ITS4R:5′-TCCTCCGCTTATTGATATGC-3′)扩增ITS片段[21],PCR步骤按试剂盒说明书进行操作。使用2% 琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union-City CA,USA)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用Quanti-Fluor™-ST(Promega,USA)对PCR产物进行检测定量。根据Illumina MiSeq平台(Illumina,San Diego,USA)标准操作规程将纯化后的扩增片段构建PE2*300的文库。构建文库步骤:连接“Y”字形接头;使用磁珠筛选去除接头自连片段;利用PCR扩增进行文库模板的富集;氢氧化钠变性,产生单链DNA片段。利用Illumina公司的MiSeq PE300平台进行测序(上海美吉生物医药科技有限公司)。原始数据上传至NCBI数据库中。
1.4 数据处理及生物信息学分析
数据下机后,使用Trimmomatic软件对原始测序序列进行质控,使用FLASH软件进行拼接:设置50 bp的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,去除质控后长度低于50 bp的序列;barcode需精确匹配,引物允许2个碱基的错配,去除模糊碱基;根据重叠碱基overlap将两端序列进行拼接,overlap需大于10 bp。去除无法拼接的序列。
使用UPARSE软件(version 7.1 http://drive5.com/uparse/),根据97% 的相似度对序列进行分类单元(operational taxonomic units,OUT)聚类;使用UCHIME软件剔除嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对Unite ITS 8.0数据库,设置比对阈值为70%。使用I-sanger生信云系统,计算各样本(组)共有或特有的OTU数量与α多样性指数;基于UniFrac距离算法NMDS(non-metric multidimensional scaling)和ANOSIM(analysis of similarities)对各种长势古树名木根际土壤的真菌群落组成及β多样性进行分析,通过对样本(组)间距离判断其差异大小;设置LDA(linear discriminant analysis)score的阈值为2,对各种长势组的差异真菌进行分析,找出不同长势中具有显著性差异的真菌物种。本研究运用SPSS 24.0中单因素方差分析法判断古树名木不同长势对其土壤真菌α多样性指数的影响,运用最小显著差异法(LSD)(P<0.05)进行显著性检验。
2 结果与分析
2.1 古树名木长势
经过长势评价,正常组为48株,占总株数64.0%,其中古树46株,名木2株;衰弱组为22株,占总株数29.3%;濒危组为5株,占总株数6.7%。正常组古树名木长势较好,典型的症状出现在树冠,异常叶片平均比例为15.3%,枯枝平均比例为7.5%,偶见枯枝掉落。衰弱组古树出现一定范围的损伤,异常叶片平均比例为43.8%,枯枝平均比例为27.5%,树冠某处集中出现枯枝,树干有明显空洞。濒危组古树损伤严重,异常叶片平均比例为81.4%,枯枝平均比例为72.8%,树木衰变,木材形成层活动减慢,树冠稀疏,枯枝较多。
2.2 土样测序结果
通过对古树名木根际土壤真菌的ITS鉴定,75个土壤样品一共获得5 092 652条高品质序列。供试土样序列经过OTU聚类处理,3个长势组共有11 293个OTUs。所有土样的稀释曲线随有效序列数目增加而逐渐平缓(图1),说明本次取样基本能反映真实环境,3个长势组土壤真菌群落情况置信度较高。由图2a的Venn图可以看出,不同长势古树名木根际土壤中真菌OTU数目中,ZC获得的OTU数目最多(9 486),其次是SR(6 911),BW最低(2 982)。3个长势组土壤共有的OTU数目较多(2 195),同时在纲水平的Venn图显示(图2b),3个长势组样点共有真菌45纲。
2.3 3种长势古树名木土壤真菌群落组成及物种差异
3种长势75个土样的OTU有效序列经分析鉴定出17门、67纲、176目、418科、1 078属、2 101种的真菌学名。由图3可知,3个长势组土壤真菌群落门水平上主要属于9个类群,主要包括子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、分类地位未鉴定真菌(unclassified_k_Fungi)、被孢霉门(Mortierellomycota)、罗兹菌门(Rozellomycota)、壶菌门(Chytridiomycota)、球囊菌门(Glomeromycota)、梳霉门(Kickxellomycota)和捕虫霉门(Zoopagomycota)。

图1 3个长势组土样稀释曲线Fig.1 Dilution curves of soil sample in 3 growing groups

图2 3个长势组土壤真菌韦恩图Fig.2 Venn diagram of soil fungi in 3 growing groups

图3 3种长势古树名木土壤真菌门水平上的群落丰度Fig.3 Community abundance at the level of phylum of soil fungi of 3 species of ancient and famous trees
由图4可知,3个长势组土壤真菌群落纲水平上主要属于12个类群,主要包括粪壳菌纲(Sordariomycetes)、伞菌纲(Agaricomycetes)、散囊菌纲(Eurotiomycetes)、银耳纲(Tremellomycetes)、分类地位未鉴定真菌(unclassified_k_Fungi)、座囊菌纲(Dothideomycetes)、分类地位未鉴定子囊菌门真菌(unclassified_p_Ascomycota)、被孢霉纲(Mortierellomycetes)、分类地位未鉴定罗兹菌门真菌(unclassified_p_Rozellomycota)、分类地位未鉴定罗兹菌亚门真菌(Rozellomycotina_cls_incertae_sedis)、盘菌纲(Pezizomycetes)和锤舌菌纲(Leotiomycetes)。
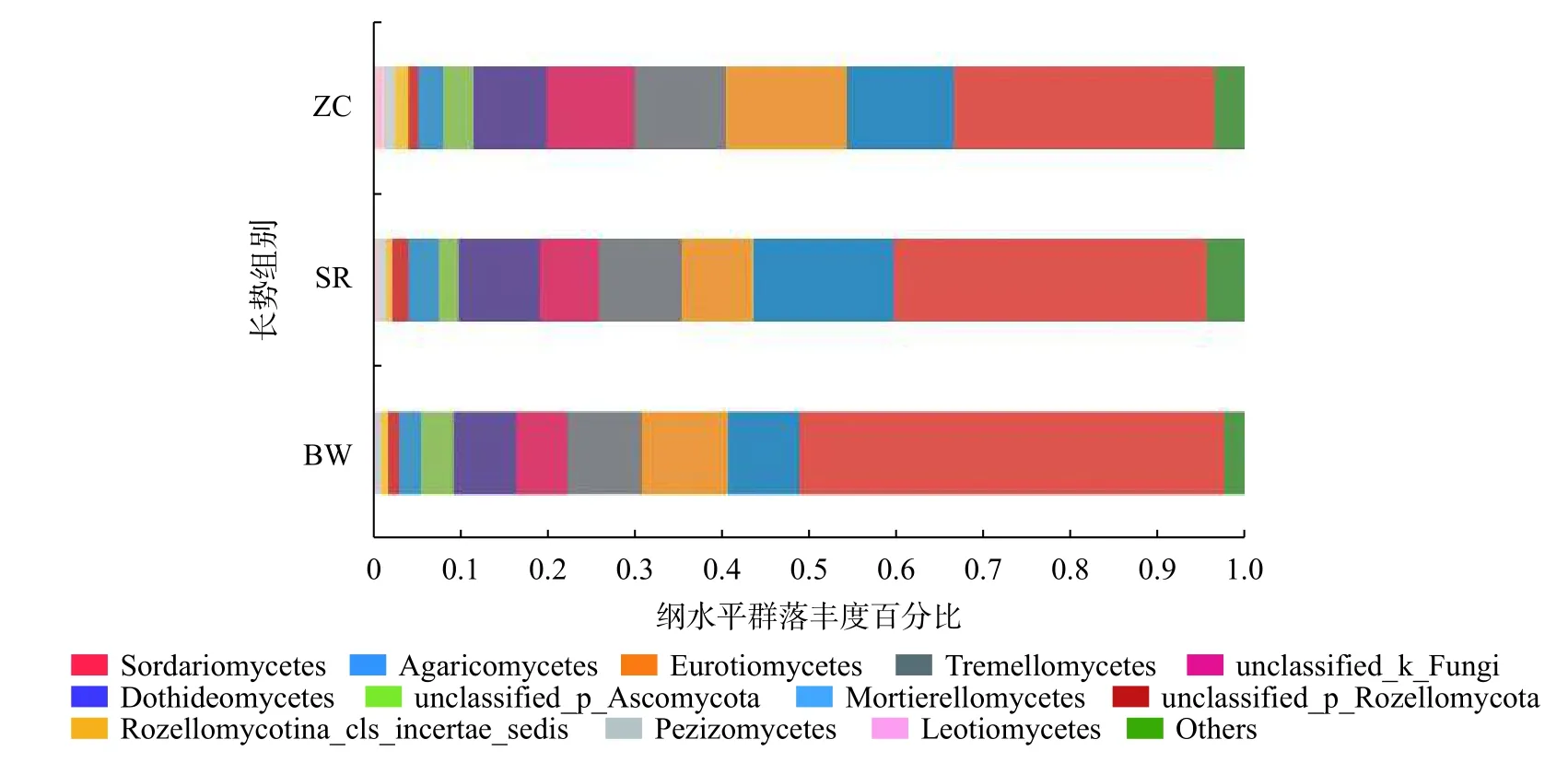
图4 3种长势古树名木土壤真菌纲水平上的群落丰度Fig.4 Community abundance at the level of class of soil fungi of 3 species of ancient and famous trees
在属分类水平上,忽略相对丰度小于1%的菌属不计,3种长势的古树名木根际土壤真菌共有35属(图5);各个长势组均含有相当一部分真菌未被分类,相对丰度在25%~35%。

图5 3 种长势古树名木土壤真菌属水平上的群落丰度Fig.5 Community abundance at the level of genus of soil fungi of 3 species of ancient and famous trees
根据LEfSe分析的LDA判别分值,由表2可知,在纲分类水平上,BW组土壤中粪壳菌纲与其他2个长势组差异显著。3个长势组有显著差异的真菌属总计36个,其中BW组古树名木土壤中差异显著的真菌属最多,共28个;ZC组与SR组有显著差异的真菌属数量相同,各有4个。

表2 3种长势古树名木土壤真菌门和属的LDA分值(差异显著)Table 2 LDA scores of soil fungi of 3 species of ancient and famous trees (significant difference)
2.4 3种长势古树名木土壤真菌群落多样性分析
2.4.1 α多样性分析
通过采用Chao1算法和Ace算法估算群落中OTU数目,反映土壤真菌群落物种丰富度;采用Shannon指数和Simpson指数说明土壤真菌群落的多样性。由表3可知,Chao指数和Ace指数由大到小排列依次为:SR>BW>ZC,其中SR的Ace指数与ZC差异显著(P<0.05)。各长势组的香农指数由大到小排列依次为:BW>SR>ZC,辛普森指数排序为:SR>ZC>BW,但差异均不显著。

表3 不同长势古树名木土壤真菌生境内多样性指数(α多样性指数)Table 3 Soil fungi within-habitat diversity index of ancient and famous trees with different growth potentials (α diversity index)
2.4.2 β多样性分析
基于unweighted UniFrac距离算法,对3种长势古树名木土壤真菌群落OTU进行非度量多维尺度分析(NMDS分析),结果见图6。3个长势组的土壤真菌群落距离较近,ZC组范围最大,基本包含其他2组的真菌群落,范围大小关系为:ZC>SR>BW。为了检验群落组成结构差异的显著性,进行组间相似性分析(ANOSIM),结果表明3种长势古树名木土壤真菌群落OTU组成相似,且差异不显著(R=-0.081,P=0.889)。

图6 3种长势古树名木土壤真菌群落基于unweighted UniFrac距离的非度量多维尺度分析Fig.6 Non-metric multi-dimensional scale analysis of soil fungal communities of 3 species of ancient and famous trees based on unweighted UniFrac distance
3 结论与讨论
Illumina MiSeq高通量测序技术的发展为快速有效分析微生物群落结构和组成提供了一个强大而高效的平台[22]。部分学者指出,在不同的生境中,微生物群落的总体组成或许存在较大差异,但优势菌群基本相似[17]。结果表明:子囊菌门和担子菌门是3种长势古树名木土壤真菌的优势菌门,其含量均高于70%。这2类菌在3个长势组中丰度各异,其中子囊菌门在濒危组中的相对丰度最高,正常组次之,衰弱组最低,在各组的含量分别为71.38%、59.68%及59.20%;担子菌门在衰弱组的相对丰度最高,正常组次之,濒危组最低,在各组的含量分别为26.15%、23.42%及17.01%。熊丹等[23]利用第2代基因测序技术(Illumina平台)对贵阳市3个地区的马尾松-杜鹃群落中杜鹃根围土壤真菌群落分析,结果在调查区域中一共发现土壤真菌9门296属,其中相对丰度最高的是子囊菌门和担子菌门,这与本研究结果相一致。按属水平分类,3种长势古树名木根际土壤中均含有部分真菌未被分类,在已分类的真菌属中,丰富度由至高低排序分别为Saitozyma、曲霉属(Aspergillus)、毛壳菌属(Chaetomium)、被孢霉属(Mortierella)、毛孢子菌属(Trichosporon)、灵芝属(Ganoderma)、青霉属(Penicillium)、Apiotrichum、新赤壳属(Neocosmospora)等,其中以Saitozyma、曲霉属、毛壳菌属、被孢霉属、毛孢子菌属、灵芝属和青霉属为优势菌属。部分优势菌属与相关研究结果一致,如董爱荣等[24]对红松(Pinus koraiensis)林土壤真菌多样性的研究指出,小兴安岭地区土壤真菌的优势属为接合菌纲的被孢霉属、子囊菌纲的青霉属以及丝孢纲的木霉属和轮枝孢属(Verticilium)。贾丽等[25]对天水小陇山白皮松(Pinus bungeana)林的土壤真菌多样性的研究表明,真菌的多样性指数在不同样地差异较大,优势菌群为子囊菌纲的青霉属和子囊菌纲曲霉属。
本研究对3个长势组古树名木根际土壤真菌生境内多样性(α指数)分析可知,受损古树名木(衰弱组和濒危组)根际土壤真菌群落丰度指数(Ace和Chao指数)大于健康的古树名木(正常组)。不同的森林类型或植物种类[26],其土壤微环境[27]或地表枯落物可利用率各异[28],从而影响土壤真菌群落组成结构。通过改变土壤环境[29],植物使土壤微生物的群落结构发生分异,影响其物种多样性[17,30]。对3种长势古树名木根际土壤真菌进行群落组成与多样性分析,可以为古树名木的管护和人工复壮提供科学依据。此外,3个长势组土壤高通量测序结果显示有大量真菌ITS序列未被鉴定,这些未知菌株尚待下一步的分析。
由结果可知,东莞市古树名木大部分都有一定程度损伤,但总体长势良好。3种长势古树名木根际土壤真菌群落以粪壳菌、伞菌和散囊菌3个菌纲为优势菌。结合土壤真菌OTU丰度与物种系统发育距离矩阵分析,3种长势古树名木土壤真菌群落组成无明显差异。正常长势组古树名木长势优于衰弱长势组和濒危长势组,导致土壤真菌群落丰富度低于衰弱长势组和濒危长势组,古树名木的长势及健康状况对其土壤真菌群落组成有一定影响。

