不同种类及浓度的植物生长调节剂对具鳞水柏枝扦插生根的影响
李 波 魏科宇 王丽华
(1.中国科学院山地生态恢复与生物资源利用重点实验室,生态恢复与生物多样性保育四川省重点实验室,中国科学院成都生物研究所,四川 成都 610041;2.阿坝师范学院资源与环境学院,四川 阿坝 623002)
我国高海拔地区拥有丰富的野生植物资源,其中不乏观赏性和生态价值兼具,且有较强适应性的本土物种。但受气候条件和重视程度不够的影响,导致对于这类植物的开发利用相对滞后。因此,以扦插作为植物快速繁育技术手段打破高海拔地区植物生长缓慢的劣势,深入挖掘这些高海拔植物的潜在价值,不仅能丰富园林景观物种和缓解高海拔地区苗木资源的短缺的问题,同时也利于本土植物生物多样性的保护,进而推动高海拔地区生态保护和经济的发展。
具鳞水柏枝(Myricaria squamosa)是一种可观花观型,叶和枝干四季呈不同颜色变化的园林理想植物,同时强大的根系使其具有一定防风固沙的能力[1],可以说兼具较高的观赏价值和生态价值。前人研究主要集中于宽苞水柏枝(Myricaria bracteata)[2]和疏花水柏枝(Myricaria laxiflora)[3-5]的扦插培育等方面的内容,然而关于具鳞水柏枝的研究相对较少。同时具鳞水柏枝的种子生命力短,种子萌发率较低,种繁技术对于大面积推广种植并不适用,而扦插则是快速繁殖的有效手段,满丽婷等[6]对具鳞水柏枝扦插繁育的试验表明,在吲哚乙酸(IBA)处理下的枝条的成活高达95%,而徐海平[1]对具鳞水柏枝的进行扦插试验,成活率达77.53%。相关研究表明[6-10],植物生长调节剂的使用对于植物扦插繁殖生根率的提高有显著的促进作用,植物生长调剂的选择应用,也是提高扦插生根率的关键因素之一。但目前对于在短时间内提高具鳞水柏枝的生根率以及成活率的研究相对较少。
基于以上,本研究将通过设置不同扦插处理条件,分析和对比具鳞水柏枝的生根率以及根系相关指标,进而深入了解扦插生长情况,寻求最佳扦插方案。以期形成初步的具鳞水柏枝嫩枝扦插繁殖技术,为解决高海拔地区生态环境的治理和园林绿化中苗木匮乏的问题提供一定的理论依据和数据支撑。
1 材料与方法
1.1 试验设施概况
试验地位于四川省阿坝藏族羌族自治州汶川县水磨镇阿坝师范学院苗圃基地温室大棚(30°92′64″N、103°41′24″E)[11],该区域气候为亚热带季风气候,冬季严寒、夏季多雨,海拔975 m。大棚内设置扦插苗床1个,扦插苗床为砖混结构,在苗床底部铺设1层地膜,以防止杂草的生长,同时在苗床底部铺设约20 cm的碎石,以增加苗床的滤水性,在不同苗床上分别铺设约20 cm的混合型基质。试验大棚内装设自动喷雾设备,棚外设置透光率为75%的遮阳网,白天温室内温度应保持在25 ℃左右,最高温度不超过35 ℃,空气相对湿度保持在80%及以上。
1.2 试验材料
于2019年4月底在四川省阿坝藏族羌族自治州理县毕棚沟景区内(31°13′34″N,102°52′00″E,海拔约3 654 m),随机选择长势较好且健康的具鳞水柏枝作为采集树种,用枝剪截取80 cm长度的1年生嫩枝条,截取枝条应均匀、健康且有5~10个芽孢。随后装入编织袋并喷洒适量水保湿,以供扦插试验。待回试验室,将枝条剪取成插穗,插穗长度约为10 cm,每根插穗保留3个芽以上,上端切口为平口,下端切口为马蹄形[6]。
1.3 试验设计
按照V(珍珠岩)∶V(营养土)=1∶2的比例标准混合基质,随后用1 000倍的多菌灵和百菌清混合液消毒杀菌待用。植物生长调剂有水杨酸(SA)、萘乙酸(NAA)、IBA以及清水,浓度按照表1内浓度进行配制以供处理所需。试验所需浓度参照秦洪文等[4]和黄颖宏等[7]对植物的扦插试验。

表1 3种植物生长调节剂浓度配比及编号Table 1 The concentration ratio and number of 3 plant growth regulators
于2019年5月,将剪好的插穗分别使用植物生长调节浸泡6 h,浸泡深度为4 cm,随后在扦插时,先用器具在苗床中挖1条10 cm的直槽,将插穗按照固定扦插密度摆插好后将基质覆盖上,并轻轻按压覆盖上的基质,使基质与插穗之间紧密结合,同时立即浇透水。每个浓度水平下做27个重复,共有270个处理。
1.4 调查与分析方法
1.4.1 生根调查
在扦插培养9 d后,对各处理下进行根系数量和根系长度统计,统计标准以发根为准。每隔10 d测量1次生根数据,共计测定4次。按公式(1)计算各线段斜率(K),即生根速度。按公式(2)计算生根率。

式中:Δx、Δy分别表示x轴、y轴的变化量。
1.4.2 分析方法
采用Microsoft Office 2010软件整理数据和绘制表格,绘图采用GrapPad Prism,并利用SPSS 25.0软件进行统计分析。重复测量方差分析(Repeated measures ANOVA),并采用最小显著差数法(LSD法)进行多重比较。
2 结果与分析
2.1 不同浓度植物生长调节剂对具鳞水柏枝生根的影响
2.1.1 不同浓度SA对具鳞水柏枝生根的影响
由表2可知,在短时间内(处理时间<20 d),各浓度梯度对具磷水柏枝生根均表现为促进现象,且均高于CK,SA各浓度梯度之间与CK存在显著性差异(P<0.05),以S1效果最佳。随着时间增加,在20~40 d,生根率逐渐趋于稳定,在第39 天测量时,各处理组之间均不存在显著性差异。由图1可知,随着浓度的上升,各水平的K均会发生一定的变化,以0~9 d时,S1的K最大,故在此时间段和此浓度梯度下,具鳞水柏枝的生根速度最快。可见,采用SA作为植物生长调节剂,以SA 1.5 mg/L处理20 d左右生根速度和生根率最佳。

表2 不同浓度SA具鳞水柏枝的生根情况Table 2 Effect of different concentrations of SA on rooting of M.squamosa

图1 不同浓度SA具鳞水柏枝的生根速度及生根率Fig.1 Effect of different concentrations of SA on rooting speed and rooting rate of M.squamosa
2.1.2 不同浓度NAA对具鳞水柏枝生根的影响
由表3可知,不同浓度梯度的NAA处理对具鳞水柏枝的生根速度及生根率均具有一定的影响。在9 d时,各处理水平之间均不存在显著性差异,在19 d时,N1与其余处理存在显著性差异(P<0.05)。由图2可知,随着时间的增长,各水平的生根速度都在逐渐降低,在前9 d时,KN3>KN1>KN2,但 在9~19 d时,出 现 了 反 转KN1>KN3>KN3,在前19 d中,以N3处理9 d时生根速度最快。随后的20 d里,一直以N1的生根率保持最佳。可见,在短时间内,若采用NAA作为植物生长调节剂,以NAA 50 mg/L处理下具鳞水柏枝的生根速度最佳。

表3 不同浓度NAA具鳞水柏枝的生根情况Table 3 Effect of different concentrations of NAA on rooting of M.squamosa

图2 不同浓度NAA具鳞水柏枝的生根速度及生根率Fig.2 Effect of different concentrations of NAA on rooting speed and rooting rate of M.squamosa
由图3可知,N1的根系数量显著高于其他处理,N1与和其余处理组均存在显著性差异(P<0.05),其余各处理组之间无显著性差异。不同浓度的NAA对具鳞水柏枝的影响不同,N1的根系数量最多,可达16.68条,N3次之,达11.10条,CK数量最少,为9.06条。可见,NAA在一定的浓度下可以有效地提高具鳞水柏枝的生根数量,以 50 mg/L NAA处理效果最佳。
2.1.3 不同浓度IBA对具鳞水柏枝生根的影响
由表4可知,不同浓度梯度的IBA处理对具鳞水柏枝的生根速度及生根率具有一定的影响。在短时间内(处理时间<20 d),在IBA处理的具鳞水柏枝生根率均高于CK,且在0~9 d时,I1与CK之间存在显著性差异(P<0.05),其余处理与CK不存在显著性差异。在9~19 d时,I1和I2与CK之间存在显著性差异(P<0.05)。由图4可知,随着时间的增长,各水平的生根速度都逐渐降低,以I1和I3的K最大,即生根速度最快。可见,在短时间内(处理时间<20 d)使用此种植物生长调节剂的处理,以IBA 50 mg/L处理下具鳞水柏枝的生根速度及生根率最佳。
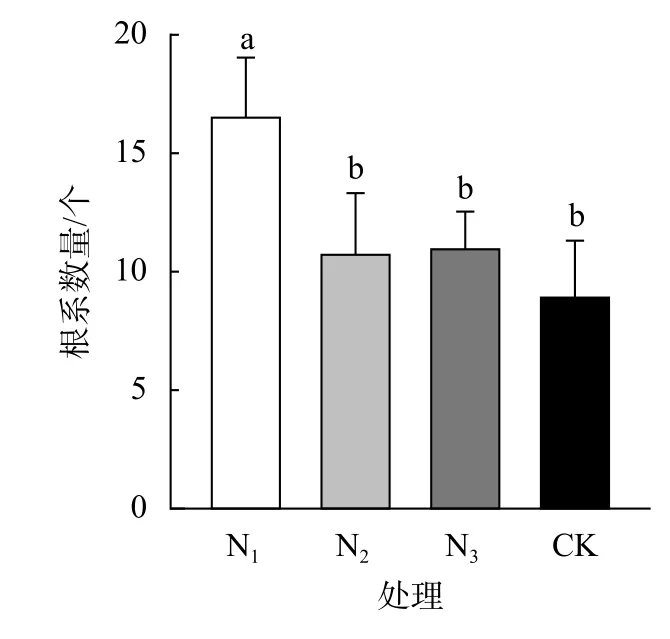
图3 不同浓度NAA对具鳞水柏枝根系数量的影响Fig.3 Effects of different concentrations of NAA on root number of M.squamosa

表4 不同浓度IBA具鳞水柏枝的生根情况Table 4 Effect of different concentrations of IBA on rooting of M.squamosa
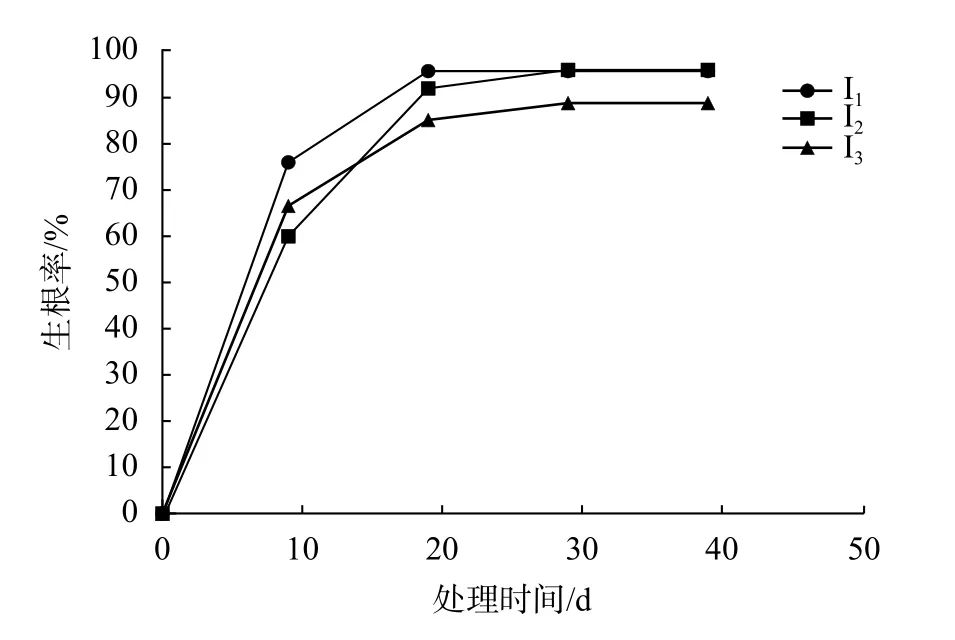
图4 不同浓度IBA具鳞水柏的生根速度及枝生根率Fig.4 Effect of different concentrations of IBA on rooting speed and rooting rate of M.squamosa
2.2 不同种类植物生长调节剂对具鳞水柏枝生根的影响
2.2.1 不同植物生长调节剂对具鳞水柏枝生根速度及生根率的影响
由图5可知,不同植物生长调节剂处理对具鳞水柏枝的生根速度具有一定的影响。在0~9 d时,各线段的斜率为KI1>KS1>KCK>KN1,故生根速度由快到慢依次为IBA>SA>CK>NAA。在9~19 d时,各线段的斜率为KN1>KS1>KI1>KCK,故生根速度快慢依次为NAA>SA>IBA>CK。在19~29 d时,各线段的斜率为KCK>KS1>KI1=KN1,故生根速度由快到慢依次为CK> SA>IBA=NAA。在29~39 d时,各线段的斜率为KCK>KS1=KI1=KN1,故生根速度由快到慢依次为CK>SA =IBA=NAA。结果表明,在短时间内,IBA可以有效地提高生根速度。

图5 不同植物生长调剂具鳞水柏枝的生根率Fig.5 Effects of different plant growth regulators on rooting rate of M.squamosa
2.2.2 不同种类植物生长调剂对具鳞水柏枝生根数量及生根长度的影响
由表5可知,在其余处理因素都相同的条件下,4种处理因素下的生根情况为SA>IBA>CK>NAA,各植物生长调节剂处理下的生根率不存在显著性差异,以SA处理的生根率最高,达96.26%。不同的植物生长调节剂对具鳞水柏枝根系数量的影响不同,NAA处理的根系数量显著高于其他组 (P<0.05),与CK之间存在显著性差异(P<0.05),其余各处理组之间无显著性差异。由此可见,植物生长调节剂在一定的浓度下可以有效地提高具鳞水柏枝的生根数量,以NAA处理效果最佳。不同植物生长调剂处理之间的根系长度无显著性差异,以IBA处理下的根系长度最长。
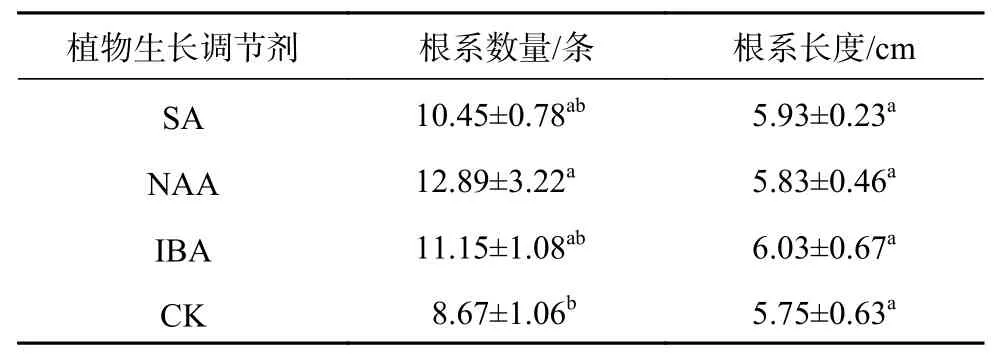
表5 不同种类植物生长调节剂具鳞水柏枝的生根情况Table 5 Effects of different plant growth regulators on rooting of M.squamosa
3 结论与讨论
本研究分别分析了具鳞水柏枝的植物生长调节剂种类及生长调节剂浓度对扦插过程中生根率、生根数量的影响。试验结果表明,在短时间内,IBA能够有效地提高具鳞水柏枝的生根速度及效率;植物生长调节剂下的生根率大小为SA>IBA>CK> NAA,其生根效果之间不存在显著性差异;使用NAA 50 mg/L处理插穗,生根系数量显著高于其他处理组,达16.68条。植物生长调节剂对具鳞水柏枝嫩枝扦插效果显著,但不同生长调节剂生根效果存异,其中IBA 50 mg/L下浓度对具鳞水柏枝嫩枝生根效果最佳。
植物扦插生根是一个相对复杂的过程,相关研究表明[12-15],生长调节剂的使用(主要是生长促进剂)对于植物扦插繁殖生根率的提高有着显著的促进作用[16]。植物促根剂的选择应用,是提高林木扦插成活率的关键技术之一。从本次试验结果来看,IBA、NAA和SA均能够有效地提高具鳞水柏枝的生根速度,而不同激素下其生根速度有一定差异,表现为IBA>SA>NAA,这是因为不易被氧化分解,容易保留在被处理的部位作用,强烈作用时间长,诱发的根多而长,且IBA在浓度低时刺激植物生长,浓度高时抑制植物生长,同时IBA有促进植物生长、生根、开花,提高发芽率,使农作物早熟高产等功能[12]。NAA效果与IBA相似,但诱发发得根少,故在一定程度上会影响生根速度。在实践生产上若要在短时间有效地促进具鳞水柏枝生根,最好使用IBA对插穗进行外源的植物生长调节剂处理,能够有效地提高工作效率。
不同的植物生长调节剂在植物扦插繁育的过程对于促进植物生根中起着至关重要的作用[12]。使用SA、NAA和IBA处理具鳞水柏枝,除NAA外,其余处理组与对照组相比均能有效地具鳞水柏枝的扦插生根率。在本次试验发现,在3种不同植物生长调节剂以及清水处理下的生根率为大小为SA>IBA>CK>NAA。刘自刚等[14]研究表明外施SA可提高作物对逆境的抗性和耐性,促使枝梢生长健壮,促使细胞自身分裂能力增加。而在本研究中,采用SA浓度梯度作为实验处理的重要激素,在整体上使用水杨酸处理后的成活率高达96.26%。
植物的扦插繁育综合来看是一个相对复杂的过程,本研究仅从不同植物生长调节剂及其浓度梯度2个方面进行了初步探究,若要更深一步找到最适于具鳞水柏枝的扦插繁育条件,满足实践中生产的需要,还需要从植物生长调节剂的混合使用、不同基质、不同的扦插密度、不同的浸泡时间、不同的插穗长度以及插穗的粗细程度等方面进行探究,以进一步优化试验。

