水曲柳松散型愈伤组织诱导及悬浮培养体系的优化
刘 林 陈思齐,2 董宇飞 邸鑫宇 詹亚光 齐凤慧
(1.东北林业大学生命科学学院,黑龙江 哈尔滨 150040;2.阜新市产业技术创新推广中心(阜新市产业技术研究院),辽宁 阜新 123000)
水曲柳(Fraxinus mandshurica)为木犀科(Oleaceae)白蜡树属,产于东北、华北、陕西、甘肃、湖北等省,生于海拔700~2 100 m的山坡疏林中或河谷平缓山地。朝鲜、俄罗斯、日本也有分布,落叶大乔木,通常树干高大通直,高达30 m以上,胸径可达2 m[1]。水曲柳材质坚硬,纹理通直,花纹美观,因其生产出备受推崇的硬木[2],而被广泛用于家具和特殊建筑材料[3],如橱柜、运动器材及农具等[4]。
有研究报道水曲柳树皮中含有香豆素类成分[5],在民间常将水曲柳皮用于抗炎镇痛等[4]。但树木去皮后会死亡,砍伐也会造成资源的浪费和破坏,不利于可持续发展。因此,可以利用组织培养技术对水曲柳进行繁殖。目前水曲柳的繁殖主要是种子、扦插和嫁接,而无性繁殖主要利用成熟胚的下胚轴诱导不定芽,子叶诱导体细胞胚。但这些技术中依然存在几个关键问题:如不定芽的诱导中,虽然可以活动不定芽,但在后期伸长培养中不定芽普遍发育不良,成苗率低。在体细胞胚诱导中,大部分形成畸形胚,而且多数是在褐化的外植体上形成体胚[6]。目前也有以水曲柳叶柄或下胚轴为外植体诱导愈伤组织并进行悬浮培养[7-8]。这些研究结果为水曲柳的无性繁殖及单细胞诱导奠定了基础,但要进行大规模的繁殖还需要对诱导体系进一步的优化,以达到生产应用的目的。
本研究在前人研究基础上,对水曲柳愈伤组织诱导并对悬浮培养体系进一步优化,获得能够长期继代培养并能形成均一化的单细胞和小细胞团的培养体系。该体系的建立一方面可以为水曲柳次生代谢产物生产及研究提供材料,另一方面为利用单细胞诱导体细胞胚从而建立水曲柳再生体系提供基础。
1 材料与方法
1.1 材料来源
实验材料为水曲柳组培苗,由东北林业大学生命科学学院詹亚光教授提供。
1.2 水曲柳愈伤组织诱导
在无菌条件下,将水曲柳组培苗叶片和叶柄切下来,叶柄切成0.5 cm左右大小,叶片复叶形式,垂直叶脉方向划两刀,切断叶脉,分别接种到愈伤组织诱导培养基上。培养基是以WPM为基础培养基,加入30 g/L蔗糖,5.6 g/L琼脂,6-BA(0,5,6,7,8 mg/L)和TDZ(6,7 mg/L)2种植物生长调节剂,培养基命名为WG1~WG10(表1)。

表1 水曲柳愈伤组织诱导培养基Table 1 Induction medium for F.mandshurica callus
1.3 松散型愈伤组织诱导培养基的筛选
将获得的愈伤组织从外植体上切割下来,切割成直径0.5 cm的球型小块,接入愈伤组织诱导培养基中(见表2)。每种浓度重复3瓶,每瓶接种9块愈伤组织,温度(25±1) ℃,光照周期12 h/d,光照强度2 000~3 000 lx,培养20 d后观察愈伤组织生长情况。

表2 松散型愈伤组织诱导培养基Table 2 Medium for inducing loose callus mg/L
1.4 水曲柳愈伤组织形态学观察
将诱导的愈伤组织浸入FAA中固定24 h。蒸馏水清洗3次以去除固定液,OTC包埋,-20 ℃冷冻30 min,用冰冻切片机切片,厚度为8~15 μm。
将切好的材料用番红固绿双染。先用0.1%番红染色2~3 min,蒸馏水清洗后,用0.05%固绿染色1 min,再次水洗。制成临时装片,在显微镜下观察。
1.5 水曲柳细胞悬浮培养
将获得的松散愈伤组织,称取2 g,接种到50 mL F4液体培养基中,110~120 r/min振荡培养。温度(25±1) ℃,光照周期12 h/d,光照强度2 000~3 000 lx,培养2周。用100目细胞筛过滤弃去大块愈伤组织,用F4液体培养基扩大培养,获得水曲柳悬浮细胞。
1.6 水曲柳细胞悬浮培养生长量、pH值、电导率检测
称取2 g悬浮细胞,接种到50 mL编号 F4的液体培养基中,重复30瓶,120 r/min震荡培养,连续培养20 d。每隔2 d随机取出其中3瓶,过筛后,称其鲜质量,然后60 ℃烘干2 h,称其干质量;以pH计测量滤液的pH值,电导率仪检测电导率的变化,连续测定10次,记录实验结果。
1.7 水曲柳细胞悬浮培养中蔗糖、N、P、接种量的检测
以编号F4液体培养基为基础培养基,蔗糖浓度设计为10、20、60、80 g/L,培养基编号为F4C1、F4C2、F4C3、F4C4; KNO3浓度为400、800、1 200 mg/L,培养基编号为F4N1、F4N2、F4N3;磷源KH2PO4浓度为 170、340 g/L,培养基编号为F4P1、F4P2;接种量设计为4、6 、8、10 g/50 mL。连续培养20 d,分别对培养基内细胞状态进行观察,并称干质量和鲜质量,对比不同处理条件下细胞增殖情况。
1.8 数据统计与分析
所有数据均使用SPSS 17.0软件进行分析。愈伤组织诱导率、增殖率、死亡率按照以下公式计算:

或

2 结果与分析
2.1 6-BA和TDZ浓度对水曲柳愈伤组织形成的影响
以WPM为基本培养基,TDZ浓度为6 mg/L,叶柄为外植体的愈伤组织诱导率随6-BA浓度增加呈现先增后减趋势,6-BA浓度为5 mg/L时,诱导率最高,为90.91%;叶片为外植体的愈伤组织诱导率随6-BA浓度增加呈现先降后增再降的趋势,6 mg/L TDZ时诱导率最高,为87.5%。6-BA浓度为5 mg/L时,愈伤组织整体存活率最高为80%,(见表3)。
表3 不同外植体愈伤组织诱导情况Table 3 Callus induction of different explants
以WPM为基本培养基,TDZ浓度为7 mg/L,叶柄为外植体的愈伤组织诱导率随着6-BA浓度的增加而降低,叶片为外植体的愈伤组织诱导率随6-BA浓度的增加先升高后降低(见表3)。
从表3还可以发现:叶柄愈伤组织的诱导随TDZ浓度增加,愈伤组织诱导率也增加,如TDZ浓度为6 mg/L和7 mg/L时,水曲柳叶柄的愈伤组织诱导率分别为88.89%<96.97%。
形态学观察6-BA浓度增加,叶柄愈伤组织形态上变化不大(图1a,b,c),TDZ浓度增加,愈伤组织体积也增大(图1d,e)。叶片为外植体时,6-BA浓度增加时愈伤组织变化不明显(图1f,g,h),TDZ浓度增加时,叶片的所有伤口处都会长出愈伤组织(图1i,j)。叶片诱导出的愈伤组织坚硬、致密,而叶柄诱导出的愈伤组织疏松、浅黄色。

图1 不同外植体形成的愈伤组织Fig.1 Callus formed by different explants
2.1.1 水曲柳松散型愈伤组织的诱导
将获得的愈伤组织接种到含有TDZ、6-BA、NAA、IBA 4种植物生长调节剂的培养基中(F1~F9),光照培养20 d,通过愈伤组织形态和增殖率进行对比发现,F4培养基的增殖率最高为462.86%(表4),并且愈伤组织疏松分生旺盛(如图2),最适宜进行水曲柳松散型胚性愈伤组织的增殖培养。

表4 增殖培养基的选择与形态描述Table 4 Selection and morphological description of proliferation medium
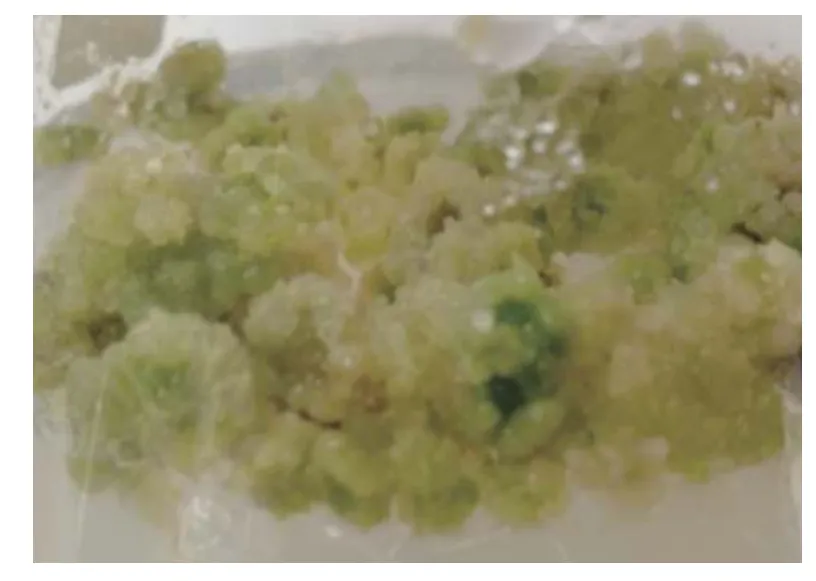
图2 F4培养基诱导的松散型愈伤组织Fig.2 Loose callus induction in F4 medium
对愈伤组织增殖率进行方差分析,结果显示,4种植物生长调节剂组合的培养对水曲柳愈伤组织增殖差异显著(P<0.05)。多重比较结果显 示,F9、F8、F6之间,F7与F1之间,F1与F2之间,F2与F5、F3之间无显著差异;F4与其他培养基间显著差异。
将获得的愈伤组织切片观察,非胚性愈伤组织细胞大、疏松、不规则排列(图3a)。而胚性愈伤组织会含有胚性细胞团,经过编号F4的培养基培养1~2个继代,通过切片观察可以看到细胞小而紧密整齐的排列(图3b),对球状突起的愈伤组织切片可以观察到类似于球胚的结构(图3c)。

图3 愈伤组织切片形态观察Fig.3 Morphological observation of callus slices
2.1.2 水曲柳胚性愈伤组织悬浮培养生长曲线
从细胞生长形态来看,随着培养时间的增加,细胞数量也增多,颜色由绿色逐渐呈淡黄色(如图4),说明培养基内营养成分消耗导致细胞活力下降。取2 g胚性细胞接种于100 mL F4液体培养基中,每隔2 d取样测量鲜质量及干质量,计算生长量,结果如图5所示。细胞的生长符合S形生长,在第6 天开始进入对数生长期,细胞生长量增加,到达18 d时,细胞生长达到最高值,之后开始降低。18 d时细胞生长量最高,但是细胞颜色呈黄色,也可能是细胞数量过大,培养基无法提供充足的营养,而16 d时,细胞颜色还是绿色,因此,水曲柳胚性愈伤组织悬浮细胞生长周期为16~18 d。

图4 不同培养时间水曲柳悬浮培养细胞形态Fig.4 Cell morphology of suspension culture of F.mandshurica in different culture times
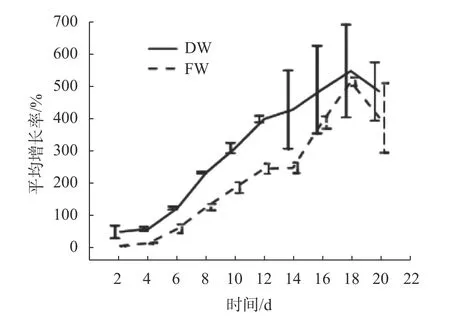
图5 水曲柳细胞悬浮培养生长曲线Fig.5 Growth curve of suspension culture of F.mandshurica
2.1.3 水曲柳细胞悬浮培养液的pH和电导率
随着培养时间的增加,培养液中的pH值先升高后降低,但基本维持在5左右。这也说明植物细胞自身对pH值具有较强的调控能力,使其达到适合生长的范围。培养液中的电导率处于一个上下波动的状态,说明细胞在调节pH值时,所释放的物质也会影响培养液中的电导率变化(如图6)。

图6 悬浮培养液中pH及电导率Fig.6 pH and conductivity in suspension culture
2.1.4 蔗糖浓度对水曲柳悬浮细胞的影响
蔗糖作为碳源为植物细胞提供能量来源,调节培养基内的渗透压。通过增加培养基中蔗糖含量,水曲柳细胞的增长率先升高后降低,当蔗糖浓度为10 g/L时,由于渗透压过小,不利于细胞生长,蔗糖浓度为20 g/L时渗透压平衡,细胞增长提高,当蔗糖浓度为30 g/L时,生长量达到最大,其中鲜质量为400%,干质量为500%,高于30 g/L时,渗透压过高,细胞增长率明显降低(如图7)。通过细胞生长状态的观察,在蔗糖浓度为10~30 g/L时,细胞呈浅黄绿色,细胞的密度也随着蔗糖浓度的增加而增加,当蔗糖浓度为60~80 g/L时,细胞的密度没有明显增加,而且细胞颜色为浅褐色(如图8)。

图7 不同蔗糖浓度下细胞的增长率Fig.7 Cell growth rate at different sucrose concentrations

图8 不同蔗糖浓度下培养20 d细胞生长状态Fig.8 Growth state of cells cultured for 20 days under different sucrose concentrations
对不同蔗糖浓度下悬浮细胞增长率进行方差分析,结果显示不同蔗糖浓度对水曲柳悬浮细胞生长干质量、鲜质量差异均显著(P<0.05),多重比较结果显示,干质量中30 g/L蔗糖与其他浓度有显著差异;鲜质量中,糖浓度为60、80 g/L时与10、20 g/L无显著差异,与30 g/L差异显著;糖浓度为10 、20 g/L时与30 g/L无显著差异(如图7)。
2.1.5 氮、磷含量对水曲柳悬浮细胞的影响
氮是植物每个活细胞的组成部分,是生长的必需养分,当氮素充足时,植物可合成较多的蛋白质,促进细胞的分裂和增长。通过添加KNO3来增加氮的含量,添加量为400 mg/L时,细胞鲜质量的增长率为30%,干质量增长率为95%(如图9),细胞颜色为浅黄色(图10a)。随着氮的含量进一步增加,细胞的增长率降低,氮含量增加1 200 mg/L时,细胞鲜质量增长率10%左右,干质量50%左右,细胞颜色由浅黄色变为白色(图10c)。对愈伤组织增殖情况 进行方差分析,结果显示,说明增加氮的含量对细胞生长差异不显著。多重比较结果显示不同浓度氮源对细胞增殖情况无显著差异。

图9 不同浓度氮源下细胞增长率Fig.9 Cell growth rate under different concentrations of nitrogen source
磷是植物体内核酸、蛋白质和酶等多种重要化合物的组成元素,磷对植物营养有重要的作用。增加磷的含量细胞增长率也增加,增加170 mg/L KH2PO4时,细胞鲜质量增殖率为12%,干质量的增殖率为36%。继续增加340 mg/L KH2PO4时,细胞干鲜质量增殖率都比增加170 mg/L KH2PO4时低(如图11)。观察细胞生长状态,发现细胞均为白色(如图12)。对细胞增殖情况做方差分析,结果显示增加磷的浓度,细胞增殖率差异不显著。
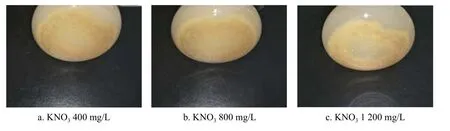
图10 不同浓度氮源下细胞状态Fig.10 Cell state under different concentrations of nitrogen source

图11 不同浓度磷源下细胞增长率Fig.11 Cell growth rate under different concentrations of phosphorus source

图12 不同浓度磷源下细胞状态Fig.12 Cell status under different concentrations of phosphorus source
2.1.6 细胞接种量对水曲柳悬浮培养的影响
在50 mL F4液体培养基中,分别添加4、6、8、10 g胚性细胞,培养20 d后观察,结果显示,随接种量增加,细胞生长率也再增加。接种量为10 g时,生长率最高,其中鲜质量增长率为1 000%,而干质量增长率为1 150%(如图13)。观察细胞生长状态,培养20 d时细胞均有不同程度的褐化,褐化程度随接种量增加而增大(图14)。因此,相同培养条件下,增加接种量可以提升细胞生长率,但培养时间不能超过细胞的生长周期,否则细胞会褐化。对不同接种量的悬浮细胞增长率进行方差分析,结果显示接种量对细胞增长差异显著(P<0.05),多重比较结果显示,接种量2 g与4 g时无显著差异,4 g与6 g无显著差异,6 g与8 g无显著差异,10 g与其他接种量差异显著(如图13)。
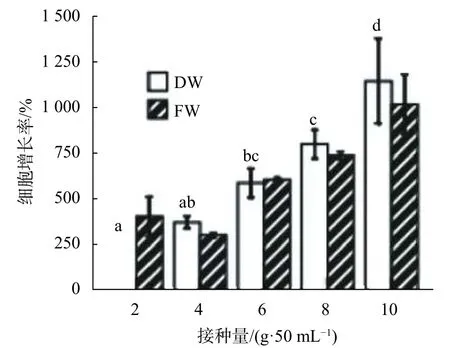
图13 接种量对悬浮细胞增长量的影响Fig.13 Effect of inoculation amount on the growth of suspended cells

图14 不同接种量下细胞生长状态Fig.14 Cell growth status under different inoculation amounts
3 结论与讨论
TDZ是一种人造植物生长调节剂,广泛用于植物组织培养。 TDZ可以替代植物生长素和细胞分裂素[9-10],但更广泛地用于体外植物组织培养中以诱导枝条生长[11],体细胞胚胎[12-13],原生质体分裂[14]和原球茎状体[15]。在本研究中发现水曲柳愈伤组织的形成主要依赖于TDZ,TDZ浓度增加,愈伤组织也增加,如TDZ浓度为6 mg/L和7 mg/L时,水曲柳叶柄的愈伤组织诱导率最高分别为88.89%和96.97%,而6-BA浓度的增高或降低对水曲柳愈伤组织诱导影响较小,但在松散型胚性愈伤组织诱导中和增殖培养中,TDZ需要和6-BA、NAA和IBA联合处理。
有研究报道,培养基中氮的种类和浓度会影响生物量的积累[16-18],硝铵离子对植物细胞和组织培养中生物活性化合物的积累有不同程度的影响,NH4+浓度较低和NO3-浓度较高时,不但有利于最佳生物量积累,而且也有利于多糖、多酚类物质和黄酮类物质的积累[19]。本研究中,增加NO3-浓度(400 mg/L),细胞鲜质量的增长率提高30%,细胞颜色为浅黄色。但是不能一直增加,当增加NO3-浓度1 200 mg/L时细胞鲜质量增长率10%左右,细胞颜色由浅黄色变为白色。
相对较高的蔗糖浓度有利于细胞生物量的积累,而较低的浓度影响次生代谢产物的积累[20-21]。在Bacopa monnieri的培养中,2%的蔗糖有利于生物量的积累,而无蔗糖的培养基有利于Bacopa含量的积累[22]。同样,在Gymnema sylvestre细胞培养中,3%蔗糖浓度可以获得较高的生物量积累,而4%的蔗糖浓度更适合代谢产物的积累[23]。在铁皮石斛(Dendrobium officinale)原球茎悬浮培养中,5.0%蔗糖更适合生物质的积累,而2.5%蔗糖更适合多糖、多酚和类黄酮的积累[19]。本研究中,蔗糖浓度为3%时,水曲柳细胞的增长率最高,随着蔗糖浓度的增加,细胞的增长率也降低。这说明蔗糖浓度对细胞生长有着重要的作用,但较高的蔗糖浓度会对细胞的生长产生抑制作用。
关于水曲柳的组织培养多年来也有研究报道。通过下胚轴诱导不定芽,但不定芽经过继代之后逐渐褐化死亡,最后存活率只有48.7%[24]。黄剑[25]也用水曲柳下胚轴为外植体,不定芽诱导率为83.3%,不定芽伸长培养一个月全部死亡。这说明水曲柳不定芽再生体系并不成熟,不定芽发育普遍不良,组培苗形成率低[6]。也有通过体细胞胚诱导繁殖水曲柳的报道,水曲柳体胚萌发率为60%,成熟率70%,但其中有59.9%为畸形胚,不能形成完整的植株[26]。张丽杰等[27]在1/2MS (MS 所有成分均减半)培养基中诱导水曲柳体胚发生,诱导率只有19.5%。以子叶为外植体诱导体胚诱导率为67%,其中约82%的体细胞胚是在褐化的子叶上出现[28]。这说明体细胞胚途径繁殖水曲柳培养体系也有待进一步优化。以水曲柳叶柄和下胚轴为外植体,都可以诱导愈伤组织并进行悬浮培养,但从文章中的细胞形态观察,悬浮细胞多为细胞团,并不能获得单细胞或小细胞团的悬浮细胞[7-8]。而本研究通过对胚性愈伤组织的筛选和悬浮培养条件的优化,利用WPM+0.3 mg/L TDZ+1.5 mg/L 6-BA+0.1 mg/L NAA+0.5 mg/LIBA+3%蔗糖的液体培养基,可使水曲柳愈伤组织形成均一化的单细胞和小细胞团,生长迅速并可以长期继代培养。这一培养体系的建立,一方面为单细胞诱导水曲柳体细胞胚途径再生水曲柳植株提供了技术和材料;另一方面为水曲柳次生代谢产物的调控机理研究提供了可能;第三为水曲柳单细胞遗传转化或功能基因的瞬时表达提供了材料和技术。

