黄连素下调细胞周期蛋白依赖性激酶-2活性抑制血管紧张素Ⅱ诱导的心肌纤维化
姜学泽, 陈宇涵, 陈友铭, 王岳鹏
(上海交通大学医学院附属新华医院心内科,上海 200092)
心肌纤维化是多数心脏疾病的共同病理表现,其主要特征是心脏成纤维细胞大量分化、增殖以及细胞外基质的过度沉积[1-2]。心肌纤维化可导致心力衰竭,同时也改变心脏电传导而引起心律失常[3-4]。其主要病理发生机制涉及心脏成纤维细胞过度分化及增殖。目前临床上治疗心肌纤维化的方法匮乏且疗效甚微。在传统中医药中,黄连用作药材的历史可以追溯到公元200年中医药经典《神农本草经》。黄连素是从黄连中分离的异喹啉化合物的主要成分[5],具有抗微生物、抗真菌和抗炎的性能。近年来研究提示其对高脂血症、高血糖症、高血压、神经退行性疾病及肿瘤等有治疗效果[6-11]。有动物实验[12]表明,黄连素可下调糖尿病大鼠心脏成纤维细胞中胰岛素样生长因子1受体(insulin-like growth factor-1 receptor, IGF-1R)的表达并随后降低心脏中基质金属蛋白酶(matrix metalloproteinase, MMP)-2/MMP-9、α平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)和 Ⅰ 型胶原(collagen)的表达来改善心肌纤维化和功能障碍,从而对糖尿病大鼠起到心脏保护作用。Che等[13]通过体内及体外实验证实,黄连素可以减少巨噬细胞浸入经异丙肾上腺素刺激的大鼠心肌,并抑制转化生长因子(trans-forming growth factor, TGF)-β1/smads信号通路阻止成纤维细胞转化为“激活的”分泌型肌成纤维细胞,从而对心脏损伤起到保护作用。这些实验表明,黄连素可能有抑制心肌纤维化的作用。本课题组利用蛋白磷酸化质谱筛选到黄连素对心肌细胞的细胞周期蛋白依赖性激酶-2(cyclin-dependent protein kinases-2, CDK2)有显著抑制作用。CDK2是细胞外分裂原刺激后通过细胞内丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)通路下游的调节细胞周期从G1期到S期的关键调节蛋白。大量前期研究表明,CDK2的活性对调节心脏成纤维细胞的分化及增殖至关重要,其主要激活位点为Thr-160[14-17],因此设想黄连素可能通过抑制CDK2-T160磷酸化来抑制心脏成纤维细胞增殖,从而达到抑制心肌纤维化的目的。本研究在体内和体外探讨黄连素对心肌纤维化的作用,以及是否通过抑制CDK2活性起作用,从而为临床治疗心肌纤维化提供新的药物及作用靶点。
1 材料与方法
1.1 试剂与仪器
野生型SD大鼠及乳鼠购自上海斯莱克实验动物有限责任公司;植入式胶囊渗透压泵(2ML4)购自美国Alzet公司;血管紧张素 Ⅱ (angiotensin Ⅱ, Ang-Ⅱ)、黄连素(berberine,BBR)等购自美国Sigma公司;小动物无创血压仪购自美国Vistech Systems公司;DMEM高糖培养基、DMEM低糖培养基、PBS粉末、Ⅱ型胶原蛋白酶、0.25%胰酶(含0.02%EDTA)、Hanks缓冲溶液(10×HBSS)、胎牛血清购自美国Gibco公司;L-谷氨酰胺(L-glutamine)、青霉素-链霉素溶液、磷酸盐缓冲液(phosphate-buffered saline, PBS)、冻存用二甲基亚砜(dimethyl sulfoxide, DMSO)等购自上海生工生物工程有限公司;CCK-8试剂盒、anti-GAPDH、anti-mouse IgG HRP、anti-rabbit IgG HRP等购自上海碧云天生物科技有限公司;anti-CDK2、anti-phosphate-CDK2-T160、anti-Cyclin D1、anti-Collagen Ⅰ、anti-Collagen Ⅲ、anti-Vimentin及anti-α-SMA等购自上海优宁维生物科技有限公司;CDK2-T160A及CDK2-T160D腺病毒包装由上海汉恒生物有限公司提供。
1.2 方法
1.2.1 SD大鼠心肌纤维化模型制作 将4~5周龄体重约180g野生型雄性SD大鼠共24只随机分为4组(n=6): 空白对照组(Ctl)、血管紧张素组(Ang-Ⅱ)、低剂量黄连素组(Low BBR)及高剂量黄连素组(High BBR)。Ctl组植入胶囊渗透压泵,注入0.9%氯化钠溶液2mL,其余3组渗透压泵内用注射器按照500ng/(kg·min)灌注速度注入Ang-Ⅱ溶液2mL。腹腔注射5%水合氯醛水溶液1~2mL 麻醉SD大鼠,用剃须刀将大鼠背部皮肤除毛,75%酒精棉球局部消毒后,用剪刀纵向剪开大鼠背部皮肤,并钝性分离至皮下,按组别分别埋入0.9%氯化钠及Ang-Ⅱ渗透压泵(释放速度2.5μL/h),缝合皮下组织及皮肤。术后Ctl组及Ang-Ⅱ组每日用灌胃方式灌入1.5mL蒸馏水,Low BBR组及High BBR组按照10mg/(kg·d)及 60mg/(kg·d)灌胃灌入1.5mL黄连素蒸馏水混悬液,共计28d。每只大鼠每3d测定鼠尾血压,每次测量至少5次,取平均值,以大鼠收缩压>140mmHg(1mmHg=0.133kPa)并结合心脏超声及Masson病理染色确定大鼠心肌纤维化模型制作成功。
1.2.2 大鼠心脏超声检查 用Vevo2100小动物超声成像平台进行大鼠心脏超声检查,评价各组实验大鼠的心脏结构及功能。探头频率21MHz,采用M型超声分别测定各组大鼠心动周期5次以上,取平均值,分别测量左室舒张期末后壁厚度(left ventricular posterior wall thickness at end-diastole, LVPWTD)、室间隔厚度(interventricular septal thick-ness at diastole, IVSD)、左室收缩期末内径(left ventricular end-systolic diameter, LVESD)、左室舒张期末内径(left ventricular end-diastolic diameter, LVEDD)、左室收缩期末容积(left ventricular end-systolic volume, LVESV)、左室舒张期末容积(left ventricular end-diastolic volume, LVEDV)、左室心肌质量(left ventricular mass, LV_mass)、左室短轴缩短率(left ventricular fractional shortening, LVFS)、左心室射血分数(left ventricular ejection fraction, LVEF)等。
1.2.3 心脏组织病理染色 大鼠麻醉过量致死后,立即剖开胸腔取出心脏,称重,取左心室中部组织冠状切面,用4%多聚甲醛固定后石蜡包埋,切片,行Masson及H-E染色,于倒置显微镜下观察心肌纤维化程度并拍照。
1.2.4 心脏组织总蛋白提取 取10mg大鼠心脏心室组织,液氮低温下研磨组织,加入100μL RIPA裂解液及2μL苯甲基磺酰氟(phenylmethanesulfonyl fluoride, PMSF),冰上匀浆30min,转移至1.5mL离心管,于4℃下10000×g离心15min,取上清液,分装保存,行Western印迹法检测。
1.2.5 心脏成纤维细胞的分离、培养及鉴定 选取1~3d SD大鼠乳鼠,5%水合氯醛腹腔麻醉后,无菌状态下开胸取出心脏,盛装在PBS中转移至超净台,PBS清洗后剪碎切成小于1mm3的小块,在4℃下于含有0.5%胰蛋白酶的D-Hanks平衡盐溶液中孵育过夜,收集小块,并通过Ⅱ型胶原酶(100μ/mL)在37℃ 下进一步消化40min,用含有10%胎牛血清(fetal bovine serum, FBS)的DMEM终止消化,重悬后通过200目的滤网过滤,铺板在含有10%FBS的DMEM的培养皿中孵育70min,弃上清液后收集附着在底部的剩余细胞,重悬后重新铺板,补充含有10%FBS、100 U/mL青霉素、100μg/mL链霉素的DMEM培养基,后每48h更换1次完全培养基,待细胞生长至融合状态时,以1∶2比例传代,选取第3~4代细胞进行实验。待细胞生长至80%融合状态时,去除培养基,用PBS反复冲洗细胞3次,加入2mL PBS,显微镜观察及获取照片,行免疫荧光波形蛋白(Vimentin)染色及α-SMA染色后荧光显微镜下观察鉴定成纤维细胞。
1.2.6 细胞毒性测定(CCK-8) 配置每100μL 5000 个细胞的成纤维细胞悬液,加入96孔板,37℃、5% CO2培养箱预培养24h,PBS冲洗后向培养孔中加入100μL含不同终浓度(0、3、10、30、100、300、1000、3000 μmol/L)的黄连素完全培养基,继续孵育培养24h 后,每孔加入10μL CCK-8溶液,孵育1~4h,每小时用酶标仪测定在450nm处的光密度值(A450)。
1.2.7 心脏成纤维细胞纤维化模型构建 选取第3~ 4代心脏成纤维细胞,待细胞密度达到50%~60%时,将细胞分为4组,正常对照组(Ctl组): 培养基不加药物干预;Ang-Ⅱ对照组(Ang-Ⅱ组): 培养基加入Ang-Ⅱ(终浓度1μmol/L);低浓度黄连素组(Low BBR组): 培养基加入Ang-Ⅱ(终浓度1μmol/L)+黄连素(终浓度20μmol/L);高浓度黄连素组(High BBR组): 培养基加入Ang-Ⅱ(终浓度1μmol/L)+黄连素(终浓度200μmol/L)。分别放入培养箱中培养24、48h后观察细胞形态、生长速度。
1.2.8 细胞增殖检测(CCK8) 按照成纤维细胞纤维化模型分组,将100μL心脏成纤维细胞悬液加入96孔板中,在培养箱37℃、5% CO2预培养24h后,按照前述心脏成纤维细胞纤维化模型分组向培养孔中加入含相应浓度药物的培养基,继续孵育培养24~48h后,向每孔加入10μL CCK-8溶液,孵育1~4h,每小时用酶标仪测定在450nm处的吸光度值(A450)。
1.2.9 流式细胞仪检测细胞增殖周期 经药物处理过的细胞用PBS洗涤后加入胰酶消化,收集细胞,PBS清洗2次,离心后弃上清液,加入1mL PBS涡旋成细胞悬液,逐滴加入预冷的100%乙醇配成75%左右的乙醇溶液,-20℃避光过夜,200×g离心细胞10min,弃上清液,PBS清洗细胞2次后,加入含100μg/mL核糖核酸酶A(RNase A)和50μg/mL碘化丙啶(propidium, PI)的PBS后重悬细胞,37℃孵育30min,300目的尼龙膜过滤后流式细胞仪(美国,Thermo)检测细胞增殖周期分布。
1.2.10 成纤维细胞总蛋白提取 将药物处理过的细胞用PBS清洗2次后加入200μL RIPA裂解液及4μL PMSF,冰上裂解30min,转移至1.5mL离心管于4℃下10000×g离心15min,取上清液,分装保存及行Western印迹法检测。
1.2.11 CDK2-T160A及CDK2-T160D腺病毒包装、感染心脏成纤维细胞 将状态良好的细胞按照每孔5×105个细胞接种到12孔板,预培养24h后,吸去原有培养基,加入完全培养基,按照MOI=50将融化后的2种腺病毒加入细胞中,混匀后放入培养箱37℃感染4h,更换新鲜培养基37℃培养24~36h,每组均加入Ang-Ⅱ(终浓度1μmol/L)后,加入黄连素(终浓度为20μmol/L及200μmol/L)处理细胞,与未加黄连素的对照组细胞同时放入培养箱继续培养24~48h,观察细胞形态、生长速度。
1.2.12 Western印迹法检测 用BCA法测定组织及细胞总蛋白浓度,滴定各组蛋白至统一浓度,加入上样缓冲液,煮沸5min,取20μL蛋白质样品行12.5% SDS-PAGE电泳,将蛋白转入PVDF膜上,用5%脱脂奶粉室温封闭1h,TBST缓冲液漂洗3次后,加入1∶1000稀释的一抗封膜,4℃摇床过夜,TBST漂洗3次后加入1∶1000稀释的二抗室温摇床孵育1h,TBST漂洗膜3次,加入发光液后立即于化学发光成像仪(Las 4000 Mini)发光并采集图像。
1.3 统计学处理

2 结 果
2.1 黄连素减轻Ang-Ⅱ引发的大鼠心脏功能不全
心脏超声心动图可显示心脏腔内结构及心功能,在SD大鼠心肌纤维化模型中,经Ang-Ⅱ作用28d后,心超检查结果Ang-Ⅱ组大鼠LVPWT、IVSD、LV_mass及LVFS较Ctl组大鼠均有明显增加(P<0.01),LVEF明显降低(P<0.01),见图1。处死大鼠后取出心脏测量心脏和体重比(heart weight/body weight, HW/BW)明显升高,差异有统计学意义(P<0.01)。表明经Ang-Ⅱ刺激后大鼠心脏呈向心性肥厚,并存在心功能不全。而经过黄连素治疗后,相对于Ang-Ⅱ组,LVPWT、IVSD、LV_mass、LVFS及HW/BW均明显下降(P<0.01),LVEF明显增加,差异有统计学意义(P<0.01),并与Ctl组相接近。而低剂量的黄连素和高剂量的黄连素治疗效果相比,除LVPWT及HW/BW差异有统计学意义(P<0.01)外,IVSD、LV_mass、LVFS及LVEF差异不显著,见表1。而心室组织行H-E染色后,计算心肌细胞横截面积显示Ang-Ⅱ可诱发心肌细胞肥大(P<0.01),而黄连素显著逆转Ang-Ⅱ的这种作用(P<0.01),见图2。
2.2 黄连素减轻Ang-Ⅱ致大鼠心肌纤维化
大鼠心室组织切片后行Masson及H-E染色,计算纤维化面积比值,结果显示Ang-Ⅱ组相较于Ctl组大鼠心肌纤维化程度明显增加(P<0.01),而经黄连素处理后明显减轻Ang-Ⅱ诱导的心肌纤维化(P<0.01),高剂量黄连素组降低得更加明显(P<0.01),见图2A、C。提取心室组织行Western印迹法检测心肌纤维化标志物,结果显示与Ctl组相比,Ang-Ⅱ明显增加心脏组织Collagen Ⅰ/Ⅲ的表达(P<0.01),经黄连素处理后显著降低Ang-Ⅱ诱发的Collagen Ⅰ/Ⅲ的表达(P<0.05),高剂量黄连素处理组降低得更显著(P<0.01),见图3。
图1 黄连素减轻Ang-Ⅱ引发的大鼠心脏向 心性肥厚及心功能不全Fig.1 Berberine attenuates angiotensin Ⅱ-induced cardiac hypertrophy and cardiac dysfunction in rats
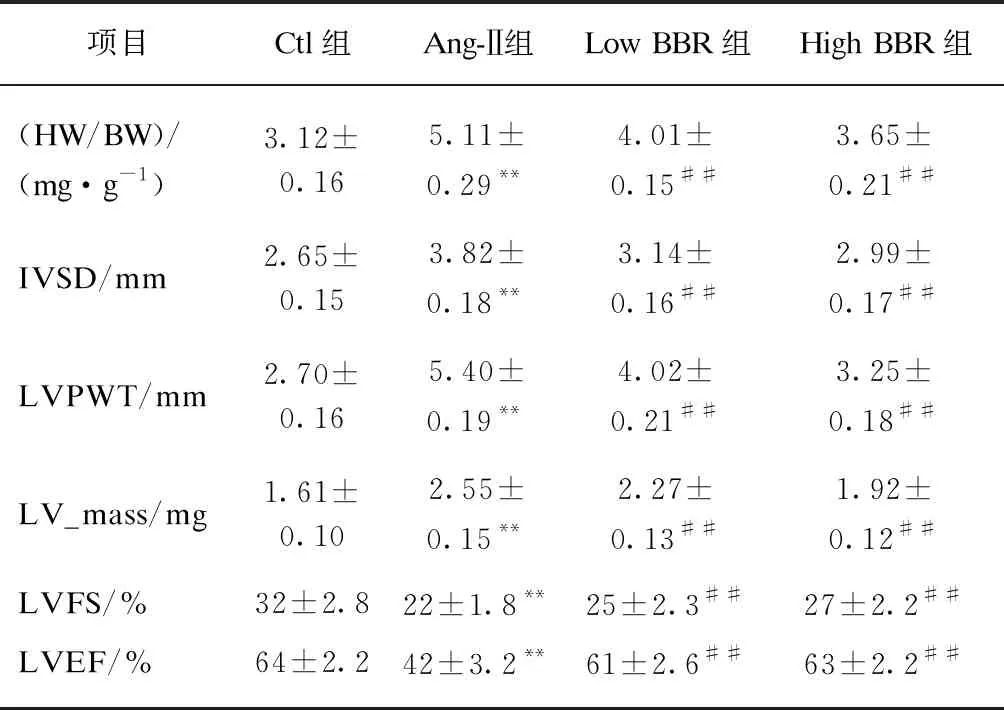
表1 各组大鼠心脏和体重比值以及心超检查结果
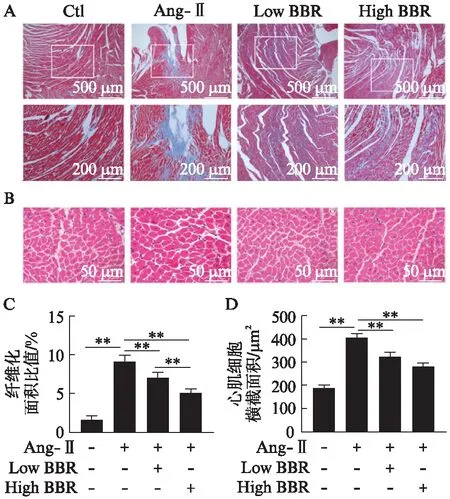
图2 黄连素抑制Ang-Ⅱ诱导的心肌纤维化Fig.2 Berberine inhibits angiotensin Ⅱ-induced cardiac fibrosisA: 各组心室组织行Masson染色,观察纤维化程度,计算各组纤维化面积比值;B: 各组心室组织行H-E染色,观察心肌细胞,计算心肌细胞横截面积;C: 各组心室组织纤维化面积比值比较,**P<0.01;D: 各组心肌细胞横截面积比较,**P<0.01
2.3 黄连素通过下调CDK2活性抑制血管紧张素Ⅱ诱导的心肌纤维化
大鼠心室组织提取总蛋白后行Western印迹法检测,结果显示,Ang-Ⅱ 明显上调CDK2-T160磷酸化水平(P<0.01)及Cyclin D1表达(P<0.05),高剂量黄连素处理组的大鼠心肌细胞CDK2-T160磷酸化水平及Cyclin D1表达较Ang-Ⅱ组均明显降低(P<0.05),与空白对照组相比差异无统计学意义(P>0.05),而低剂量黄连素处理组仅Cyclin D1有明显降低,差异有统计学意义(P<0.05),CDK2-T160磷酸化水平下降不是很明显(P>0.05),见图3。
2.4 心脏成纤维细胞鉴定及黄连素对细胞毒性测定
在倒置显微镜下观察分离培养的心脏成纤维细胞呈梭形或多角形,细胞核呈椭圆形,胞体较大,细胞排列紧密,不易聚集成团,无自主搏动。Vimentin染色为阳性,α-SMA染色为弱阳性,细胞计数表明所分离培养的细胞98%以上为心脏成纤维细胞[18],见图4A。CCK8毒性测定结果提示黄连素对细胞毒性呈浓度依赖型,经统计学分析和计算,IC50=177μmol/L,见图4B。
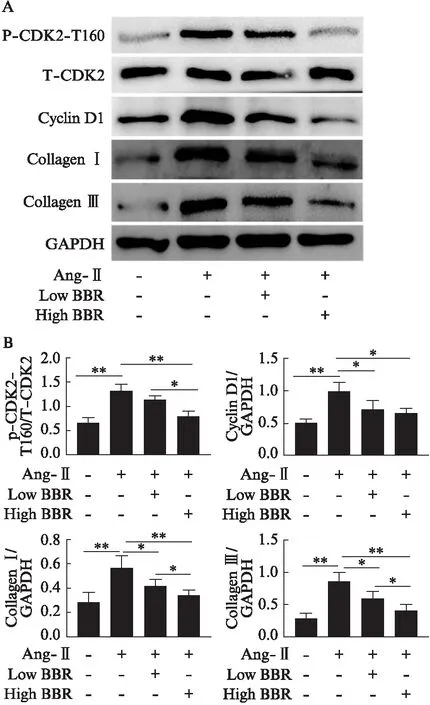
图3 黄连素通过下调CDK2活性抑制 Ang-Ⅱ诱导的心肌纤维化Fig.3 Berberine inhibits angiotensin Ⅱ-induced cardiac fibrosis by inactivation of CDK2A: Western印迹法检测CDK2-T160蛋白磷酸化、CDK2总蛋白表达量、Cyclin D1蛋白表达量、Collagen Ⅰ/Ⅲ蛋白表达量;B: 各组目标蛋白与GAPDH条带灰度值比较,及p-CDK2-T160与T-CDK2灰度值比值比较;*P<0.05;**P<0.01
2.5 黄连素抑制Ang-Ⅱ诱导的心脏成纤维细胞增殖
分离培养的心脏成纤维细胞经Ang-Ⅱ及不同浓度的黄连素处理24~48h后,采用CCK8检测细胞增殖,结果提示,经Ang-Ⅱ处理后心脏成纤维细胞增殖较Ctl组明显加快(P<0.01),48h后细胞增殖加快更加显著,而加入黄连素后,低浓度黄连素处理的细胞增殖较单纯Ang-Ⅱ组受到轻度抑制(P<0.05),而高浓度的黄连素处理后较低浓度黄连素组抑制效果更明显(P<0.05),尤其是在经过48h药物作用后,差异有统计学意义(P<0.05),见图4C。

图4 黄连素抑制Ang-Ⅱ诱导的心脏成纤维细胞增殖Fig.4 Berberine inhibits angiotensin Ⅱ-induced cardiac fibroblast proliferationA: 心脏成纤维细胞免疫荧光鉴定,绿色为Vimentin抗原阳性;红色为α-SMA抗原阳性,蓝色为DAPI染色;B: 黄连素对心脏成纤维细胞毒性测定;C: 细胞增殖检测,与Ang-Ⅱ组相比,*P<0.05,**P<0.01,与Ang-Ⅱ+Low BBR组相比,#P<0.05
2.6 黄连素抑制Ang-Ⅱ诱导成纤维细胞增殖于G0/G1期
心脏成纤维细胞经Ang-Ⅱ及黄连素处理后,于流式细胞仪检测细胞增殖情况,计算S+G2期百分比。结果显示,与Ctl组相比,Ang-Ⅱ处理后细胞增殖明显加快(P<0.01),黄连素处理可明显抑制细胞增殖于G0/G1期(P<0.05),高浓度黄连素较低浓度黄连素抑制增殖效果更明显(P<0.05),且与Ctl组相比差异无统计学意义,见图5。
2.7 黄连素通过下调CDK2活性来抑制血管紧张素Ⅱ诱导的心脏成纤维细胞增殖
Western印迹法显示,Ang-Ⅱ可明显提高细胞CDK2-T160磷酸化水平(P<0.01)及Cyclin D1表达(P<0.01),高剂量黄连素处理后大鼠心肌细胞CDK2-T160磷酸化水平及Cyclin D1表达较Ang-Ⅱ组均明显降低,差异有统计学意义(P<0.05,P<0.01),与Ctl组相比差异无统计学意义;而低剂量黄连素处理后CDK2-T160磷酸化水平及Cyclin D1表达下降不明显,差异无统计学意义(P>0.05),见图6。
2.8 CDK2-T160D超表达后黄连素对心脏成纤维细胞增殖的抑制作用消失
CDK2-T160A是显性阴性突变体,突变后T160不能被上游分子磷酸化,而CDK2-T160D是显性阳性突变体,突变后其磷酸化被固化。CDK-T160A及CDK2-T160D病毒包装、感染细胞,在Ang-Ⅱ及黄连素作用后,CCK8检测提示,黄连素处理后Ade-CDK2-T160A感染的心脏成纤维细胞增殖变化不显著,而CDK2-T160D超表达后明显促进细胞增殖(P<0.01),结合之前黄连素对Ang-Ⅱ诱导的野生型SD大鼠成纤维细胞增殖有抑制作用,说明CDK2-T160D超表达后黄连素对细胞增殖的抑制作用消失,见图7A。而比较加或不加黄连素对于Ade-CDK2-T160A或Ade-CDK2-T160D感染细胞的区别,结果显示低浓度或高浓度黄连素对细胞增殖的作用均不显著,见图7B。

图5 黄连素抑制Ang-Ⅱ诱导的心脏成纤维 细胞增殖伴有CDK2活性下调Fig.5 Berberine inhibits angiotensin Ⅱ-induced fibroblast proliferation and inactivates CDK2A: 流式细胞术检测各组细胞增殖;B: 各组S+G2期细胞百分比比较;*P<0.05,**P<0.01
2.9 CDK2-T160D超表达后显著上调经黄连素处理后的心脏成纤维细胞CDK2活性
用黄连素处理病毒感染及Ang-Ⅱ 刺激的细胞后,Western印迹法显示,黄连素对Ade-CDK2-T160A感染的心脏成纤维细胞CDK2-T160磷酸化作用不明显,CDK2-T160D超表达后各组CDK2总蛋白量较CDK2-T160A各组变化不明显,而CDK2-T160磷酸化水平明显升高,差异有统计学意义(P<0.01),结合之前黄连素可以抑制Ang-Ⅱ诱导的CDK2-T160磷酸化的结果,说明CDK2-T160D的超表达使得黄连素不能通过抑制CDK2-T160的磷酸化来下调CDK2的活性,见图8。
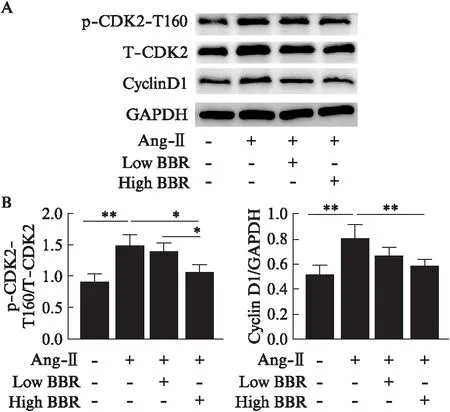
图6 黄连素下调CDK2活性Fig.6 Berberine inactivates CDK2A: Western印迹法检测CDK2-T160蛋白磷酸化、CDK2总蛋白表达量及Cyclin D1蛋白表达量;B: 各组p-CDK2-T160、CDK2及Cyclin D,表达比较*P<0.05,**P<0.01
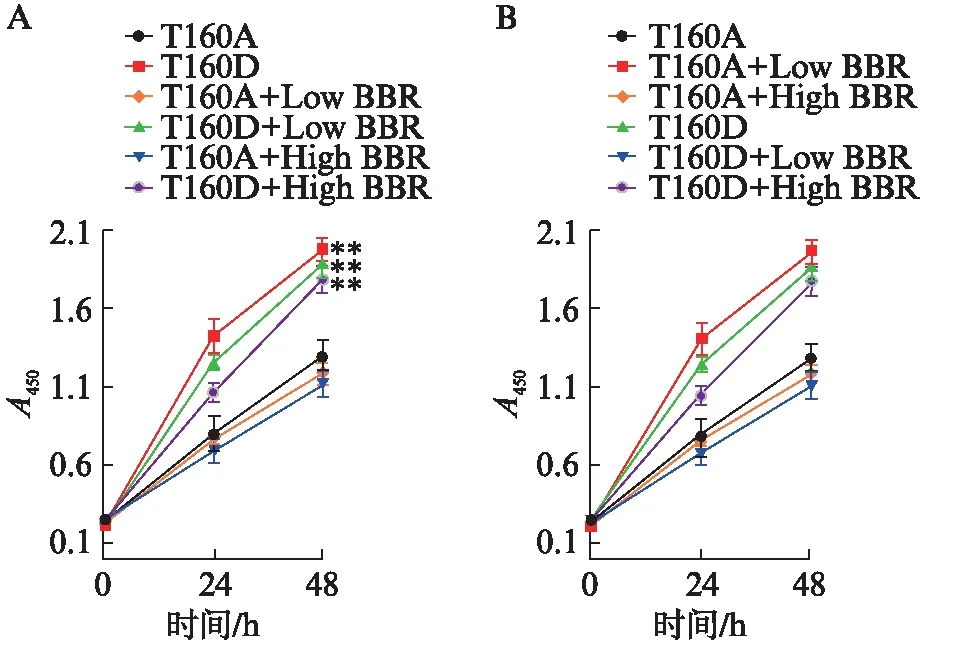
图7 CDK2-T160D超表达后黄连素对心脏成 纤维细胞增殖的抑制作用消失Fig.7 Overexpression of CDK2-T160D in cardiac fibroblasts blocked the inhibitory effect of berberine on cell proliferationA: Ade-CDK2-T160A或Ade-CDK2-T160D感染后细胞增殖比较,*P<0.05,**P<0.01;B: 黄连素对Ade-CDK2-T160A或Ade-CDK2-T160D感染后细胞增殖的影响
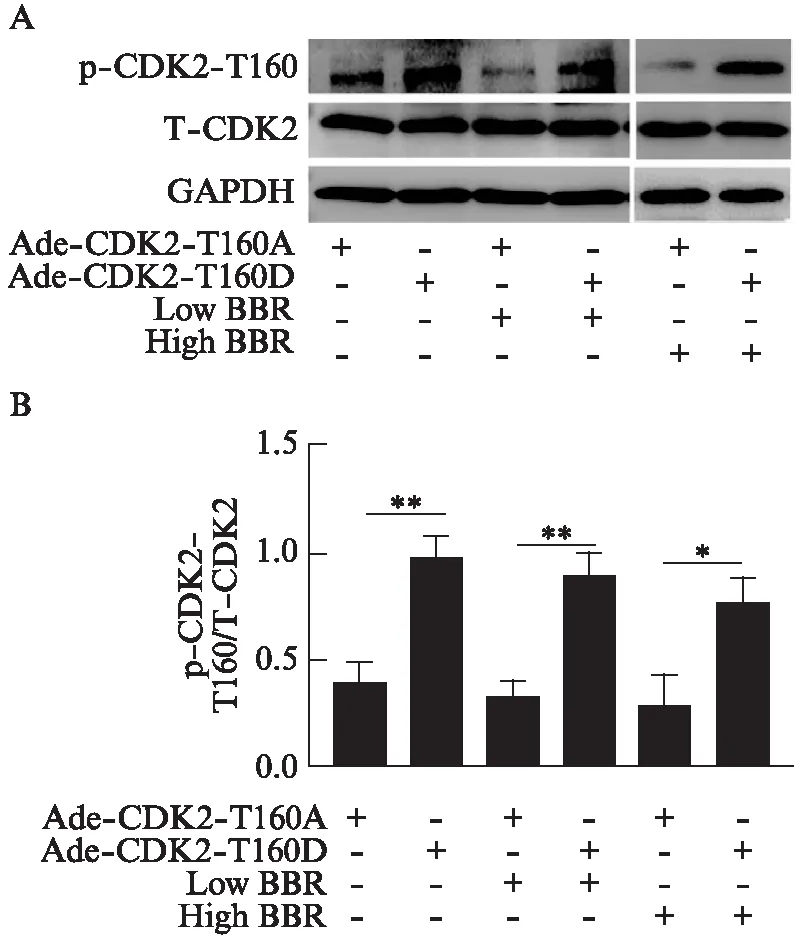
图8 黄连素通过下调CDK2活性实现对血管紧张素Ⅱ 诱导的心脏成纤维细胞增殖的抑制作用Fig.8 Berberine inhibits angiotensin Ⅱ-induced fibroblast proliferation through inactivation of CDK2A: Western印迹法检测CDK2总蛋白表达量及CDK2-T160磷酸化水平;B: 各组p-CDK-T160与T-CDK2比较,*P<0.05,**P<0.01
3 讨 论
心肌纤维化是由炎症或其他损伤导致的纤维结缔组织对心脏侵害的结果,是心肌重构的重要病理过程[1-2]。心肌细胞再生能力可以忽略不计,急性心肌梗死后,大量心肌细胞因为急性缺血死亡而触发炎症反应,最终导致胶原蛋白性瘢痕替代死亡的心肌[19-20]。在没有完全梗死的情况下,其他的病理生理状况也会诱发隐性间质和血管周胶原沉积,最终导致纤维化,比如高血压或主动脉瓣狭窄引起的压力超负荷以及瓣膜反流性病变引起的容量超负荷[1,21]。另外肥厚型心肌病、扩张型心肌病、代谢紊乱以及多种毒性损伤也常常表现为明显的心肌纤维化[22]。心肌纤维化会增加左心室的僵硬度,阻碍心脏的收缩和舒张,导致心力衰竭,同时改变心电传导引起心律失常[3-4]。因此抑制或逆转心肌纤维化及其不良后果是目前临床用于治疗心脏病的干预措施的主要目标,对缓解心力衰竭、心律失常的发生是有益的,但是由于纤维化的病理机制复杂,目前针对心肌纤维化的治疗方法匮乏且疗效甚微。
Ang-Ⅱ及其受体在心肌纤维化病理进程中起重要作用,低剂量的Ang-Ⅱ已用于诱发心脏肥大和广泛的心肌纤维化[22-23]。本研究在体内实验显示,中低剂量及高剂量黄连素灌胃处理大鼠后可显著降低Ang-Ⅱ诱发的心肌纤维化程度,减轻其引发的大鼠心功能不全,并且小剂量黄连素治疗即可取得显著治疗效果。体外实验显示,黄连素可显著抑制Ang-Ⅱ诱导的成纤维细胞增殖,这与以前的实验结果相符。在体内及体外实验中,小剂量黄连素即可表现出显著抑制Ang-Ⅱ诱导的心肌纤维化的作用,心肌纤维化程度及成纤维细胞增殖均明显受到抑制,而高剂量黄连素这种抑制效果更明显,表明黄连素抑制心肌纤维化的作用呈浓度依赖性,并且是一种比较安全的抑制心肌纤维化的药物。
既往的研究[24-25]表明,心脏成纤维细胞过度分化和增殖在心肌纤维化过程中的作用至关重要。流式细胞术检测显示,Ang-Ⅱ可促进心脏成纤维细胞由G0/G1向S及G2转变加速细胞增殖,而经黄连素处理后,可明显抑制细胞向S期转化,下调DNA合成,从而起到抑制增殖的作用。细胞增殖周期通过高度受控的过程调节细胞增殖,该过程涉及复杂的细胞事件级联反应,包括Cyclin和细胞周期蛋白依赖性激酶(CDK),CDK2/Cyclin D1复合体是细胞周期从G0/G1到S期转变的重要因子[16,26]。Western印迹法检测结果提示,黄连素在体内及体外均明显抑制了Ang-Ⅱ诱导的CDK2-T160磷酸化,并抑制Cyclin D1的表达。体外用CDK2-T160A及CDK2-T160D腺病毒感染心脏成纤维细胞后,用Ang-Ⅱ及黄连素处理细胞,结果显示低浓度及高浓度黄连素对Ade-CDK2-T160A组细胞的增殖抑制作用不显著,Western印迹法检测提示黄连素对Ade-CDK2-T160A组细胞的CDK2-T160磷酸化水平影响也不显著。而随着CDK2-T160D被超表达,黄连素对细胞增殖的抑制作用消失,细胞增殖明显加快,Western印迹法检测提示CDK2-T160D超表达后细胞内CDK2表达量较CDK2-T160A组变化不明显,而CDK2-T160磷酸化水平明显增加,提示CDK2-T160D超表达使黄连素丧失对CDK2活性的下调作用。因此,本研究认为黄连素通过下调CDK2活性来抑制Ang-Ⅱ 诱导的成纤维细胞增殖达到抑制心肌纤维化的作用,其作用位点为T160。
当前的研究存在的局限性在于,体内实验仅研究了Ang-Ⅱ及黄连素对心脏成纤维细胞的作用,没有研究黄连素对其他细胞的影响,因此需要进一步的研究以阐明黄连素对其他细胞影响的特定机制。
综上所述,黄连素通过抑制CDK2-T160磷酸化下调CDK2活性来显著抑制心脏成纤维细胞的增殖及心肌纤维化。心肌纤维化及成纤维细胞的增殖可能与CDK2-T160磷酸化位点有关,因此CDK2-T160可能是防治心肌纤维化新的靶点。

