基于“问题—探究”模式的教学设计与实践
——以“化学平衡”教学为例*
王美芹,王 颂
(菏泽家政职业学院,山东 菏泽274300)
美国教育家布鲁纳认为“学生不是被动的知识接受者,而是积极的信息加工者”,学习应是主动发现的过程.布鲁纳的认知结构理论强调学生的主体作用,但从我国的国情和教育环境来看,教师的主导作用不能忽视.这就要求教师由知识的讲授者、灌输者转变为学生加工信息的帮助者和促进者,通过对新知识问题的交流、讨论和探究,锻炼学生的思维.“问题—探究”教学模式是借鉴“发现探究”教学模式,将“传统的讲授事实性知识”的教学与“以学生为中心”的教学有机结合,运用布鲁纳的认知结构理论,使学生在问题引导下,通过独立或小组讨论、合作实验探究活动,发现获取新知识信息、发展智慧技能的教学模式[1].该教学模式中,学生的主要学习方式是理解与应用,改变传统教学模式中以记忆为主的学习方式.
“化学平衡”是高职医用化学教学的重点和难点,这是因为“动态平衡观念”是化学课程的核心素养之一,又由于其移动原理条件多变,导致化学平衡移动方向的判断难度较大,又使其成为教学的难点.本文“化学平衡”的课堂教学设计为当前高职化学重难点教学的解决和学生能力的提升提供参考.
1 教学设计理念
教学价值取向由 “学科知识为本”转变为 “学科核心素养为本”[2].以“化学平衡”为代表的化学原理模块一般比较抽象,而高职学生绝大多数化学基础较差,学习主动性和自学能力均有所缺失.在“问题—探究”教学模式下,要求教师扮演好指导促进者,改变以往“讲授灌输为主”的观念,结合课程知识特点,精心设计引导问题和知识的呈现、探究方式,“授人以渔”,激发学生学习兴趣,充分发挥其主体作用,调动其学习的主动性和积极性,提高自主学习能力、创新能力,训练学生将化学知识融入生活,服务生活的能力[3].
1.1 挖掘生活知识内涵,精心设计问题
化学既是一门实验科学,也是一门应用科学.生活与化学虽属不同的体系,却在内涵上融会贯通.利用这种相似性展开课堂教学,创设情境真实化,有利于活跃课堂气氛,亦有利于学生对化学知识的正确理解与掌握.
本教学设计在教学中引导学生从实际生活事例中“发现”化学平衡移动规律—通过分析生活中“冰水混合物”的现象,了解平衡体系中冰与水相互转化的规律,引出化学平衡移动原理,简化了原理推导程序,把更多课堂时间给学生讨论探究,训练培养学生思维能力.
1.2 借助实践呈现知识,强化原理应用
从“下雪不冷化雪冷”这样一生活话题为切入点,引发出“化学平衡移动规律”的问题,再用这个规律去启发学生智慧思维,解释一些化学问题(如:饱和溶液、沉淀溶解平衡、弱电解质电离平衡、缓冲作用机制、氧化还原反应中电子得失平衡等),以及借助化学平衡原理教育学生正确看待生活中的得与失,引导学生树立正确的价值感,提升其道德水平.
1.3 注重知识纵向与横向间的联系,降低学习难度
把化学抽象的知识用数学知识建立模型来解决,有利于降低学习难度[4].通过化学平衡常数与浓度商的数学表达式和二者之间的相对大小,对化学平衡的移动方向进行推理和解释,加深了对平衡移动原理和平衡常数的理解,同时通过数学公式和符号表征也使抽象的原理更加简单明了.
2 教学设计与实践
本文讨论“问题—探究”教学模式在基础化学课程“化学平衡的移动”一节教学中的应用.教材涉及的教学内容包括: 1)浓度、压强、温度对化学平衡移动的影响; 2)化学平衡移动原理; 3)化学平衡移动原理的应用(如:利用原理判断平衡移动的方向等).
“化学平衡移动原理”目前各版本的教材基本都采用从浓度、压强、温度三个维度上,通过对实验现象的分析,分别展开来阐述,最终归纳得出化学平衡移动原理[5~7].本节教学设计改传统繁琐的原理推导过程为通过生活实例直接引出原理、验证原理、应用原理的过程,最终达到“以理解与应用为主”的问题—探究学习方式替代“以记忆为主”的传统讲授学习方式,使学生在学习过程中主动、积极加工信息.具体教学设计和实践如下:
2.1 化学平衡移动原理
设计1:提出问题“为什么下雪后化雪时比下雪时还要冷?”
目的:创设情境,激发学生思考现实生活中蕴含的知识,为分析“冰水混合物平衡体系的移动规律”和引出化学平衡移动原理埋下伏笔.
实践1:引导学生分析
1)下雪是空气中的水凝结为雪花(冰),过程放热;雪融化是雪花(冰)变成水,过程吸热.
实践2:师生共同总结化学平衡移动原理
如果改变影响体系平衡的条件之一(如:浓度、压强或温度等),那么平衡就会向能够削弱这种改变的方向移动.这个规律就是化学平衡移动原理,也叫吕·查德里原理.
2.2 浓度对化学平衡的影响
设计2:提出问题“当可逆反应达到平衡后,在其他条件不变时,若增加反应物的浓度,正反应速率V正和逆反应速率V逆如何改变?平衡是否移动?如何移动?为什么?”
目的:注重新旧知识的联系,训练学生分析问题解决问题的能力,培养其创新意识.通过引导学生回顾“正、逆反应速率相等是可逆反应达平衡的根本原因”,分析增加反应物的浓度时,V正>V逆……发现、解释新知识.
实践3:利用化学平衡移动原理,鼓励学生思考讨论,自主推导出结论.
浓度对化学平衡的影响规律:在其他条件不变时,增大反应物的浓度或减小生成物的浓度,平衡向正反应方向移动(即平衡向右移动);增大生成物的浓度或减小反应物的浓度,平衡向逆反应方向移动(即平衡向左移动).
实践4:(讨论重点)提示学生从浓度改变对正、逆反应速率影响的角度分析解释浓度对化学平衡的影响规律.
教师强调:浓度的改变使正逆、反应速率发生改变且不再相等,因此化学平衡才发生移动(见图1).

图1 增大反应物浓度对化学平衡的影响
实践5:设计实验,利用原理预测实验结果并实验验证之(学生自主完成).
提示:在做探究实验时,教师应给学生尽可能多的选择余地,试验台上除放置有符合老师设计方案的实验药品,也要有可供学生选择的药品.如:


设计3:提出问题“可逆反应达到平衡后,其他条件不变,当浓度改变时,平衡常数K是否改变?K与浓度商Qc的关系,如何影响平衡移动的方向?”
目的:强化与旧知识化学平衡常数的联系,同时通过理论数学计算,深化理解化学平衡移动原理,体会不同学科间知识的联系,培养科学素养.
实践6:教师讲解

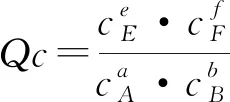
实践7:(讨论重点)首先引导学生自主分析,然后师生共同总结得出结论.
在其他条件不变时,增大反应物的浓度或减小生成物的浓度,Qc均小于K;增大生成物的浓度或减小反应物的浓度,Qc均大于K.由此可得出:
Qc=K,反应体系处于平衡状态,平衡不移动;
Qc Qc>K,平衡向逆反应方向进行. 说明:平衡常数K与反应物的浓度和生成物的浓度、体系的压强均无关,其大小与物质的性质和温度有关.温度不变时,改变浓度或分压,此时K不变,变化的是Qc;浓度或分压不变,改变温度,此时Qc不变,变化的是K. 根据K、Qc二者的相对大小对化学平衡的移动方向进行推理和解释,是对宏观现象的微观解释和符号表征,化学学科独特的这种思维方式,可较好地强化学生宏观辨识和微观探析能力. 实践8:巩固知识,解决问题 练习1:根据K与Qc的关系,解释向平衡体系溶液中加水稀释时平衡的移动情况. 提示学生思考方向:各物质的浓度都将发生倍数n变化,此时浓度商为Qc=n(e+f-a-b)·K, 若(e+f)>(a+b),则Qc>K,平衡向逆反应方向进行; 若(e+f)<(a+b),则Qc 若(e+f)=(a+b),则Qc=K,平衡不移动. 练习2:试判断“对平衡体系: 加水稀释后,溶液颜色会如何变化?” 设计4:提出问题“打开啤酒瓶盖后为什么会有大量气泡?” 目的:培养学生知识迁移、应用能力,以及将化学知识融入生活,服务生活的能力. 对学困生提示: 在其他条件不变时,当体系体积缩小,压强增大时,各反应物的浓度和生成物的浓度均增大为原来的n倍,此时浓度商Qc=n(e+f-a-b)·K. 若(e+f)>(a+b),则Qc>K,平衡向逆反应方向进行; 若(e+f)<(a+b),则Qc 若(e+f)=(a+b),则Qc=K,平衡不移动. 实践9:激励学生自己归纳总结得出压强对化学平衡移动的影响规律: 在其他条件不变时,若增大压强(体系体积缩小),则平衡向减小压强(减少气体物质的量)的方向移动;若减小压强(体系体积增大),则平衡向增大压强(增加气体物质的量)的方向移动. 实践10:强化认识 练习3:对反应前后气体物质的量相等的可逆反应和无气体参加的可逆反应,改变压强,其平衡是否移动?为什么? 练习4:观察450℃时,N2与H2反应生成NH3的实验数据见表1,让学生说出:在一定温度下,增大压强,合成氨平衡移动如何移动?为什么? 表1[9] 合成氨反应在不同压强下的平衡体系中NH3的含量 设计6:可否用实验验证压强对化学平衡移动的影响规律? 目的:体验成功的快乐,激发学生学习兴趣,培养其创新能力. 实践11:自己设计实验,验证压强对化学平衡移动的影响规律. 实践12:巩固新知识 练习:5:当其它条件不变时,增大压强缩小容器体积,试判断下列平衡的变化情况. 设计7:提出问题:合成氨反应[11]: 1)充入一定量的惰性气体,Qc是否改变?平衡是否发生移动? 2)充入一定量的氮气、氢气或氨气,平衡移动方向如何? 目的:强化正确灵活应用知识的能力,培养严谨科学思维. 提示学生:分析思路需清晰.体系压强改变对化学平衡的影响,是通过影响反应物和生成物浓度的变化而实现的.通过教师讲解指导,让学生认识压强影响平衡移动的实质,引导学生把压强问题点转到浓度变化对平衡的影响. 实践13:师生共同总结分析 分析一:充入惰性气体,可增大体系总压,但体系的体积没有变化,故各个组分的浓度不变,所以Qc不改变,平衡也就不会移动. 分析二:由于反应容器恒温恒容,充入氨气使[NH3]增大,[N2]和[H2]均不变,Qc大于K,平衡向逆反应方向移动. 发现问题:多数学生对此题分析时,常常只会考虑到充入氨气使容器压强增大,不会考虑到容器体积不变,其他成份分压(浓度)不变这一因素,因而出现“平衡会向正反应方向移动”的错误结论. 目的:通过师生共同分析、讨论、探究问题,强化学生的学科核心素养. 实践13: 1)师讲 化学反应常伴随着放热或吸热现象的发生.放出热量的反应称为放热反应,吸收热量的反应称为吸热反应.一般在化学方程式右端写出热量变化,用符号“△H”表示,放热反应的△H为负值,用“—△H”表示,吸热反应的△H为正值,用“+△H”表示,例如:NO2生成N2O4的反应为吸热反应,可表示为: 对于可逆反应,如果正反应是吸热反应,那么逆反应就一定是放热反应;如果正反应是放热反应,那么逆反应一定是吸热反应,且正反应吸收(或放出)的热量与其逆反应放出(或吸收)的热量相等. 2)引导学生分析温度对化学平衡的影响规律 实践14:教师演示实验,验证温度对化学平衡的影响规律 将装有 NO2和 N2O4混合气体的平衡仪的一端放入盛有热水的烧杯中,另一端放入盛有冰水的烧杯中,试观察平衡仪两端玻璃球内混合气体颜色的变化. 实验前,先让学生预测实验结果,两个烧杯中玻璃球气体颜色的如何变化?然后再进行演示实验,并让学生认真观察实验现象,检验自己的判断是否正确.从中体会到成功(判断正确)的快乐. 设计9:提出问题 为什么北大2017毕业典礼校长致辞说“吃亏就是占便宜”? 目的:通过师生共同讨论,借用“氧化还原反应中的电子得失平衡,氧化剂得到电子所成物质未必比还原剂失去电子所成物质更有价值”等,启发学生智慧思维,感悟生活中蕴含的“平衡”哲理,加深对“平衡观念”的认同感,实现思政与课程的融合. 实践15:学以致用 练习1:人吸入CO后,CO会与人体中的血红蛋白结合建立如下平衡: 当HemCO浓度为HemO2浓度的2%时,人的智力就会受到严重损伤.如果有人发生了CO中毒,根据化学平衡移动原理,请你说说应该如何救治? 练习2:已知反应: 请学生查阅文献、网上搜索科学家哈珀对“合成氨反应”进行的实验,了解哈伯合成氨应用于军事的史实.进一步提升学生自主学习能力和分析解决实际问题的能力,同时培养其科学精神和勇于承担社会责任的意识. 人生哲理博大精深,化学世界亦是如此,化学与人生可以交互诠释[12].在教学过程中,教师要进一步挖掘化学平衡移动原理的价值和功能,精心创设教学情境,实现情境与知识的交融,从“学科知识本位”转向“学科核心素养本位”,通过问题讨论探究,帮助学生透彻理解、正确掌握化学知识原理,让化学知识融入生活、服务生活,有效提升学生的自主学习能力、创新能力、思政素养等,使学生适应社会市场人才的发展变化.化学平衡移动原理不仅是基础化学的重点和难点,也是生活的重要哲理,其部分实验期待进一步改进.2.3 压强对化学平衡的影响


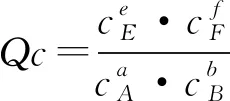





2.4 温度对化学平衡的影响规律



3 结语

