正、逆反应速率的概念辨析
◎
一、问题的提出
化学反应速率是化学反应原理的重要组成部分,是指某一物质在单位时间内物质的量浓度的变化,通常用以表述化学反应的快慢。《普通高中化学课程标准(2017 年版)》对化学反应速率的教学要求是“知道化学反应速率的表示方法,了解化学反应速率的简单方法[1]”。根据课程标准的要求,化学反应速率的表示方法是高中化学知识的必讲内容。
化学平衡是在化学反应速率和可逆反应的基础上提出的一个新的概念性知识,其中化学平衡的定义以及影响因素是高中化学的重点和难点[2]。改变平衡的条件,判断平衡移动的方向更是高考中重要的考点。学习化学平衡不仅能够加深学生对化学反应速率的理解,而且是后续学习水解平衡、沉淀溶解平衡和电离平衡的基础,在化学反应原理的学习中起着承上启下的作用。掌握化学平衡的定义,在这一内容学习中显得尤为重要。国内三套不同版本的高中化学教材对“化学平衡”的概念界定如表1 所示。

表1 高中化学教材中“化学平衡”的概念表述
通过比较发现三套教材对于化学平衡的定义并无太大差别,均提到了化学平衡的条件之一是正反应速率和逆反应速率相等。但教材中在讲述化学反应速率时并没有涉及到正、逆反应速率的概念,概念的缺失导致学生在学习此部分内容时会产生以下困惑:
1.错误正逆反应速率的含义
受到字面意思“正”和“逆”的影响,学生往往会认为正反应速率是指用反应物表示反应速率,逆反应速率是指用生成物表示的反应速率[6]。以可逆反应2SO2+O2⇌2SO3为例,学生可能会认为当反应达到化学平衡状态时υ(SO2)=υ(O2)=υ(SO3),这显然是不正确的。
2.对净反应速率、正反应速率和逆反应速率之间的关系理解混乱
在可逆反应的学习时,教师往往会告诉学生“净反应速率=正反应速率-逆反应速率”。由于在学习“化学反应速率”的概念时,学生已经知道用不同的物质表示同一化学反应在同一时间段内的反应速率其数值大小是不一定相同的。当学生看到这里的净反应速率、正反应速率和逆反应速率,联想到化学反应速率的概念,便会产生疑惑,这三种反应速率用不同物质表示时是不是不同? 如果是,这里指的是哪种物质的反应速率呢?
3.学习“化学平衡”时产生迷思概念
“化学平衡”是高中教学的重点和难点,研究表明,在学习化学平衡时学生会产生许多迷思概念[7],其中有很多都是因为对正反应速率和逆反应速率的错误理解造成的。例如,有学生会认为化学平衡状态的标志是“A 的正反应速率等于B 的逆反应速率[8]”或“达到化学平衡时,体系内各物质的反应速率相等[9]”。
毋庸置疑,学生在学习时产生以上困惑增加了学生学习的负担,导致教学活动面临“教师教的吃力,学生学的困难”的局面。通过文献调研发现,很多研究者指出了这方面存在的问题,但鲜有人给出清晰明确的解决方案[10]。
不难发现,产生上述困惑的根本原是中学化学教材中缺乏对正反应速率和逆反应速率概念的清晰解释。为了帮助学生更清晰、深入的理解正、逆反应速率的内涵,明确可逆反应中三种化学反应速率之间的关系,消除学习化学平衡概念时产生的迷思概念,本文将基于学生的认知水平,在可逆反应的基础上,借鉴教材中关于化学反应速率的概念,尝试定义了正反应速率和逆反应速率,推导在某一反应体系中用不同物质表示正反应速率和逆反应速率的公式,对净反应速率、正反应速率和逆反应速率之间的关系做详细说明,并重新表述了化学平衡的定义。
二、概念界定
1.化学反应速率
在学习正反应速率和逆反应速率之前,应当首先知道何为“化学反应速率”。中学教材对“化学反应速率的定义”如表2 所示:

表2 高中化学教材中“化学反应速率”的概念表述
查阅相关大学教材后发现,关于“化学反应速率概念”的表述与中学教材基本一致,如表3 所示:

表3 大学化学教材中“化学反应速率”的概念表述
由表2 和表3 可知,无论是中学化学教材还是大学化学教材,“化学反应速率”概念的表述均没有涉及到可逆反应,而且很多教材中都指出可用“反应物浓度的降低或生成物浓度的增加”来表示化学反应速率,从这一点可以看出,对“化学反应速率”的定义是将化学反应默认为不可逆反应。
以人教版化学教材选修4“化学反应原理”为例,介绍化学反应速率的表示方法:
化学反应速率用单位时间内反应物或生成物的浓度变化来表示,通常是用单位时间内反应物浓度的减少或生成物浓度的增加来表示,即:
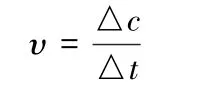
式中υ表示反应速率。c 表示各反应物或生成物浓度,△c表示其浓度变化(取其绝对值),t 表示时间,△t表示时间变化。
对任意一个反应,用符号来代替具体的化学物质,反应的化学方程式表示为:
mA+nB=pC+qD
反应体系中各物质的浓度分别表示为:c(A),c(B),c(C),c(D),则某一物质的反应速率表示为:
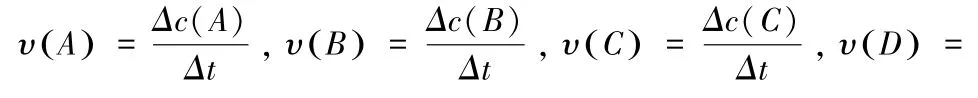
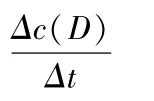
化学反应速率的大小可用化学反应中任意一种物质表示,其关系为:
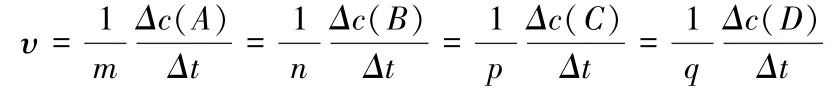
式中υ表示此反应的化学反应速率,单位为(浓度·时间—1)。
由此可见,用不同物质表示同一反应的化学反应速率时,由于各物质在化学方程式中的化学计量数不同,因此表示出的化学反应速率大小会有差异。
2.正反应速率和逆反应速率
中学化学中可将化学反应分为两类,分别是可逆反应和不可逆反应。在正、反两个方向上都能进行的反应称为可逆反应,把从左向右的过程称作正(向)反应,把从右向左的反应称作逆(向)反应。另一类化学反应其反应物能完全变为生成物,即反应能进行到底,把这一类反应称为不可逆反应。
我们查阅了大量文献,并没有找到有关于正反应速率和逆反应速率的明确定义,在华彤文主编的《普通化学原理(第4 版)》中,有这样的描述;“化学反应有可逆性,当正向反应开始进行之后,随之即有逆反应发生,所以实验上测定的反应速率实际上是正向速率和逆向速率之差,即净反应速率[13]”。这里的净反应速率就是可逆反应的化学反应速率,由此可知,只有在可逆反应中,才会出现正反应速率和逆反应速率的概念。可逆反应中涉及的正反应速率和逆反应速率,是抛开净反应速率,单从其中的一个方向来讨论微观状态下化学反应的速率。根据化学反应速率的定义,正反应速率就是正向反应中某一物质的化学反应速率,逆反应速率就是逆向反应中某一物质的化学反应速率。而由于正向反应和逆向反应的共同作用而体现出的宏观反应速率应称为此可逆反应的“净反应速率”,很多文献中将其简单称为“化学反应速率”是不严谨的。
正反应速率、逆反应速率和化学反应速率之间的关系应该是并列的,化学反应速率是指不可逆反应中的某一物质单向反应速率,正反应速率和逆反应速率是指可逆反应中某一物质的某一个方向的反应速率。正反应速率及逆反应速率的定义和化学反应速率定义应该是类似的,不同之处在于定义正反应速率及逆反应速率时需要强调反应的可逆性和方向性。
参照化学反应速率的定义,我们如下定义正反应速率和逆反应速率:对于可逆反应,当体系为气态或溶液时,正反应速率为单位时间内由于正反应造成的反应物或生成物的浓度(常用物质的量的浓度)变化量;逆反应速率为单位时间内由于逆反应造成的反应物或生成物的浓度(常用物质的量的浓度)变化量。
与化学反应速率类似,用不同物质来表示正反应速率或逆反应速率的大小时,其数值大小由于化学计量数的差异可能会有所不同,因此对于同一个化学反应,比较正反应速率和逆反应速率的大小时,应着重强调二者均是以同一种物质为基准。
三、关系梳理
1.可逆反应中的化学反应速率
在可逆反应中,同时存在三种化学反应速率,分别是净反应速率、正反应速率和逆反应速率,在梳理正反应速率和逆反应速率的概念时,已经提及对于一个可逆反应,其“净反应速率=正反应速率-逆反应速率”,这种表述方式放在大学教材中是没有问题的,因为在大学教材中,这三种速率的大小都能用唯一的速率方程表示,因此其数值是固定的。但中学阶段并没有涉及到速率方程,只是学习了用不同物质表示反应速率的方法,而用这种方法表示反应速率,由于化学方程式中计量数的差异会造成反应速率大小的数值不同。因此,在表述三者之间的关系时,要有一个前提,即是用同一种物质表示的反应速率。
笔者认为用以下方式表述三者之间的关系较为合适:在可逆反应中,用同一种物质表示反应速率时,净反应速率=正反应速率-逆反应速率。这里的净反应速率、正反应速率和逆反应速率,均是用同一种物质表示的。
2.化学平衡的判断依据
由正反应速率和逆反应速率的定义可知,在可逆反应中某一物质既有正反应速率,又有逆反应速率。判断化学平衡的依据之一是“正反应速率与逆反应速率相等”,这里所指的正反应速率和逆反应速率均是指同一物质的反应速率,只是一个是正反应造成的此物质的浓度变化量,一个是逆反应造成的此物质的浓度变化量,教师在教授化学平衡的概念时应着重强调这一点,若是用不同物质分别表示正反应速率和逆反应速率,由于化学计量数的差异,二者相等时是不一定能达到化学平衡状态的。
四、教学建议
1.中学教材中应明确表述正反应速率和逆反应速率的概念
正反应速率和逆反应速率是高中化学教学中的重要内容,其概念的缺失必定会给教师的教学和学生的学习带来负面影响。学生往往只是简单记住在可逆反应中有正反应速率和逆反应速率这两个名词,而不去思考其各代表什么含义。当教材中明确表述正反应速率和逆反应速率后,学生自然不会误以为正反应速率就是用反应物表示的反应速率,逆反应速率就是用生成物表示的反应速率了。
2.知道各反应速率间等式成立的先决条件
教师在教授可逆反应的有关内容时,都会告诉学生“净反应速率=正反应速率-逆反应速率”,但受到“化学反应速率”概念的影响,学生会知道用不同物质表示化学反应速率时大小是不一定相等的,那么这里的净反应速率、正反应速率和逆反应速率都是指哪种物质的反应速率呢? 教师在课堂教学中应主动将这个问题抛出,引发学生的思考,与学生交流讨论后得出结论:用同一种物质表示以上三种化学反应速率,等式才可以成立。
3.正确表述化学平衡的定义
化学平衡的学习向来是高中化学学习的一个重点和难点,如果对化学平衡的定义理解有误,不仅会产生很多迷思概念,而且对先前有关化学反应速率知识的巩固还是对后续各类溶解平衡知识的理解都是不利的。因此应着重强调概念中所说的正反应速率和逆反应速率都是用同一种物质表示的。化学平衡的定义应表述为:对于可逆反应,在一定条件下,当用同一种物质表示的正、逆两个方向的反应速率相等时,反应体系中所有参加反应的物质的量或浓度可以保持恒定的状态,称为化学平衡状态。如是定义化学平衡,也就解决了学生会产生“化学平衡状态的标志是A 的正反应速率等于B 的逆反应速率”等迷思概念的问题。
正反应速率和逆反应速率的缺失在高中教学中带来了诸多问题,本文基于化学反应速率的概念,在可逆反应的基础上,尝试定义了正反应速率和逆反应速率,建议中学阶段的化学教学中,应明确表述正反应速率和逆反应速率的概念,梳理在可逆反应中三种反应速率构成等式成立的先决条件,并正确表述化学平衡的定义。

