2020年慢性阻塞性肺疾病全球倡议《COPD诊断、治疗与预防全球策略》指南解读(一)
——稳定期药物管理
李正欢,张晓云,陈杨,宋雪利,秦中明,李红
专家说:
慢性阻塞性肺疾病全球倡议(GOLD)是美国国立心、肺和血液研究所(NHLBI)、美国国立卫生研究院(NIH)和WHO于1998年联合发起的,目的是为了提高临床医生对慢性阻塞性肺疾病(COPD)的认知,重视COPD的早期发现、管理及预防。GOLD于2001年首次发布了共识性文件,即《COPD诊断、治疗及预防的策略》,以后每5年进行一次重大更新,期间每年根据最新研究进行适当修改。与前几版共识性文件相比,GOLD 2020修订版增加了起始吸入性糖皮质激素治疗需要考虑的因素、调整了慢阻肺管理循环图表、改进了非药物治疗的随访要求、明确了慢阻肺急性加重的鉴别诊断。本文就GOLD 2020中有关COPD稳定期管理的部分内容进行了解读。
COPD是呼吸系统常见病和多发病,且发病率逐年增高,多项研究发现,COPD防治存在三低“早期诊断低、治疗依从性低、治疗规范性低”。构建“医院-社区-家庭”的COPD防治模式,提高基层医疗机构COPD防控能力,是解决此问题的一个较好办法。所以在GOLD 2020中,对稳定期患者的诊治,重点更新了稳定期管理流程:诊断、评估、初始治疗、再评估、调整,如此循环往复,并依据评估结果进行治疗的升级与降级,实现COPD治疗个体化。需要注意的是除对患者肺功能和总体病情评估外,还要注意装置吸入技术的评估,这些恰恰是全科医生日常需要完成的工作。COPD患者在专科医生制定初始治疗后,随访评估及治疗调整,又回到基层医疗机构,成为全科医生的管理对象,符合我国提倡的专科-全科分级诊疗要求,可见基层医疗机构是COPD防治的主战场,全科医生是COPD防治主力军。GOLD 2020为基层医疗机构对COPD的防治提供更多的解决方案,需要全科医生认真学习。
目前,慢性阻塞性肺疾病(COPD)是世界第三大死因,仅位于缺血性心脏病和卒中之后[1]。预计未来40年COPD的患病率将不断增加,到2060年每年可能会有超过540万人死于COPD及其相关疾病[2]。目前国内在COPD诊疗方面存在的主要问题是疾病评估和管理的全面性和准确性不够,治疗随意性大,尤其是基层医院对疾病相关循证指南更新掌握不及时、理解不到位,致使诊疗精度和效度不高,增加了疾病恶化和急性加重的风险,也增大了后续管理的难度。加快促进COPD诊断、治疗和预防的规范化,提高诊疗精度和效度具有重要的现实意义,本课题组将基于2020年慢性阻塞性肺疾病全球倡议(GOLD)《COPD诊断、治疗与预防全球策略》指南(简称:指南)和其他循证研究证据,从临床应用角度分别针对COPD稳定期药物管理、稳定期非药物管理和急性加重期管理进行全面阐释和分析,本指南解读(一)主要涉及稳定期药物管理,内容包括诊断评估、初期管理和后续管理。
1 诊断和评估
GOLD委员会强调,任何有呼吸困难、慢性咳嗽或咳痰,以及反复下呼吸道感染和/或长期危险因素暴露(吸烟/被动吸烟、生物燃料暴露、空气污染等)情况时均应考虑COPD(特别是40岁以上人群)。若吸入支气管扩张剂后,FEV1(第1秒用力呼气末容积)/FVC(用力肺活量)<0.7则证实存在持续性气流受限,COPD诊断可成立[3]。在COPD的诊断和评估方面目前基层医院主要基于临床和肺功能检查,但肺功能检查常未按照诊断操作规范进行(如检查前未常规吸入支气管扩张剂或吸入时间和剂量不正确等),影响诊断和病情评估的准确性(具体内容将在指南解读(二)中详述)。另一方面,基层医院的临床病例中很少记录体现GOLD分级、改良版英国医学研究委员会呼吸困难问卷(mMRC)、慢性阻塞性肺病评估测试问卷(CAT)评分和ABCD分组等,不利于全面评估病情。GOLD指南强调,COPD诊断一旦成立就需要进一步评估气流受限程度(GOLD分级),COPD对患者健康状况的影响包括不良事件如病情恶化、住院或死亡的风险,以及可能存在的合并疾病如心血管疾病、骨骼肌功能障碍、抑郁和肺癌等。如图1所示,在COPD综合评估方案中,以肺功能评估气流受限的严重程度;以mMRC和CAT分别评估呼吸困难程度和健康状况,并与中、重度急性加重病史(包括住院治疗史)共同评估恶化风险(ABCD分组);该方案肯定了患者症状和急性加重风险在指导COPD治疗中的重要性,医师可仅基于ABCD分组快速启动治疗方案。
2 稳定期药物管理
COPD稳定期管理的目的是减轻症状、提高运动耐力、改善健康状况,最重要的是减少恶化的风险(预防急性加重、防止疾病进展、减少死亡),需要反复多次进行病情评估和调整治疗方案(见图2)。
2.1 初期管理 稳定期管理的基础是要求患者戒烟(包括电子烟),减少接触职业性粉尘、烟雾气体以及室内外空气污染物等,对烟草依赖者除戒烟健康教育外,必要时可给予药物治疗如伐尼克兰、安非他酮缓释剂及各剂型尼古丁[4-6]。GOLD指南推荐的稳定期初始药物治疗见图3。
2.1.1 支气管扩张剂 吸入(不建议口服)支气管扩张剂是COPD症状管理的核心,给予常规基础剂量可以预防或减轻症状。
GOLD指南推荐所有A组患者,根据呼吸困难严重程度给予一种短效或长效支气管扩张剂;B组患者初始治疗应包括长效支气管扩张剂,对于合并严重呼吸困难者,可考虑使用两种支气管扩张剂进行初始治疗,同时注意识别和治疗其他合并症[7];推荐C组患者给予长效支气管扩张剂、长效胆碱能受体拮抗剂(LAMA),其对呼吸困难和急性加重均有疗效且在预防病情恶化方面优于长效β2-受体激动剂(LABA)[8];D组患者治疗可以从LAMA开始,但对于症状更严重的患者(CAT评分≥20分),特别是有更严重的呼吸困难和/或运动受限者,可选择LAMA+LABA作为初始治疗[9-10]。
GOLD指南指出,短效制剂一般仅用于偶尔出现呼吸困难的轻症患者,以及急诊呼吸困难症状的迅速缓解,除此之外长效优于短效,不建议长期使用短效制剂。LABA和LAMA能显著改善患者肺功能、呼吸困难、健康状况等[11],后者在减少急性加重次数方面更明显[12],且LABA+LAMA的联合治疗优于单药[9-10]。英国国家卫生与临床优化研究所(NICE)指南对LABA+LAMA使用的建议是需同时满足以下条件:(1)经肺功能检测确诊COPD;(2)无哮喘或无对类固醇激素反应的特征;(3)尽管对烟草依赖进行了治疗(针对吸烟者),进行了优化的非药物管理和疫苗接种,使用了短效支气管扩张剂仍然有呼吸困难和急性加重,但若两联疗法不能改善病情,排查其他原因(如吸入装置和无效吸入,以及其他躯体、心理疾病等)后可以考虑再次降级为单一疗法。
综上所述,对于COPD轻症患者(A组)可以考虑以一种短效或长效支气管扩张剂作为初始治疗,其中短效支气管扩张剂如沙丁胺醇仅用于症状明显时的缓解,不用做长期维持治疗。对于B组患者,应使用长效支气管扩张剂作为初始治疗,症状相对较轻者,可仅使用一种长效支气管扩张剂(LAMA或LABA);症状相对较重者,可以考虑使用两种长效支气管扩张剂(LAMA+LABA)进行初始治疗,并注意识别和治疗其他合并症。对于C组患者,推荐以LAMA如噻托溴铵作为初始治疗,后续可根据病情和治疗反应考虑其他升降级方案。对于D组患者,治疗可以从LAMA开始,但对于CAT评分≥20分,特别是有严重呼吸困难和/或运动受限者,可考虑LAMA+LABA作为初始治疗;嗜酸粒细胞计数>300个/μl的D组患者也可以考虑以LABA+吸入糖皮质激素(ICS)如布地奈德福莫特罗(粉吸剂)作为初始治疗(见图3);当合并哮喘时,LABA+ICS也可以考虑作为D组患者初始治疗的首选。

图1 COPD综合评估方案Figure 1 Combined COPD assessment
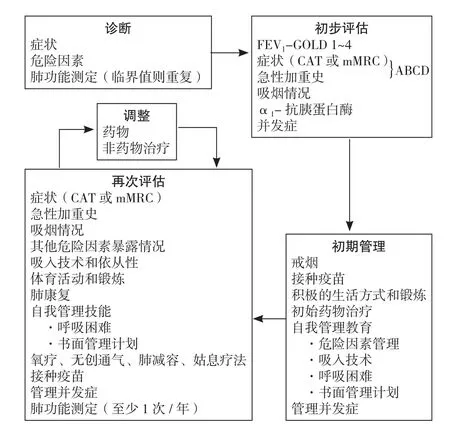
图2 COPD稳定期管理流程Figure 2 Management of COPD

图3 初始药物管理Figure 3 Initial pharmacological treatmen
2.1.2 糖皮质激素 嗜酸粒细胞可作为预估加用ICS预防病情恶化的生物标志物[13-14]。GOLD指南推荐,对于嗜酸粒细胞计数为300个/μl的患者,LABA+ICS减少病情恶化的可能性最大;对于有哮喘病史的COPD患者,LABA+ICS可能是首选。NICE指南对LABA+ICS使用给出的建议除第二条为“有哮喘特征或对类固醇激素反应的特征”外,其余同LABA+LAMA[15]。在1种或2种长效支气管扩张剂基础上启动ICS治疗时需考虑如下因素:若在标准长效支气管扩张剂维持治疗下,有急性加重住院治疗史,或急性加重≥2次/年,或嗜酸粒细胞计数>300个/μl,或伴有哮喘病史(伴发哮喘),则强烈推荐使用ICS治疗。若在标准长效支气管扩张剂维持治疗下,急性加重1次/年,或嗜酸粒细胞计数100~300个/μl,则考虑使用ICS治疗。若有反复肺炎病史,或嗜酸粒细胞计数<100个/μl,或分枝杆菌感染史,则不推荐使用ICS治疗[16-17]。其中强烈推荐使用、考虑使用、不推荐使用是三种独立的情况,如果不推荐使用与其他两种情况合并存在,建议不启动ICS治疗。
在中~极重度患者和急性加重期患者中,ICS+LABA联合使用在改善肺功能、健康状况和减少急性加重方面比单独使用任何一类药物均有效[18]。但如果患者对ICS治疗缺乏反应(如嗜酸粒细胞计数不降反升且症状持续不改善),或者因ICS不良反应需要停用,则应考虑从LABA+ICS切换到LABA+LAMA。但对于在LABA+ICS治疗中持续呼吸困难或运动受限的患者,可以添加LAMA升级到三联疗法,三联疗法可以改善肺功能、患者报告结局(PROs)和预防急性加重[19-20]。NICE指南对从LABA+ICS升级为三联疗法给出的建议是满足以下任意一条:(1)症状持续影响患者日常生活质量;(2)发生严重的需要入院的急性加重;(3)1年内发生2次中度急性加重。同理,如果具备后两条中任意一条则可以考虑从LABA+LAMA升级为三联疗法,但若只具备第一条时,可考虑先进行3个月的三联疗法,若症状改善则继续,若未改善则切换至两联疗法[15]。ICS可减轻病情加重并适度减慢呼吸道症状的进展,但似乎对肺功能和死亡率影响不大[21]。常规使用ICS治疗会增加患肺炎的风险,特别是有严重疾病的患者,GOLD指南不推荐ICS长期单药治疗,也不推荐长期口服糖皮质激素治疗[22]。NICE指南建议对继续使用激素的必要性每年至少审查1次[15]。
综上所述,启动ICS治疗需考虑的因素主要包括每年的急性加重史、嗜酸粒细胞计数、哮喘病史、肺部感染病史。临床上,不宜使用ICS进行长期单药治疗,一般应与LABA联合使用作为部分D组患者的初始治疗方案,再根据病情、治疗反应和药物不良反应考虑不同的升降级方案。
2.2 后续管理 当初始治疗反应不佳,出现呼吸困难加重和/或急性加重时的后续药物管理见图4。但应注意,对于需要抢救以快速缓解症状的患者应首先给予短效支气管扩张剂。管理过程中注意个体化,始终观察患者对升级治疗的反应,如果缺乏临床益处和/或发生不良反应,则应考虑降级治疗。对接受升级治疗的患者,当部分症状(如咳嗽咳痰、喘息气促、呼吸困难等)缓解时,也可以考虑降级治疗。
对LAMA+LABA二联疗法仍不能有效控制病情且嗜酸粒细胞计数≥100个/μl的患者,可考虑升级ICS+LAMA+LABA三联疗法。对嗜酸粒细胞计数<100个/μl的二联疗法患者和治疗反应不佳的三联疗法患者,均可考虑加用磷酸二酯酶抑制剂罗氟司特抑制气管炎性反应和/或考虑加用阿奇霉素预防感染(既往有吸烟史,尤其存在频繁加重者)。注意,在升级治疗前均应审查患者药物吸入方法是否正确,是否存在引起呼吸困难和急性加重的其他原因。
总之,升级和降级治疗均以呼吸困难症状和急性加重频率、程度作为主要的判断指标,因患者异质性较大,临床上没有固定的时间标准。如果呼吸困难症状加重和急性加重次数增多或程度加重,排除其他原因如合并疾病、不规律服药、不规范操作(吸入剂)等,可以考虑升级治疗。同理,如果呼吸困难症状明显减轻和急性加重次数减少或程度减轻且病情较平稳,可以考虑小剂量、缓慢减量或减药的降级治疗。
2.2.1 磷酸二酯4(PDE4)抑制剂 PDE4为细胞内特异性的cAMP水解酶,其抑制剂(罗氟司特)通过增加cAMP水平发挥抗炎、扩张支气管等药理作用。罗氟司特能改善肺功能,减少中度和重度急性加重;可以改善以固定剂量LABA+ICS联合治疗患者的肺功能并减少急性加重次数[3],且在有急性加重住院病史的患者中,罗氟司特的益处更大[23]。GOLD指南推荐,在重度至极重度气流受限、慢性支气管炎和急性加重的患者中,可以考虑在使用长效支气管扩张药(有或无ICS)的情况下添加PDE4抑制剂。

图4 后续药物管理Figure 4 Follow-up pharmacological treatment
总之,PDE4抑制剂罗氟司特是疗效确切的具有抗炎、解除支气管平滑肌痉挛等药理作用的COPD治疗药物,不良反应相对较小,对于病情较重且排除禁忌证(18岁以下或中、重度肝功能损害)的患者可以考虑常规加用。
2.2.2 茶碱 茶碱是一类甲基黄嘌呤类衍生物,为非选择性PDE4抑制剂,在COPD稳定期具有较小的支气管扩张作用。黄嘌呤衍生物的毒性(包括致命性心律失常、大抽搐等)与剂量有关,治疗指数低,只有在给予接近毒性剂量时才会产生大部分疗效[24]。目前在一些基层医院茶碱仍然是COPD治疗的一线药物,但GOLD指南推荐:除非其他长期治疗的支气管扩张剂不可用或负担不起,否则不建议使用。茶碱具有一定扩张肺动脉的作用,对于合并肺心病、肺动脉高压的患者可以考虑小剂量、短程使用,使用过程中需严密观察疗效和不良反应,动态增减药量或及时停药。
2.2.3 抗生素 研究表明,长期应用阿奇霉素和红霉素可减少1年以上的急性加重[3]。GOLD指南推荐,优先但不仅限于经过适当治疗仍有急性加重的有吸烟史的患者,可以考虑使用大环内酯类药物,尤其是阿奇霉素。NICE指南也认为阿奇霉素的有效性证据最多,可以减少部分COPD患者急性加重的频率[25]。但长期使用阿奇霉素可能会增加细菌耐药性,因此除非确有必要,否则不建议长期使用。在病情加重期间,可以通过观察痰液颜色和参考C反应蛋白和降钙素原水平来限制抗生素的使用[26]。
2.2.4 疫苗 研究表明,接种流感疫苗可以降低COPD患者严重肺部感染发生率和死亡率[3]。23价肺炎球菌多糖疫苗(PPSV23)已被证明可以降低存在并发症且FEV1预计值<40%的<65岁COPD患者的社区获得性肺炎发生率[27];13价结合型肺炎球菌疫苗(PCV13)可降低>65岁人群菌血症和严重侵袭性肺炎球菌肺炎的风险[28]。GOLD指南推荐,所有>65岁的患者接种肺炎球菌疫苗即PCV13和PPSV23;PPSV23也推荐给患有严重并存疾病(慢性心脏病或肺病)的年轻患者[29-30]。本课题组认为,在加强营养和体育锻炼增强免疫力的基础上,仍有频繁加重和/或多次住院的年老体弱合并多种基础疾病的患者,可以考虑接种疫苗[31]。
2.2.5 黏液溶解剂和镇咳剂 研究表明,在没有接受吸入性皮质类固醇治疗的COPD患者中,定期使用黏液溶解剂可以减少病情恶化并适度改善健康状况[32]。GOLD指南推荐,定期使用黏液溶解剂(厄多司坦,羧甲半胱氨酸和N-乙酰半胱氨酸)可以降低某些人群急性加重的风险。本课题组认为,对于急性加重痰多的患者可以常规应用黏液溶解剂以利于迅速控制感染和改善呼吸困难症状,但稳定期无痰不建议长期服用。没有确凿的证据表明镇咳药在COPD患者中具有有益作用,GOLD指南不推荐使用镇咳药。镇咳药可能会影响痰液的引流,急性加重痰多时不宜应用,但稳定期长期严重干咳影响生活时可考虑少量应用。
2.2.6 其他 GOLD指南不推荐使用他汀类药物预防急性加重,不推荐将批准用于原发性肺动脉高压的药物用于COPD继发性肺动脉高压,而对于COPD重症患者的呼吸困难(mMRC 3~4级)可以尝试给予低剂量口服和静脉注射长效阿片类药物。GOLD指南推荐,对患有严重α-1抗胰蛋白酶缺乏症(AATD)的肺气肿患者可以考虑α-1抗胰蛋白酶替代疗法。本课题组认为,对于严重肺气肿尤其具有AATD家族史的患者,可以进行相关筛查,确诊患者可以转诊至专家中心会诊后再决定是否实施α-1抗胰蛋白酶替代疗法。其他药物如肿瘤坏死因子拮抗剂、基质金属蛋白酶抑制剂、抗血小板制剂等尚处于研究发展阶段,而有关β-受体阻滞剂预防COPD急性加重的临床试验并未显示出良好的结局且有加重病情的风险等[33-35]。
3 结语
GOLD指南不再提哮喘-COPD重叠综合征(ACO),相反强调哮喘和COPD是不同的疾病。但哮喘和COPD可能在单个患者中共存,此时药物治疗应该主要遵循哮喘指南,同时兼顾COPD的治疗方法。任何一种药物治疗方案均不是一成不变的,需要动态观察患者对治疗方案的反应(包括疗效和不良反应),在排除其他原因(非COPD)引起的呼吸困难、审查患者吸入器技术和依从性后,再对药物进行个体化增减和/或对剂量进行调整。药物治疗可用于减轻症状,降低加重的频率和严重程度,改善运动耐量和健康状况。但到目前为止,没有确凿的临床试验证据表明任何现有的COPD药物可以改变肺功能的长期下降[36]。所以,除了药物治疗外,尚需要更多的综合疗法如肺康复、手术等延缓和/或改善肺功能(稳定期非药物管理将在解读(二)中论述)。
本文着重基于GOLD指南(同时参考其他循证证据),针对目前国内在COPD药物管理方面存在的问题,立足于临床实践对COPD药物管理进行系统总结、论述和分析,内容包括诊断评估、初期管理和后续管理,以期能够有助于提高临床诊疗的全面性和准确性。在COPD稳定期管理方面,本课题组认为最重要的是一级和二级预防,控制和减少急性加重是临床管理的目的和落脚点,也是未来研究的重点和方向。
作者贡献:李正欢进行研究设计、撰写修改论文并对文章负责;李正欢、宋雪利、秦中明、李红进行研究实施、评估、资料收集;陈杨进行参考文献筛选和研究证据质量评估;张晓云进行整体质量控制及审校。
本文无利益冲突。

