鸭坦布苏病毒山东流行株的分离鉴定及其基因组序列分析
(山东农业大学动物科技学院,山东省动物生物工程与疾病防治重点实验室,山东省畜禽疫病防制工程技术研究中心,山东泰安 271000)
鸭 坦 布 苏 病 毒(duck Tembusu virus,DTMUV)属于黄病毒科黄病毒属恩塔亚病毒群,同属病毒多为人兽共患病病毒,如登革病毒(dengue virus,DENV)、日本乙型脑炎病毒(Japanese encephalitis virus,JEV)和西尼罗病毒(West Nile virus,WNV)等。研究[1]显示:DTMUV 基因组为单股正链RNA,大小约11 kb,编码3 种结构蛋白和7 种非结构蛋白,分别为衣壳蛋白C、膜蛋白M、囊膜蛋白E,以及非结构蛋白NS1、NS2A、NS2B、NS3、NS4A、NS4B 和NS5,各蛋白在病毒入侵、复制和包装释放等过程中发挥重要作用。此外,糖基化位点在蛋白质结构和功能中起着重要作用。E 蛋白在第154~157 位(NYSA)和314~317 位(NPTD)有糖基化位点,NS1 蛋白在第130~133 位(NNTF) 和175~178 位(NTTD)存在糖基化位点;C 蛋白参与核衣壳的组装和新病毒粒子的结合。研究[2]表明,糖基化位点的变异可以改变病毒毒力或抗原性。
各品种鸭对DTMUV 均易感,其中麻鸭最易感。蛋鸭感染后会出现严重产蛋下降,而肉鸭则以生长迟缓和神经症状为主要特征。剖检病变可见,卵巢出血、萎缩,卵泡破裂,脾脏肿大,脑膜水肿、充血和出血;组织病理学可见典型的病毒性脑炎病变。该病自2010 年首先在我国浙江、福建等地暴发以来,流行范围不断扩大,我国主要养鸭地区都有该病流行的报道,给养鸭业造成了巨大经济损失[3]。
山东省鸭养殖量较大,商品肉鸭年出栏量约占全国总量的1/3,蛋鸭存栏量约占全国总量的1/10,在我国养鸭业中占据重要地位[4]。为了解山东省DTMUV 流行及变异情况,对2018 年下半年至2019 年上半年来自全省不同地区的102 份送检病料进行DTMUV 病原学检测,结果检出8 份阳性样品,阳性检出率为7.8%,进而选取其中3 株病毒进行全基因组扩增和序列分析。
1 材料与方法
1.1 细胞及主要试剂
鸡胚成纤维细胞(DF-1),由本实验室保存;DMEM 高糖培养基、胎牛血清(FBS)、胰酶,购自Gibco 公司;TRIzol RNA 抽提试剂、PrimeSTAR® Max DNA 聚合酶、DNA Marker、pMD18-T 载体、大肠杆菌DH-5α 感受态细胞,均购自宝生物工程(大连)有限公司;反转录试剂盒,购自南京诺唯赞生物科技有限公司;胶回收试剂盒,购自北京康为世纪公司。其余所使用试剂均为分析纯试剂。
1.2 样品采集及处理
2018 年7 月—2019 年8 月,对来自泰安、济宁和淄博等11 个地区的送检病鸭,采集肝、脾和脑等组织,加入含10×青链霉素的无菌PBS(1 mL/g)研磨;对研磨液12 000 r/min、4 ℃离心10 min,取上清经0.22 μm 滤器过滤后分装,置于-80 ℃超低温冰箱保存备用。样品主要来自表现下列症状的产蛋鸭与雏鸭:产蛋鸭产蛋量下降,剖检可见脾脏肿大、出血;雏鸭瘫痪、头部震颤、腹泻,排褐色粪便,剖检可见脑膜出血,脾脏肿大且呈斑驳状。
1.3 病毒分离
将生长状态良好的DF-1 细胞铺于6 孔板,待细胞长到80 %左右时用于病毒分离。接毒前,用无菌PBS 清洗2 次,每孔加入500 μL 病毒滤液,轻轻晃动、混匀,放入5% CO2、37 ℃培养箱中感作2 h,每隔15 min 摇动1 次。接毒结束后,弃去病毒液,每孔加入2 mL 含1% FBS 的DMEM 细胞维持液。培养3~5 d,其间每天观察是否有细胞病变(CPE)产生。若接种后第5 天仍无CPE 出现,收集细胞和上清,反复冻融3 次再接种细胞,如此盲传3 代仍无CPE 出现则弃去。若细胞出现CPE,收集细胞和上清,分装保存于-80 ℃。
1.4 引物设计及合成
根据GenBank 已经登录的DTMUV 序列的保守区设计检测引物(DTMUV-F:CTGAAATAGCGGAAGCACTGA;DTMUV-R:CTGGAGGTGGCTGTCAT),目的片段为273 bp。同时,设计9 对两两相互重叠的PCR 引物,用于扩增DTMUV 全基因组序列(表1)。引物均由北京六合华大基因科技有限公司合成。
1.5 PCR 检测及全基因组扩增
使用TRIzol 方法提取病毒RNA。将沉淀用25 μL 无RNA 酶的水溶解,按照反转录试剂盒说明书操作合成cDNA,-20 ℃保存备用。以DTMUV-F、DTMUV-R 为引物进行病毒检测,同时将部分阳性样品通过上述9 对引物,对病毒全基因组进行扩增。反应条件为:95 ℃ 5 min;95 ℃30 s、55 ℃ 30 s、72 ℃ 90 s,32 个循环;72 ℃10 min。对PCR 产物经1%琼脂糖凝胶电泳检测并回收纯化,将目的片段连接到pMD-18T载体,转化,挑选阳性克隆送样测序。
1.6 分离株遗传进化及氨基酸位点变异分析
测序结果利用SeqMan、Editseq 等软件进行序列拼接分析。从GeneBank 中选取不同年份的24 株TMUV 序列(GenBank 登录号分别为:FX2010,MH414568.1;GD06,KX977550.1;YY5,JF270480.1;SDHS,KF826757.1;CKSD-11,JQ627862.1;FQ-C1,KX977555.1;SDLC,KJ740747.1;BYD,JF312912.1;PY-2014,KX686573.1;XHZD2010,JQ595407.1,pigeon strain,JQ920425.1;JS804,JF895923.2;AH-F10,KM102539.1;JS2010,JX273153.1;SH001,KP742476.1;AH201501,KY623431.1;JS201501,KY623428.1;CQW1,KM233707.1;GX2013E,KM275940.1;HD-2015,KX686572.1;HD1-2013,KX686577.1;HZ-2014,KX686580.1;MM1775,MH414569.1;Sitiawan,JX477686.1),使用病毒ORF 核苷酸,通过Mega 4.0 软件,运用邻近法构建系统发育树。以FX2010 为参考毒株,分析本研究获得的3 个DTMUV分离株C、E和NS1蛋白氨基酸的变异情况。

表1 DTMUV 全基因组扩增引物
1.7 分离毒株蛋白结构分析及糖基化位点预测
通 过Phyre 2(http://www.sbg.bio.ic.ac.uk/~phyre2/html/page.cgiid=index)和PyMOL 软件,使用JEV 的E 蛋白结构模型(PDB ID:5WSN)分析DTMUV 分离毒株E 蛋白三级结构。利用在线分析软件NetNGlyc 1.0 Sever(http://www.cbs.dtu.dk/services/NetNGlyc/),对分离毒株的E 和NS1 蛋白进行糖基化位点预测分析。
2 结果与分析
2.1 病毒分离鉴定
临床样品研磨液接种DF-1 细胞后60 h,部分样品组细胞出现皱缩、变圆、脱落等典型CPE(图1)。使用DTMUV 检测引物,对上述细胞样品进行PCR 扩增,可获得275 bp 的特异性条带(图2)。测序、BLAST 分析显示,目的条带与DTMUV 特征相符。本实验室从2018 年下半年以来送检的102 份病料中,共检测到8 个DTMUV 阳性,阳性检出率为7.8%。
2.2 分离株全基因组分段扩增及遗传进化分析
从8 个阳性病料中分离到3 株DTMUV(482、SDTA487 和SDZB567),使用全长引物扩增分离株的全基因组序列,结果如图3 所示,获得了1 000~1 700 bp 的9 条目的片段。

图1 临床样品研磨液接种细胞后引起的CPE

图2 DTMUV 分离株的PCR 检测结果

图3 DTMUV 分离株全基因组分段扩增结果
将分离株482、SDTA487 和SDZB567 的目的片段测序、分析后,获得3 株DTMUV 的全基因组序列,其全长均为10 993 bp,仅包括1 个10 278 bp 的ORF,编码3 425 个氨基酸。从NCBI 上选取不同年份的24 株TMUV,将其与本研究获得的482、SDTA487 和SDZB567 毒株进行序列分析,结果发现3 个分离株彼此之间的氨基酸同源性为99.2%~99.3%,与24 株参考毒株的同源性为95.8%~99.9%。具体各蛋白的同源性分别为:C 蛋白,86.1%~99.2%;M 蛋白,91.6%~100%;E 蛋白,95.0%~99.4%。非结构蛋白NS1,92.3%~99.7%;NS2A,90.7%~99.1%;NS2B,95.4%~99.2%;NS3,97.9%~100%;NS4A,94.6%~99.3%;NS4B,97.2%~100%;NS5,97.8%~99.9%。详细结果见表2。以ORF 核苷酸进行系统发育树分析,发现482、SDTA487 和SDZB567 毒株与近年来分离的TMUV 毒株(AH201501,JS201501 等)亲缘关系更近,属于中国株I 型(图4)。
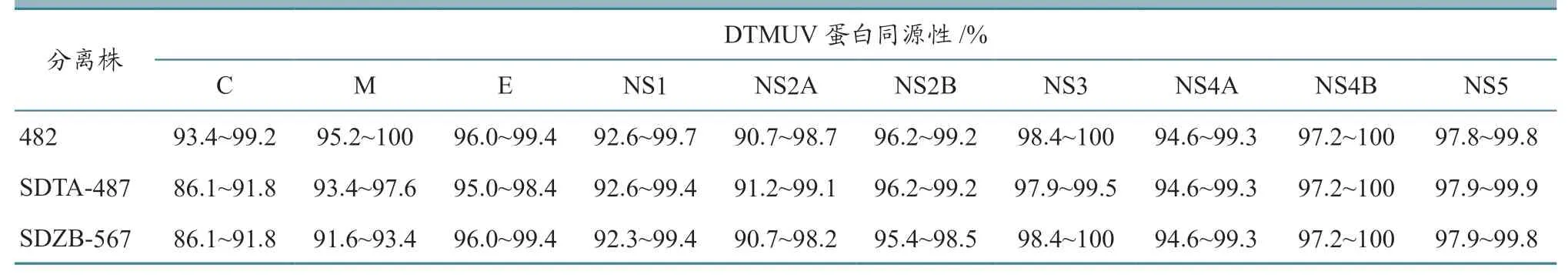
表2 3 株DTMUV 各蛋白与参考毒株的同源性分析结果

图4 DTMUV 分离株全基因组系统进化树
2.3 分离株C、E 和NS1 蛋白氨基酸位点变异分析
FX2010 是2010 年在上海市奉贤区分离到的DTMUV 毒株。以它为参考毒株,分析本研究获得的3 株病毒的C、E 和NS1 蛋白氨基酸位点变异情况。结果如表3 所示:482 的C 蛋白与FX2010相比,仅在第111 和117 位有2 个氨基酸突变,但SDTA487 和SDZB567 各有11 个相同的氨基酸突变位点,分别是第12、40、59、65、77、80、81、104、111、114 和117 位;482 和SDZB567 的E 蛋白各有6 个相同的氨基酸位点突变,分别是第38、122、124、277、487 和493 位,但SDTA487在此基础上还包括第151、153、159、161 和431位,共有11 个氨基酸突变位点;482 和SDTA487的NS1 蛋白各有6 个突变位点,分别是第112、141、191、318、338 和339 位,而SDZB567 还包括第206 位。

表3 DTMUV 分离毒株C、E 和NS1 蛋白氨基酸位点变异分析结果
2.4 E 蛋白结构分析及其与NS1 蛋白糖基化位点预测
通过Phyre2 和 PyMOL,对分离株SDTA487与FX2010 E 蛋白的三级结构进行比较分析,发现虽然SDTA487 的E 蛋白有11 个氨基酸位点突变,但其关键的第156 位氨基酸空间构象未受影响,与FX2010 保持一致(图5)。
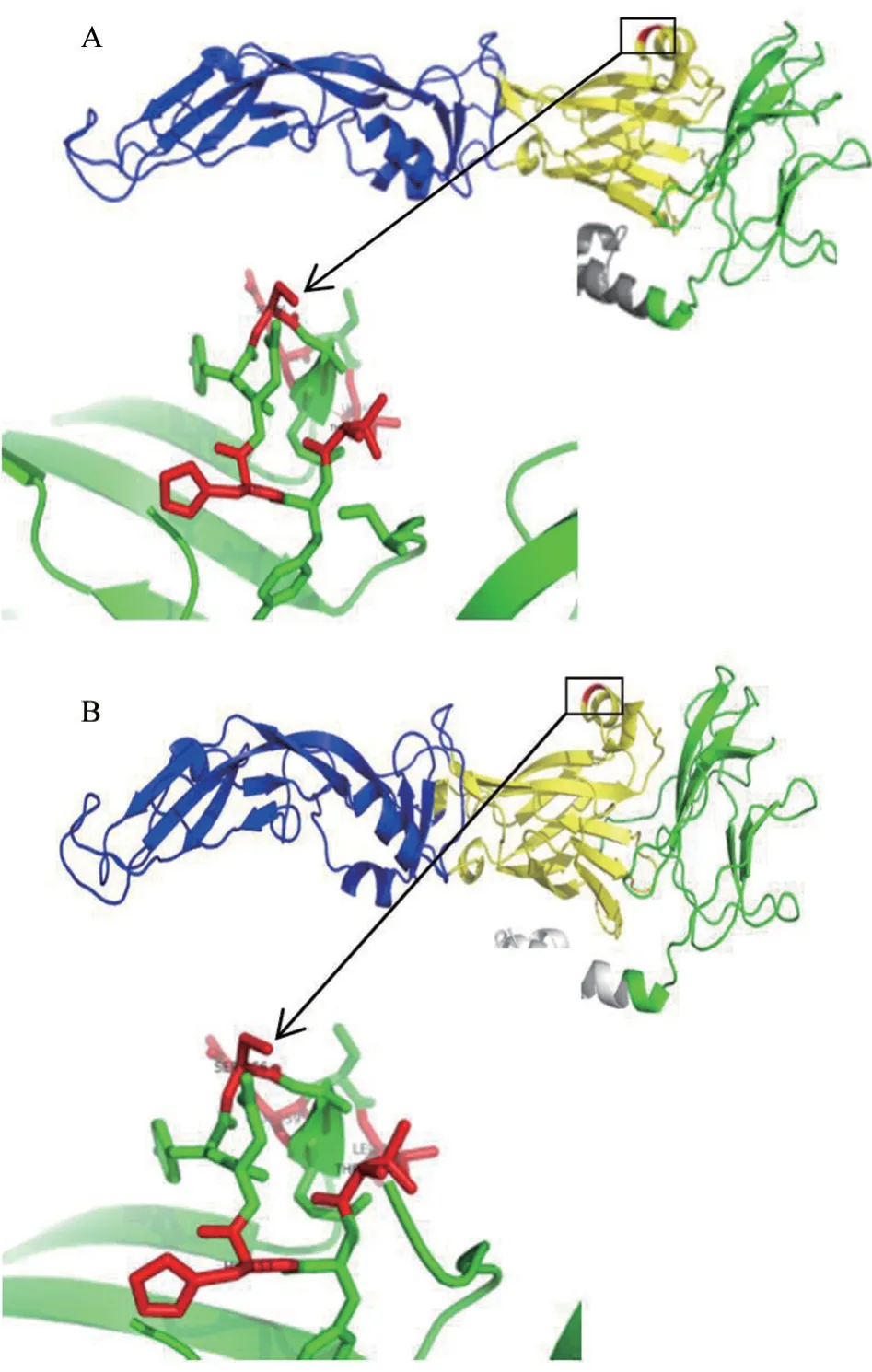
图5 E 蛋白结构分析结果
进一步预测3 个分离株E 和NS1 蛋白的潜在糖基化位点发现(表4),3 株DTMUV 与FX2010的E 和NS1 蛋白糖基化位点无差异,E 蛋白仅在第154~157 位(NYSA)和314~317 位(NPTD),NS1 蛋白在第130~133 位(NNTF)和175~178 位(NTTD)有糖基化位点。不过,SDZB567 的NS1 蛋白第207~210位(NGSW)的预测值为0.495 0(FX2010为0.453 0),接近阈值0.5。
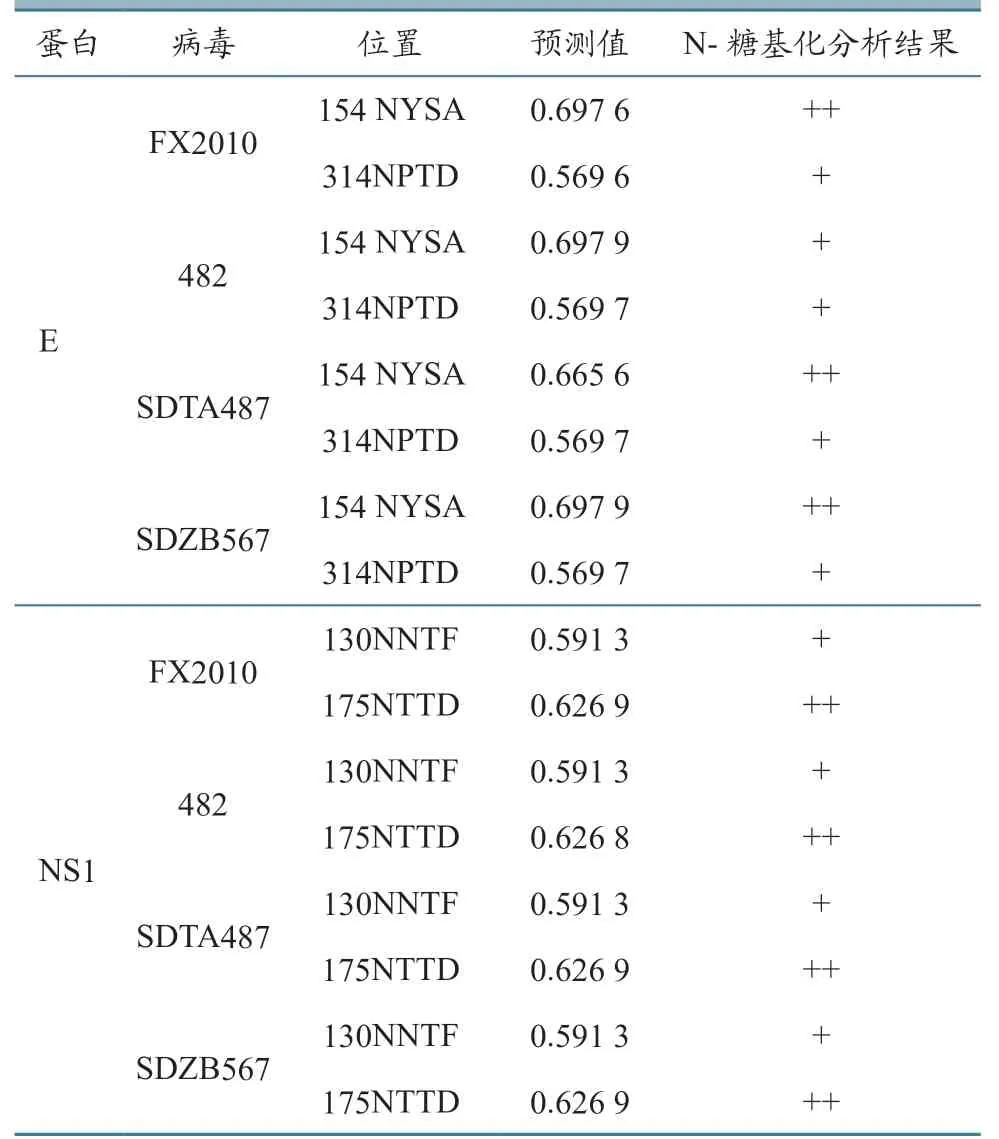
表4 E 和NS1 蛋白的N-糖基化位点分析结果
3 讨论
该病在暴发以来的9 年时间内流行并不稳定。报道[5-6]显示,2011 年该病仅在个别地区零散发生,而2012 年则出现较大范围流行。2015 年关于该病的报道较少。本实验室于2016—2017 年在山东省部分地区采集了270 份临床样品进行DTMUV病原学检测,结果共检出36 份阳性样品,阳性检出率为13.3%[7]。本研究检测了2018 年下半年至2019 年上半年来自山东省11 个地区的102 份送检病料,共检出8 份DTMUV 阳性,阳性检出率为7.8%。相较于之前的报道[2],该病流行率略有下降,其主要原因可能归结于现在绝大多数养殖场都进行该病的常态化免疫,有效降低了该病的发生。
早在1955 年,在马来西亚的库蚊中分离到第1株TMUV,随后关于该病毒的报道较少。2000 年在马来西亚Sitiawan 地区的某养鸡场内发现TMUV,但并未造成大规模流行[8],直到2010 年我国养鸭场开始暴发DTMUV 流行。目前TMUV 除可以感染鸭之外,还能感染鸡、鹅、麻雀、蚊和小鼠[9-12]。据报道[5,13]显示,TMUV 毒株目前分为中国流行株I、II,马来西亚流行株I、II 和泰国株。本研究选取分离株482、SDTA487 和SDZB567 进行了全基因组序列扩增,发现其全长均为10 993 bp;以ORF核苷酸进行遗传进化分析,发现其均属于中国株I型,与近年来的流行毒株相一致。
病毒关键氨基酸位点的变异能显著影响其传播能力和致病特性。本研究获得的3 个分离株与24 个参考毒株的氨基酸同源性为95.8%~99.9%,各蛋白的氨基酸同源性也不完全相同。TMUV 衣壳蛋白C 作为结构蛋白参与病毒复制、组装,并调控病毒毒力[14]。近期研究[15]发现,JEV 的C蛋白第66 位氨基酸位点的突变可显著降低病毒的神经侵袭力。本研究分离的3 个毒株C 蛋白与参考毒株的同源性较低,为86.1%~99.2%,尤其是SDTA487 和SDZB567,仅为86.1%~91.8%,二者与FX2010 共有11 个氨基酸位点差异,如P59A、G65V 和D77E 等,其对病毒致病性的影响还需要动物感染试验进行验证。E 蛋白是TMUV 的主要抗原蛋白,在病毒入侵和释放过程中发挥重要作用。E 蛋白包括I、II 和III 3 个结构域。据报道[2],E蛋白结构域I 中的氨基酸对DTMUV 的致病性有关键影响,当第156 位丝氨酸变为脯氨酸时,能够影响第154 位氨基酸的糖基化,进而改变E 蛋白结构构象,使病毒的组织嗜性和传播能力显著减弱。本研究中3 个分离株与参考株的E 蛋白同源性介于95.0%~99.4%,482 和SDZB567 的E 蛋白各有6 个氨基酸突变位点,而SDTA487 有11 个位点突变。考虑到E 蛋白第156 位氨基酸的关键作用,本研究对SDTA487 和参考毒株FX2010 的E 蛋白三级结构进行了模拟,结果发现虽然SDTA487 第151、153、159、161 位氨基酸发生突变,但是并没有影响第156 位丝氨酸的空间结构;糖基化位点预测也证实,这3 个分离毒株的E 蛋白并没有发生变化。所以认为,目前山东省流行的DTMUV毒株致病性未发生明显变异。除病毒自身变异会对其致病性产生影响外,宿主免疫反应在病毒致病过程中也发挥重要作用。近期研究[16]证实,TMUV的NS1 蛋白能与线粒体抗病毒蛋白(MAVS)相互作用,拮抗宿主I 型干扰素产生。本研究中的分离株NS1 蛋白变异程度相对较高,为92.3~99.4%,有6~7 个氨基酸突变位点,其能否影响病毒与宿主免疫反应的相互作用还有待进一步研究。但是整体上,相比较于近两年DTMUV 分离毒株C、E 和NS1 蛋白的氨基酸突变数量[7,17],本研究中的3个分离毒株突变数量增多,随着该病毒宿主范围的不断扩大以及疫苗的免疫选择压力,这一现象更值得关注和深入研究,以防止毒力增强变异株的出现。
4 结论
研究发现,山东省鸭群中存在DTMUV 流行,且分离毒株间的氨基酸同源性较高,均属于中国株I 型。虽然个别分离株的氨基酸位点变异较多,但关键氨基酸位点无突变,蛋白结构和糖基化位点也与经典毒株相一致,表明目前山东省DTMUV 流行株致病特性尚未发生明显变化,但应持续关注和深入研究。

