温胆汤通过调节胆固醇逆转运相关膜蛋白表达抑制ApoE−/−小鼠动脉粥样硬化斑块形成*
陈玄晶,吴炳鑫,吴焕林,徐丹苹
(1广州中医药大学第二临床医学院,2广东省中医院,广东广州 510020;3北京中医药大学,北京 100700)
动脉粥样硬化(atherosclerosis,AS)是众多心血管疾病的病理基础和关键环节,其引发的重要脏器缺血性功能障碍已成为全球人类死亡的首要原因。WHO 最新统计数据显示,每年全球约1 790 万人死于AS 所致的心脑血管疾病,约占全球死亡的31%,并且发病率仍持续增长。目前他汀类等降脂药物为临床治疗AS 的一线药物,但研究发现长期口服此类药物容易引起横纹肌溶解、肾衰等不良反应,以及部分他汀不耐受患者无法超越6%原则[1-2],因此寻找更加有效低毒的抗AS 药物具有重大意义。中药在这方面显示出明显优势,其组合协同作用和较低副作用的特点使其成为抗AS替代疗法研究的热点。
胆固醇逆转运(reverse cholesterol transport)是指外周组织过量胆固醇经由高密度脂蛋白(high-densi⁃ty lipoprotein,HDL)介导,通过血液循环转运至肝脏,最终排出体外的过程[3]。胆固醇逆转运是体内维持胆固醇代谢的经典途径,可有效防止胆固醇在肝外组织累积,促进动脉血管壁胆固醇酯和游离胆固醇的清除,在AS的防治中发挥重要作用[4]。
中医证候调研显示,痰证在现代炎症性疾病中占比高[5-6],同时血脂代谢异常已明确为中医痰证的物质基础之一[7-9]。温胆汤(Wendan decoction)是中医化痰的经典代表方,其始载于《千金要方》,被后世医家广泛应用于临床实践。近年相关研究显示,加减温胆汤干预有效抑制AS性病变的进展[10-11]。本团队前期对温胆汤及其类方的系列研究表明,温胆汤能够调节异常血脂代谢,改善AS 性心脏病患者临床症状及预后[12-14]。本研究基于高脂饲料喂养的载脂蛋白E 基因敲除(apolipoprotein E gene knockout,ApoE−/−)小鼠AS疾病模型,从胆固醇逆转运角度探讨温胆汤抗AS 的作用机制,以期为温胆汤的临床应用提供更加全面的科学依据,并为进一步开发靶点明确的抗AS中药新制剂奠定基础。
材料和方法
1 动物
SPF 级8 周龄ApoE−/−雄性小鼠75 只,SPF 级8 周龄C57BL/6 雄性小鼠15 只,体重(25±2)g。小鼠购自北京华阜康生物科技股份有限公司,饲养于广东省中医院动物实验中心SPF 级动物房,饲养环境温度为(22±2)℃,湿度为50%~60%,所有小鼠均可自由进食和饮水。人工控制室内照明,保持12 h 光照和黑暗交替循环。实验动物许可证号为SYXK(粤)2018-0094。本研究经广东省中医院实验动物伦理委员会审查批准。
普通饲料由广东省中医院动物实验中心提供。高脂饲料(含15%猪油、2%胆固醇和0.05%胆酸)购于广东省医学实验动物中心。
2 主要试剂和仪器
法半夏、竹茹、枳实、茯苓、橘皮、炙甘草和生姜购自广东省中医院;辛伐他汀购自广州南新生物制药有限公司;水合氯醛、油红O 粉末和脱脂奶粉购自Sigma-Aldrich;苏木素染液和伊红染液购自碧云天生物技术有限公司;BCA 蛋白浓度试剂盒、5×SDS蛋白电泳上样缓冲液和HaltTMProtease Inhibitor Single-Use Cocktail 购自Thermo Fisher Scientific;PhosStop购自Roche;抗ATP 结合盒转运体A1(ATP-binding cassette transporter A1,ABCA1)抗体、抗小窝蛋白1(caveolin-1)抗体、抗B 类I 型清道夫受体(scavenger receptor class B type I,SR-BI)抗体和抗分化簇36(cluster of differentiation 36,CD36)抗体购自Ab⁃cam;GAPDH rabbit mAb、anti-rabbit IgG/HRP-linked antibody、anti-rat IgG/HRP-linked antibody 和antimouse IgG/HRP-linked antibody 购自Cell Signaling Technology;Immobilon ECL Ultra Western HRP Sub⁃strate购自Millipore。
7180全自动生化测试仪(Hitachi);高速低温离心机(Eppendorf);Multiskan FC 自动酶标仪和组织包埋机(Thermo Fisher Scientific);BT125D 电子天平(Sar⁃torius);石蜡切片机和H1220 型烤片机(Lecia);垂直电泳仪、蛋白转膜系统和ChemiDoc XRS 凝胶成像系统(Bio-Rad);MB-102 振荡恒温金属浴(杭州博日科技有限公司);MS 3 digital涡旋混合器(IKA)。
3 方法
3.1 药物配制 根据唐代孙思邈《千金要方》中所载温胆汤,按原经方比例配伍。每克生药加入6 mL超纯水,浸泡30 min,加热煮沸后文火继续煎煮30 min,过滤至滤液自然滴尽,收集药液;每克药渣加入4 mL 超纯水,再次煎煮,方法同前,合并两次收集的滤液;使用旋转蒸发仪,将滤液浓缩成浸膏;预冷冷冻干燥机,放入浸膏,制成冻干粉。按人和动物间体表面积折算系数换算,以温胆汤临床给药剂量的0.5、1 和2 倍换算,分别设为低、中、高剂量温胆汤组。按小鼠灌胃剂量10 mL/kg,使用3%羧甲基纤维素钠溶液配制低、中、高剂量温胆汤药剂。
以人最大临床辛伐他汀用量40 mg,按人和动物间体表面积折算系数换算,小鼠的给药剂量为5 mg/kg。将辛伐他汀分散片碾碎,制成粉末状。按小鼠灌胃剂量10 mL/kg,使用3%羧甲基纤维素钠溶液配制辛伐他汀药剂。
3.2 分组及给药 将ApoE−/−小鼠随机分为模型(model)组、辛伐他汀组、低剂量温胆汤(low-dose Wendan decoction)组、中剂量温胆汤(middle-dose Wendan decoction)组和高剂量温胆汤(high-dose Wendan decoction)组,每组15 只。15 只相同遗传背景的C56BL/6 小鼠为对照组。常规饮食适应性喂养1 周后,所有小鼠首次称重,此后每周连续称重并记录,共10 周。适应性喂养1 周后ApoE−/−小鼠给予高脂饲料喂养,对照组小鼠给予普通饲料喂养。各干预组每日给予相应药物灌胃,模型组和对照组每日给予等量生理盐水灌胃。给药持续10周。
3.3 观察指标和方法 末次给药后,小鼠禁食12 h。按照10 mL/kg,使用10%水合氯醛腹腔注射麻醉;眼眶静脉丛采集血液标本;取血后将小鼠腹部朝上,四肢固定于取材板,沿腹部中线纵向剖开,充分暴露腹腔和胸腔;沿左心室心尖部插入针头,注入预冷的生理盐水,灌注至流出的液体清亮;体视显微镜下分离主动脉,剥离血管外模周脂肪组织,取下小鼠主动脉(主动脉弓至双髂动脉分支,保留部分弓部分支,包括头臂干、左颈总动脉和左锁骨下动脉);剪下连有心脏的部分胸段主动脉;收集小鼠肝脏。
3.4 血脂水平的测定 血液标本收集于离心管中,静置4 h;预冷离心机,4℃、1 500 r/min 离心15 min。收集血清,标记信息;每组分别随机选取6 只小鼠血清,采用全自动生化分析仪检测小鼠血清甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)和低密度脂蛋白胆固醇(low-density lipoprotein choles⁃terol,LDL-C)和HDL-C水平。
3.5 油红O染色检测主动脉整体斑块形成的情况各组分别随机选取5 只小鼠整体主动脉,生理盐水浸洗,放入4%多聚甲醛,4℃固定24 h;体视显微镜下纵向剖开,PBS 浸洗10 min;置于60%异丙醇中10 min;加入油红O 工作液,室温染色2 h;60%异丙醇分化,镜下观察至无背景色为止,拍照留存。使用Image-Pro Plus 6.0 软件分析图像,计算斑块占比。斑块占比(%)=斑块面积/主动脉内壁面积×100%。
3.6 HE 染色检测主动脉根部斑块形成的情况 各组分别随机选取5 只小鼠胸段主动脉,生理盐水浸洗,放入4%多聚甲醛,4℃固定24 h;清水冲洗1 h,采用梯度乙醇脱水;放入二甲苯中浸没1 h;将组织放入60℃石蜡溶液中;石蜡包埋组织,冷却凝固,室温储存备用;使用石蜡切片机切取厚度为5 μm的组织切片,60℃烤片1 h,室温保存;将切片放入二甲苯中脱蜡30 min,经无水乙醇、梯度乙醇各5 min,脱水完成后,超纯水浸润切片5 min×3 次;滴加苏木素染色10 min,0.5%盐酸酒精分化1 s,镜下观察细胞核呈蓝紫色,其余组织无色,流水冲洗切片20 min 返蓝;将切片放入伊红溶液染色2 min,流水冲洗多余伊红溶液,镜下观察切片颜色,细胞核呈蓝色,细胞浆呈红色或粉红色;无水乙醇脱水1 min×2次,自然风干后中性树胶封片,显微镜观察切片并拍照留存。使用Image-Pro Plus 6.0 软件分析图像,计算斑块占比。斑块占比(%)=斑块面积/主动脉内壁横截面积×100%。
3.7 Western blot检测主动脉ABCA1和caveolin-1及肝脏SR-BI 和CD36 蛋白的表达 各组随机选取6 只小鼠的主动脉进行ABCA1蛋白表达量检测,选取7只小鼠的主动脉进行caveolin-1蛋白表达量检测,选取7只小鼠的肝脏进行SR-BI 和CD36 蛋白表达量检测。取各组主动脉和适量肝脏组织,称重记录,根据组织重量加入适量裂解液,加入磁珠匀浆,冰上放置30 min;4℃、12 000 r/min离心30 min,收集上清液;取适量上清液用于BCA法蛋白浓度检测,根据各组蛋白总体积,调整各组蛋白浓度一致;恒温金属浴100℃煮10 min,于−80℃冻存备用;每组取30~50 μg 蛋白,于10%SDS-PAGE分离蛋白;转膜后,5%脱脂奶粉封闭2 h,加入一定稀释比例的Ⅰ抗,4℃孵育过夜;TBST洗膜3 次,加入对应Ⅱ抗溶液,室温孵育2 h;ECL 化学发光试剂显影曝光。以GADPH 蛋白为内参照,使用Image Lab 5.1.0软件进行蛋白条带灰度分析。
4 统计学处理
运用SPSS 19.0 软件进行统计分析。服从正态分布的计量资料以均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析,组间多重比较采用Bonferroni校正t检验或Tamhane´s T2检验。以P<0.05为差异有统计学意义。
结 果
1 温胆汤对ApoE-/-小鼠体重的影响
如图1A 所示,首次称重各组小鼠体重基线水平的差异无统计学显著性(P>0.05)。此后,模型组与对照组、各给药组之间体重差距逐渐拉大(图2)。至第10 周,末次称重结果显示,与对照组相比,模型组小鼠体重显著增加(P<0.01),而辛伐他汀组和各剂量温胆汤组小鼠体重与对照组相比差异无统计学显著性(P>0.05);辛伐他汀及中剂量温胆汤干预显著降低高脂饲料喂养ApoE−/−小鼠体重,与模型组相比差异有统计学意义(P<0.05),而低、高剂量温胆汤组ApoE−/−小鼠平均体重与模型组比较稍有降低,但差异无统计学显著性(P>0.05);辛伐他组与各剂量温胆汤组小鼠体重比较差异无统计学显著性(P>0.05);各剂量温胆汤组间比较,小鼠体重的差异无统计学显著性(P>0.05),见图1B。

Figure 1.The initial weight and last weight of the mice.A:the initial weight of the mice after 1 week adaptation with general meals;B:the last weight of the mice before preoperative fasting.Mean±SD. n=15.**P<0.01 vs control group;#P<0.05 vs model group.图1 小鼠初始体重和末次体重变化的比较
2 温胆汤对ApoE-/-小鼠血清脂质水平的影响
如表1 所示,与对照组相比,模型组小鼠血清TG、TC 和LDL-C 水平均显著增高,HDL-C 水平显著降低(P<0.01);辛伐他组和各剂量温胆汤组小鼠血清TC、LDL-C 和HDL-C 水平与对照组比较差异有统计学意义(P<0.05 或P<0.01),而TG 水平与对照组相比差异无统计学显著性(P>0.05)。与模型组比较,辛伐他汀和各剂量温胆汤均能够显著降低小鼠血清TG、TC和LDL-C水平(P<0.05或P<0.01),而辛伐他组和各剂量温胆汤组血清HDL-C水平与模型组比较差异无统计学显著性(P>0.05)。辛伐他组与各剂量温胆汤组比较,中、高剂量温胆汤降低TG 和TC水平的作用略优于辛伐他汀,辛伐他汀降低LDL-C水平的作用略优于各剂量温胆汤,但差异无统计学显著性(P>0.05)。各剂量温胆汤组间差异无统计学显著性(P>0.05),未表现出明显的剂量依赖性。
3 温胆汤对ApoE-/-小鼠主动脉整体斑块形成的影响
如图3所示,对照组C57BL/6小鼠主动脉内壁光滑,无明显红色着色斑块;模型组小鼠主动脉内壁有明显分散的红色斑块;辛伐他汀组和各剂量温胆汤组小鼠主动脉内壁红色斑块面积较模型组减少。定量分析结果显示,模型组小鼠主动脉整体平均斑块占比达(29.90±4.48)%,辛伐他汀组平均斑块占比(14.66±2.30)%,与模型组比较显著降低(P<0.01);低、中、高剂量温胆汤组小鼠主动脉平均斑块占比分别 为(19.56±5.89)%、(14.86±4.47)%和(17.80±6.41)%,与模型组比较显著降低(P<0.05 或P<0.01);各剂量温胆汤组主动脉整体占比与辛伐他汀组比较差异无统计学显著性(P>0.05);各剂量温胆汤组间比较显示,中剂量温胆汤组主动脉整体斑块占比最低,但各剂量组间的差异无统计学显著性(P>0.05)。
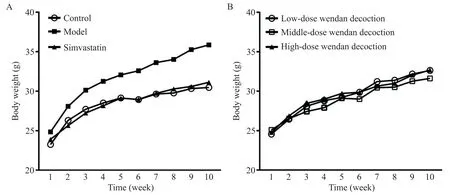
Figure 2.Changing trend of the mouse body weight.A:changing trend of the mouse body weight in control group,model group,and simvastatin group;B:changing trend of the mouse body weight in low-,middle-and high-dose Wendan decoction groups.Mean±SD. n=15.图2 小鼠体重的变化趋势
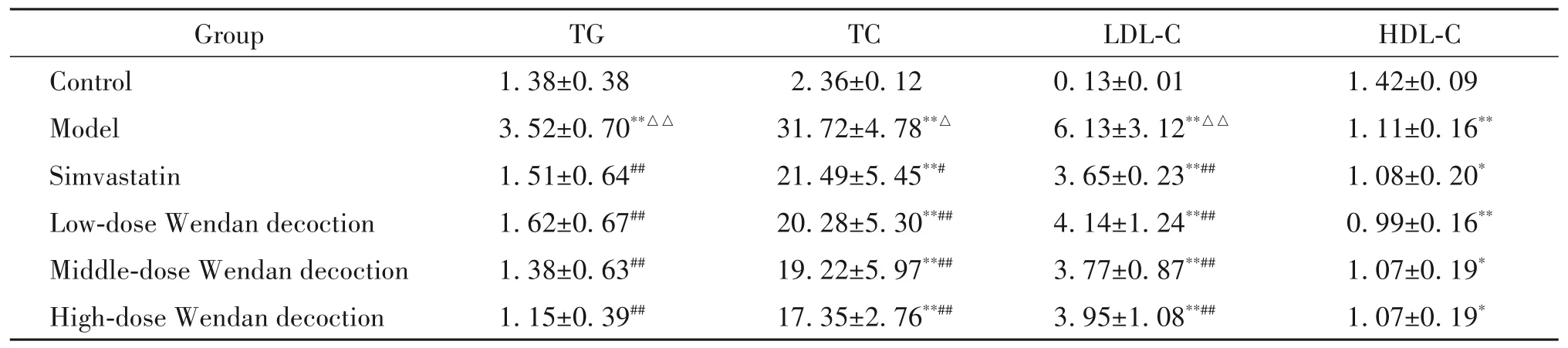
表1 小鼠血脂水平Table 1.Serum lipid levels of the mice(mmol/L.Mean±SD. n=6)

Figure 3.Atherosclerotic plaque buildup in whole aorta(oli red O staining)and quantitative analysis of lesion area.Mean±SD. n=5.#P<0.05,##P<0.01 vs model group.图3 主动脉整体斑块的油红O染色和定量分析
4 温胆汤对ApoE-/-小鼠主动脉根部斑块形成的影响
如图4 所示,对照组小鼠主动脉内壁边缘平整,无斑块;模型组小鼠主动脉内壁可见明显斑块凸起,斑块内可见脂质空泡。定量分析结果显示,模型组小鼠主动脉根部斑块占比达(32.55±1.45)%;辛伐他汀组斑块占比为(20.55±3.81)%,与模型组相比显著降低(P<0.05);中、高剂量温胆汤组斑块占比分别为(20.98±1.87)%和(21.27±2.21)%,与模型组比较显著降低(P<0.05),而低剂量温胆汤干预后主动脉根部斑块占比为(26.56±8.21)%,与模型组比较差异无统计学显著性(P>0.05);辛伐他汀组与各剂量温胆汤组比较差异无统计学显著性(P>0.05);各剂量温胆汤组中,中剂量组斑块占比最低,低剂量组占比最高,但各剂量组间差异无统计学显著性(P>0.05),见图4。
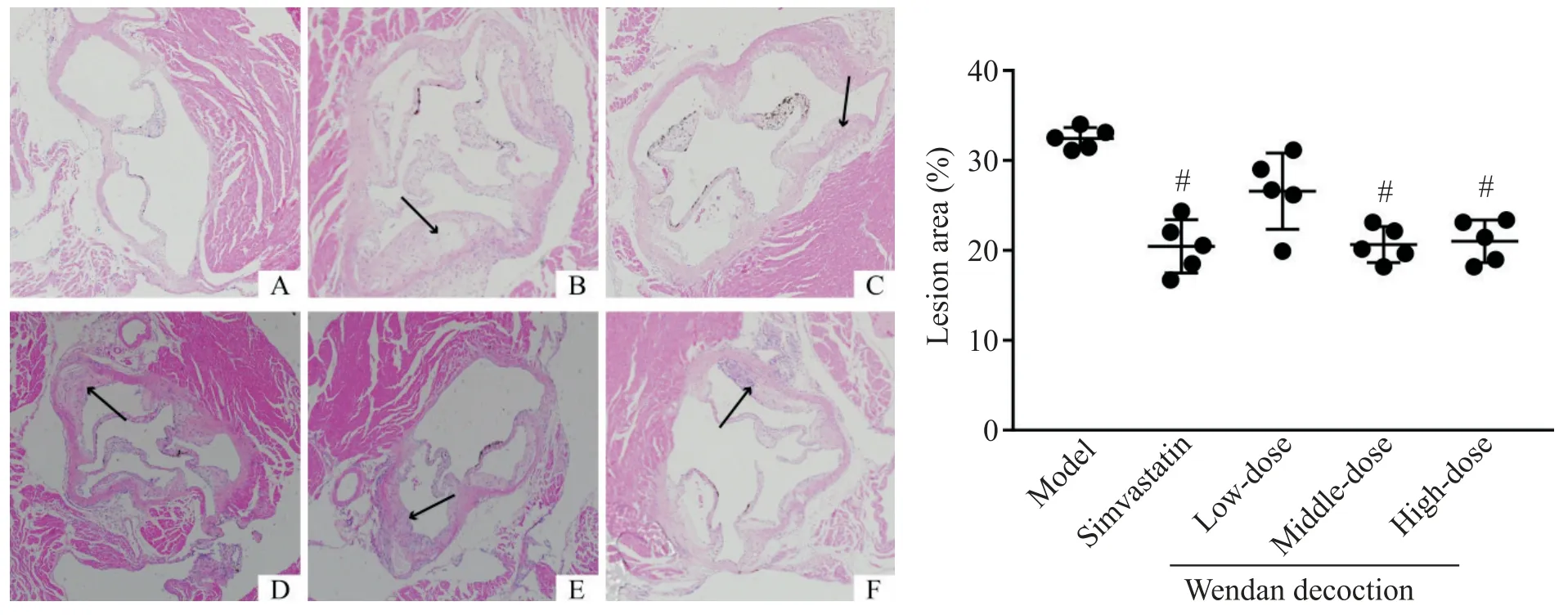
Figure 4.Atherosclerotic plaque buildup in aortic root(HE staining,×100)and quantitative analysis of the lesion area.A:control group;B:model group;C:simavastatin group;D:low-dose Wendan decoction group;E:middle-dose Wendan decoction group;F:high-dose Wendan decoction group.Black arrows indicated the atherosclerotic lesion.Mean±SD. n=5.#P<0.05 vs model group.图4 主动脉根部斑块的HE染色和定量分析
5 温胆汤对ApoE-/-小鼠主动脉ABCA1和caveolin-1蛋白表达水平的影响
与对照组比较,模型组小鼠主动脉ABCA1 蛋白水平略微升高,但差异无统计学显著性(P>0.05);辛伐他汀组和各剂量温胆汤组ApoE−/−小鼠主动脉ABCA1 蛋白表达水平均显著升高,与对照组和模型组比较差异均有统计学意义(P<0.01);各剂量温胆汤组小鼠主动脉ABCA1 蛋白水平均高于辛伐他汀组,其中低剂量温胆汤组与辛伐他组比较差异无统计学显著性(P>0.05),而中、高剂量温胆汤组与辛伐他汀组比较差异有统计学意义(P<0.05或P<0.01);各剂量温胆汤组间比较结果显示,中剂量温胆汤提高ABCA1 蛋白表达水平的效果最佳,与低剂量温胆汤组比较差异有统计学意义(P<0.01),但与高剂量温胆汤组间的差异无统计学显著性(P>0.05),见图5A。
与对照组比较,模型组小鼠主动脉caveolin-1 蛋白表达水平显著升高(P<0.01),而辛伐他汀组和各剂量温胆汤组主动脉caveolin-1 蛋白水平与对照组比较差异无统计学显著性(P>0.05);与模型组比较,辛伐他汀组和各剂量温胆汤组caveolin-1 蛋白表达水平均显著降低(P<0.01);辛伐他汀组与各剂量温胆汤组小鼠主动脉caveolin-1 蛋白表达水平的差异无统计学显著性(P>0.05);温胆汤组间比较显示,中剂量温胆汤干预后小鼠主动脉caveolin-1 蛋白水平最低,但与低、高剂量温胆汤组比较的差异无统计学显著性(P>0.05),见图5B。
6 温胆汤对ApoE-/-小鼠肝脏SR-BI 和CD36 蛋白表达水平的影响
与对照组相比,模型组小鼠肝脏SR-BI蛋白表达水平的差异无统计学显著性(P>0.05);辛伐他汀组和中、高剂量温胆汤组小鼠肝脏SR-BI蛋白表达水平显著升高,与对照组和模型组比较差异均有统计学意义(P<0.05或P<0.01),而低剂量温胆汤组小鼠肝脏SR-BI 蛋白水平与对照组和模型组比较差异无统计学显著性(P>0.05);辛伐他汀组与各剂量温胆汤组比较差异无统计学显著性(P>0.05);各剂量温胆汤组间比较显示,中剂量温胆汤提高SR-BI蛋白水平的作用最显著,但与低、高剂量温胆汤组比较差异无统计学显著性(P>0.05),见图6A。

Figure 5.The protein levels of ABCA1(A)and caveolin-1(B)in the aorta of mice.Mean±SD. n=6 in A;n=7 in B.**P<0.01 vs control group;##P<0.01 vs model group;△P<0.05,△△P<0.01 vs simvastatin group.图5 小鼠主动脉ABCA1和caveolin-1蛋白表达水平的比较
与对照组比较,模型组和各剂量温胆汤组小鼠肝脏CD36 蛋白水平均显著升高(P<0.05 或P<0.01),而辛伐他汀组与对照组比较差异无统计学显著性(P>0.05);与模型组比较,辛伐他汀干预能够明显降低小鼠肝脏CD36蛋白表达水平,与模型组比较差异有统计学意义(P<0.05),而各剂量温胆汤组与模型组比较差异无统计学显著性(P>0.05);辛伐他组与各剂量温胆汤组比较,差异无统计学显著性(P>0.05);各剂量温胆汤组间比较,差异无统计学显著性(P>0.05),见图6B。

Figure 6.The proteins level of SR-BI(A)and CD36(B)in the liver of the mice.Mean±SD. n=7.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs model group.图6 小鼠肝脏SR-BI和CD36蛋白表达水平的比较
讨 论
本研究发现,温胆汤能够抑制高脂饲料喂养的ApoE−/−小鼠体重增长;降低血清TG、TC 和LDL-C 水平,但对血清HDL-C水平无明显影响;抑制主动脉整体及根部斑块形成;能够增加主动脉ABCA1 蛋白表达水平,降低主动脉caveolin-1 蛋白表达水平;并且增加肝脏SR-BI 蛋白表达水平,但对肝脏CD36 蛋白表达无明显影响。
AS 是以巨噬细胞中脂质积聚并伴发炎症为特征的病变过程。ApoE−/−小鼠的病理改变类似于人类Ⅱ型高脂血症,AS 斑块好发于主动脉瓣、主动脉弓、胸主动脉以及其他主动脉的主要分支点,且晚期病变斑块易出现钙化,ApoE−/−小鼠AS 病理改变可观察到人类患者斑块发展的所有阶段,并且与临床AS 患者病变特征十分相似,被广泛运用于现代高脂血症、冠心病及AS 疾病的研究中[15]。本研究中采用高脂饮食喂养的ApoE−/−小鼠作为AS 疾病模型,相同背景的C57BL/6 小鼠为对照组。小鼠正常饮食适应性喂养1 周后,首次称量体重,结果显示各组别小鼠初始体重基数无显著差异;10周后,末次称量体重结果显示中剂量温胆汤干预能够抑制高脂饲料喂养ApoE−/−小鼠的体重增长。
对小鼠血清血脂水平检测结果显示,温胆汤剂量依赖性降低ApoE−/−小鼠血清TG 和TC 水平。与模型组相比,高剂量温胆汤组TG 水平降低78%,TC 水平降低46%,并且中、高剂量温胆汤药效有优于辛伐他汀的趋势。同时,各剂量温胆汤均显著降低ApoE−/−小鼠血清LDL-C水平,以中剂量温胆汤干预药效最佳,与模型组相比降低了约39%。但各剂量温胆汤干预对小鼠血清HDL-C 水平并未产生明显影响。
此外,对各组小鼠主动脉整体和主动脉根部粥样硬化斑块的病理观察结果显示,温胆汤能够有效抑制主动脉整体及主动脉根部斑块形成,以中剂量温胆汤干预药效最佳,与模型组相比斑块占比分别降低了51%和36%。肥胖和高血脂是AS 疾病公认的危险因素,以上研究结果表明,温胆汤能够显著抑制肥胖,调节血脂异常,并抑制AS病变的进展。
小窝是细胞膜上的特异性内陷结构,对胆固醇有很强的亲和力。caveolin-1是研究小窝结构的标志性蛋白,广泛表达于内皮细胞、平滑肌细胞、脂肪细胞和巨噬细胞等多种组织细胞表面,从而介导小窝结构的各种生物学功能[16]。研究显示,caveolin-1 在调节胞内胆固醇平衡中发挥重要作用,caveolae 结构的缺失可能导致细胞内脂质和胆固醇的沉积,胆固醇外流减少,从而最终导致泡沫细胞形成[17]。然而有研究显示,ApoE−/−小鼠中缺失caveolin-1,对其AS 斑块的发展有抑制作用,当caveolin-1 在ApoE−/−小鼠内皮细胞中重新表达后,AS 病变范围变大[18],其可能的原因是caveolin-1 介导的炎症反应。多项研究均表明,caveolin-1 可以抑制多种炎症因子的表达,抑制炎症作用。而过量表达的caveolin-1 可促进单核细胞分化为巨噬细胞,促进内皮增生和炎症反应,从而加速AS 病变进程[19-20]。有学者认为,caveo⁃lin-1所介导的小窝结构可能是炎症应答和胆固醇逆转运的共同分子平台,脂质沉积可诱发炎症反应,炎症反应则加剧脂质积聚[21]。因此,维持caveolin-1 的正常表达水平尤为重要。我们研究发现,高脂饲料喂养10 周的ApoE−/−小鼠主动脉caveolin-1 表达水平异常增高,而温胆汤能有效降低caveolin-1 蛋白表达水平,与对照组比较无显著差异,说明温胆汤能扭转ApoE−/−小鼠主动脉caveolin-1蛋白的异常高水平表达状态,有助于caveolin-1正常水平的维持。
ABCA1 也称胆固醇流出调节蛋白,广泛表达于参与脂质转运的组织细胞中,如肝脏、小肠和巨噬细胞等,其以ATP 为能源介导细胞内胆固醇外流至外周HDL-C,从而密切参与细胞内脂质的清除[22]。研究显示,ABCA1基因敲除小鼠尽管体内HDL-C 水平正常,其AS 病变仍持续加重[23]。而ABCA1基因过表达小鼠AS 病变减轻[24]。本研究发现,温胆汤干预后,小鼠主动脉ABCA1 蛋白表达水平显著增高,以中剂量组药效最佳,约为模型组的2.2 倍。此外,模型组ApoE−/−小鼠主动脉ABCA1蛋白水平略高于对照组。已有研究表明,ABCA1 表达水平与细胞内胆固醇含量呈正相关,细胞内氧化型LDL 及乙酰化LDL均可促进ABCA1 mRNA和蛋白的表达,且AS早期病变处巨噬细胞聚集区可发现ABCA1的表达,而AS晚期病变处巨噬细胞聚集区则不表达ABCA1[25],所以我们推测模型组小鼠ABCA1 的增加可能是因为ApoE−/−小鼠体内高胆固醇水平引起ABCA1代偿性上调的结果。
SR-BI是胆固醇双向转运蛋白,在巨噬细胞内表达,介导细胞内胆固醇外流至胞外HDL 处。而肝脏表达的SR-BI 能够选择性识别循环血流中的HDL,介导胆固醇转运至肝脏,在机体胆固醇逆转运过程发挥重要作用[26]。研究表明,肝脏过表达SR-BI可加速循环血流中HDL 的清除,并且促进机体胆固醇排泄,降低组织和血液循环中胆固醇水平,从而抑制AS 病变的进展[27]。本研究发现,中、高剂量温胆汤能够明显促进ApoE−/−小鼠肝脏SR-BI蛋白表达,约为模型组的1.5 倍。同时我们认为温胆汤对ApoE−/−小鼠血清HDL水平上调趋势不显著可能与其促进肝脏SR-BI表达有关。
CD36 也被认为是脂类和脂肪酸的受体,在相关的心脏活动中发挥作用[28]。在啮齿类动物中,CD36依赖性的脂肪酸传感已被发现,脂类传感器是CD36的新功能。相关研究表明,CD36作为脂肪酸的转运体主要参与长链脂肪酸的转运,在CD36基因敲除小鼠中心脏、骨骼肌及脂肪组织长链脂肪酸的吸收量减少了约50%~80%,将CD36 重新转入CD36基因敲除小鼠后一段时间,长链脂肪酸的吸收则恢复至正常水平[29]。在ApoE−/−小鼠肝脏CD36 蛋白水平的检测中,我们发现温胆汤并未明显影响CD36蛋白的表达。还有研究表明,一些显著促进胆固醇逆转运过程的激动剂,如LXR 激动剂、PXR 激动剂等,由于将过量的脂类转运集中至肝脏,并增加肝脏自身脂肪的合成,有诱发肝脏脂肪性病变的风险[30]。因此通过观察肝脏脂肪酸转运的主要蛋白CD36,可在一定程度上表明温胆汤在促进ApoE−/−小鼠胆固醇逆转运过程中诱发肝脏脂肪性病变副作用的风险,我们的研究结果显示,各剂量温胆汤组小鼠肝脏CD36蛋白水平与模型组相比有降低趋势,说明温胆汤在促进小鼠机体胆固醇逆转运的同时,未表现出类似胆固醇激动剂上调CD36 蛋白而诱发肝脏脂肪病变的风险。
综上所述,我们认为温胆汤干预可有效降低高脂饲料喂养的ApoE−/−小鼠体重增长及血清TG、TC 和LDL-C 水平,并抑制主动脉粥样硬化斑块的形成。相关机制可能是:温胆汤提高小鼠主动脉ABCA1 表达水平,维持主动脉caveolin-1 蛋白表达的正常水平,并且促进肝脏SR-BI 蛋白表达,从而促进主动脉病变处胆固醇逆转运过程,抑制主动脉胆固醇沉积。此外,温胆汤在促进胆固醇转运至肝脏的同时,并未显著增加小鼠肝脏CD36蛋白表达水平,可能在一定程度上避免现有胆固醇逆转运相关激动剂诱发肝脏脂肪性病变的风险。

